
Биохимия лекция
.docxБиологическая химия. Углеводы, липиды как биогенные соединения, строение и физико-химические свойства аминокислот и белков. Рекомендованная литература: березов Т.т. молекула воды состоит из, удивительно, водорода и кислорода. Вода свободная, в составе гидратных оболочек. Вода – растворитель, прослойка в мембранах, способствует тургору, регулирует тепловой баланс, переносит вещества. pH – отрицательный десятичный логарифм концентрации ионов водорода. pH физиологических жидкостей: 7,34-7,42 – кровь. Слюна 6,8-7,2. Желудочный сок – 1,5-2. Моча – 5,5-6,5. Кишечный сок – 7,5-9. Работа буферных систем поддерживает pH. Основной буфер – бикарбонатный, гемоглобиновый – внутриклеточный, до 35%, белковый – до7%. Фосфатный буфер – преимущественно в костной ткани, моче, внутриклеточной жидкости.
 Изоэлектрическая
точка – суммарный заряд молекул
амфотерных электролитов, находящихся
в этой среде, равен нулю. Является одним
из основных показателей, определяющих
электрохимические свойства. Углеводы.
Нужны 400-500г углеводов ежедневно.
Углеводы: моно(не подвергаются гидролизу),
олиго, полисахариды. Если карбонильная
группа на конце, это альдозы. Если в
середине, это кетозы. В природе
распространены пентозы и гексозы. Рибоза
и дезоксирибоза – главные моносахариды,
также глюкоза – наиболее распространенная
гексоза. Сложный углевод животных –
гликоген, растений – крахмал. Большая
часть глюкозы находится в крови,
концентрация 3-6 миллимоль/литр.
Полисахариды – сотни и тысячи остатков
глюкозы. Гомо- и гетерополисахариды.
Гликоген, крахмал, клетчатка. Расщепление
происходит под воздействием мальтазы.
Клетчатка АКА целлюлоза – тоже
растительный полисахарид, не переваривается
в организме человека. Но улучшает
перестальтику, выводит токсины. Гликоген
– резервный углевод. Гетерополисахариды
– гиалуроновая кислота, гепарин.
Изоэлектрическая
точка – суммарный заряд молекул
амфотерных электролитов, находящихся
в этой среде, равен нулю. Является одним
из основных показателей, определяющих
электрохимические свойства. Углеводы.
Нужны 400-500г углеводов ежедневно.
Углеводы: моно(не подвергаются гидролизу),
олиго, полисахариды. Если карбонильная
группа на конце, это альдозы. Если в
середине, это кетозы. В природе
распространены пентозы и гексозы. Рибоза
и дезоксирибоза – главные моносахариды,
также глюкоза – наиболее распространенная
гексоза. Сложный углевод животных –
гликоген, растений – крахмал. Большая
часть глюкозы находится в крови,
концентрация 3-6 миллимоль/литр.
Полисахариды – сотни и тысячи остатков
глюкозы. Гомо- и гетерополисахариды.
Гликоген, крахмал, клетчатка. Расщепление
происходит под воздействием мальтазы.
Клетчатка АКА целлюлоза – тоже
растительный полисахарид, не переваривается
в организме человека. Но улучшает
перестальтику, выводит токсины. Гликоген
– резервный углевод. Гетерополисахариды
– гиалуроновая кислота, гепарин.
 Физико-химические
свойства углеводов. Моносахариды –
бесветные кристаллы, сладкие, растворимы
в воде, плохо растворимы в воде,
нерастворимы в эфирах, растворы не
проводят ток. Дисахариды проводят ток,
полисахариды не растворяются в холодной
воде. функции углеводов: энергетическая,
накопительная, структурная, регуляторная.
Физико-химические
свойства углеводов. Моносахариды –
бесветные кристаллы, сладкие, растворимы
в воде, плохо растворимы в воде,
нерастворимы в эфирах, растворы не
проводят ток. Дисахариды проводят ток,
полисахариды не растворяются в холодной
воде. функции углеводов: энергетическая,
накопительная, структурная, регуляторная.
Холестерин нужен 100-500 мг. Помогает синтезировать витамин Д, входит в состав клеточных мембран, синтез стероидов.
 Жирные
кислоты – углеродная цепь с карбоксильной
группой на конце, нерастворимы в воде.
Бывают насыщенными и ненасыщенными.
Животные жиры – предельные насыщенные
жирные кислоты. Функции насыщенных:
дают энергию, синтез холестерина,
масляная кислота участвует в генетической
регуляции, каприновая кислота – прекурсор
антивирусных веществ. Ненасыщенные:
олеиновая, линолевая кислоты. Не
синтезируются в организме, поступают
с пищей, суточная потребность примерно
15 грамм. Функции: предшественники
гормонов, входят в состав гликолипидов,
обеспечивают функцию клеточных мембран,
выводят лишний холестерин из организма,
входят в состав витамина Ф, защищают
витамин А от окисления. Биохимические
функции липидов: энергетическая,
резервная, структурная,
регуляторная(гормональная), защитная,
терморегуляторная, растворяющая.
Жирные
кислоты – углеродная цепь с карбоксильной
группой на конце, нерастворимы в воде.
Бывают насыщенными и ненасыщенными.
Животные жиры – предельные насыщенные
жирные кислоты. Функции насыщенных:
дают энергию, синтез холестерина,
масляная кислота участвует в генетической
регуляции, каприновая кислота – прекурсор
антивирусных веществ. Ненасыщенные:
олеиновая, линолевая кислоты. Не
синтезируются в организме, поступают
с пищей, суточная потребность примерно
15 грамм. Функции: предшественники
гормонов, входят в состав гликолипидов,
обеспечивают функцию клеточных мембран,
выводят лишний холестерин из организма,
входят в состав витамина Ф, защищают
витамин А от окисления. Биохимические
функции липидов: энергетическая,
резервная, структурная,
регуляторная(гормональная), защитная,
терморегуляторная, растворяющая.
Б елки.
Высокомолекулярные азотосодержащие
соединения, построены из аминокислотных
остатков. Бывают простые и сложные,
глобулярные и фибриллярные, полноценные,
неполноценные, альбумины(), глобулины(в
растворах солей). В организме человека
обнаружено 5 миллионов белков. Способны
образовывать буферные системы и
коллоидные растворы. Потребность 1,5
г на килограмм тела. 10 аминокислот
синтезируются, остальные – незаменимые.
Полноценные белки – содержащие все
незаменимые аминокислоты. Яйца, рыба,
молоко, творог, мясо. Аминокислоты
содержат карбоксильную и аминогруппу.
Амфотерные соединения. Классификаций
много. Значение: строительные блоки
белков. Составные части пептидов,
предшественники низкомолекулярных
биоактивных веществ, предшественники
азотных соединений, участвуют в синтезе
медиаторов нервной системы. Пептиды –
вещества из аминокислот с пептидными
связями. Функции: пищеварение, защита,
елки.
Высокомолекулярные азотосодержащие
соединения, построены из аминокислотных
остатков. Бывают простые и сложные,
глобулярные и фибриллярные, полноценные,
неполноценные, альбумины(), глобулины(в
растворах солей). В организме человека
обнаружено 5 миллионов белков. Способны
образовывать буферные системы и
коллоидные растворы. Потребность 1,5
г на килограмм тела. 10 аминокислот
синтезируются, остальные – незаменимые.
Полноценные белки – содержащие все
незаменимые аминокислоты. Яйца, рыба,
молоко, творог, мясо. Аминокислоты
содержат карбоксильную и аминогруппу.
Амфотерные соединения. Классификаций
много. Значение: строительные блоки
белков. Составные части пептидов,
предшественники низкомолекулярных
биоактивных веществ, предшественники
азотных соединений, участвуют в синтезе
медиаторов нервной системы. Пептиды –
вещества из аминокислот с пептидными
связями. Функции: пищеварение, защита,
Уровни организации белков: первичный(пептидные), вторичный(водородные), третичный(дисульфидные и ионные), четвертичный(водородные, электростатическое взаимодействие). Функции белков: защитная, транспортная, энергетическая, сократительная, опорная, регуляторная, строительная. Физические свойства аминокислот: оптически активны(асимметричны), имеют стереоизомеры, амфотерны, разная растворимость. Белки: полимеры, в коллоидном состоянии, амфотерны, денатурируют, высокая гидрофильность, цветные реакции(биуретовая, ксантопротеиновая).
Физическая денатурация: повышение температуры, УФ излучение, механическое воздействие. Химическая денатурация: кислоты, щелочи, органические растворители, алкалоиды, тяжелые металлы. Ренатурация: высаливание(добавление нейтральных солей, слипание молекул), воодотнимающие средства(отнятие гидратной оболочки белка, но не заряда, растворимость снижается, но денатурация не наступает)
Ферментный катализ. Роль витаминов в метаболизме.
Ферменты
– вещества белкового происхождения,
катализирующие биохимические процессы.
Биологические особенности: нейтральный
pH, водная среда, температура
до 40 градусов, нормальное атмосферное
давление, высокая скорость реакций.
 Ферменты
не входят в состав конечных продуктов
реакции. Могут проводить те реакции,
которые противоречат законам термодинамике,
ферменты не смещают равновесие.
Номенклатура есть
тривиальная(1.субстрат+аза/2.субстрат+его
хим превращение+аза) и систематическая(название
субстрата, кофермента, тип хим реакции+аза)
цифры в названиях ферментов: 1- класс,
2-подкласс,3-подподкласс,4-порядковый
номер в списке. Пример: L-лактат:
НАД+оксидоредуктаза. 6 классов ферментов:
оксидоредуктазы(восстановительные
реакции), трансферазы(перенос атомов
между молекулами), гидролазы(расщепление
хим.
Ферменты
не входят в состав конечных продуктов
реакции. Могут проводить те реакции,
которые противоречат законам термодинамике,
ферменты не смещают равновесие.
Номенклатура есть
тривиальная(1.субстрат+аза/2.субстрат+его
хим превращение+аза) и систематическая(название
субстрата, кофермента, тип хим реакции+аза)
цифры в названиях ферментов: 1- класс,
2-подкласс,3-подподкласс,4-порядковый
номер в списке. Пример: L-лактат:
НАД+оксидоредуктаза. 6 классов ферментов:
оксидоредуктазы(восстановительные
реакции), трансферазы(перенос атомов
между молекулами), гидролазы(расщепление
хим. 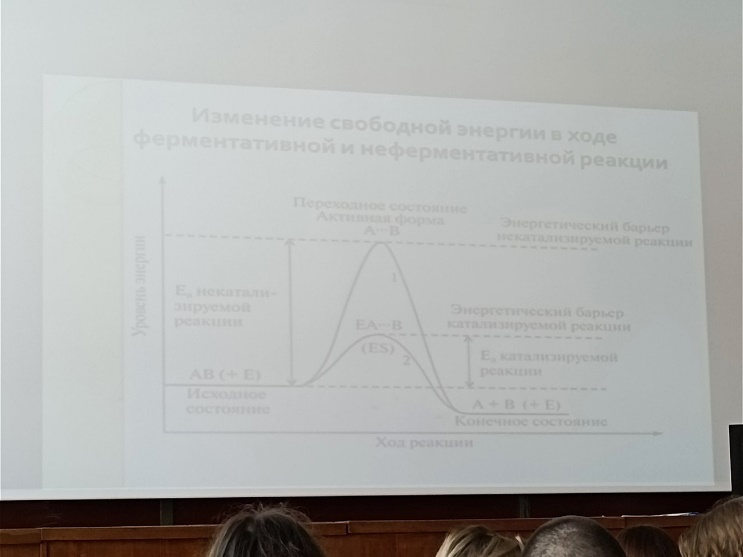 связей),
лиазы(синтазы) расщепление или образование
связей, изомеразы, лигазы(реакции
соединения). Энергия активации – это
количество энергии в калориях, которое
необходимо для того, чтобы все молекулы
1 моля вещ-ва при определенной температуре
достигли переходного состояния,
соответствующего вершине энергетического
барьера. Концентрация фермента должна
быть меньше концентрации субстрата.
Регуляция скорости ферментных реакций:
увеличение количества субстрата/фермента,
повышение температуры, повышение pH,
использование катализатора. Этапы
ферментативной реакции: 1. Присоединение
субстрата. 2. Образование ферментно-субстратного
комплекса. 3. Преобразование комплекса
в переходный комплекс. 4. Превращение
переходного комплекса в комплекс
фермент+продукт. 5. Отделение конечных
продуктов. Механизмы катализа:
кислотно-основный: в активном центре
фермента находятся группы специфичных
аминокислотных остатков. Ковалентный
катализ – образование с помощью
ковалентных связией нестабильных
соединений. Типы ферментных реакций:
связей),
лиазы(синтазы) расщепление или образование
связей, изомеразы, лигазы(реакции
соединения). Энергия активации – это
количество энергии в калориях, которое
необходимо для того, чтобы все молекулы
1 моля вещ-ва при определенной температуре
достигли переходного состояния,
соответствующего вершине энергетического
барьера. Концентрация фермента должна
быть меньше концентрации субстрата.
Регуляция скорости ферментных реакций:
увеличение количества субстрата/фермента,
повышение температуры, повышение pH,
использование катализатора. Этапы
ферментативной реакции: 1. Присоединение
субстрата. 2. Образование ферментно-субстратного
комплекса. 3. Преобразование комплекса
в переходный комплекс. 4. Превращение
переходного комплекса в комплекс
фермент+продукт. 5. Отделение конечных
продуктов. Механизмы катализа:
кислотно-основный: в активном центре
фермента находятся группы специфичных
аминокислотных остатков. Ковалентный
катализ – образование с помощью
ковалентных связией нестабильных
соединений. Типы ферментных реакций:
 Преимущества
реакций с участием ферментов: сближение
и ориентация субстрата стабилизация
процесса. Ферменты делятся на простые
и сложные. Простые состоят только из
аминокислот, сложные ферменты(коферменты)
имеют в составе небелковые части(кофактор).
Вещества-коферменты: ионы металлов и
неметаллом, гемы, кислоты, водорастворимые
витамины, нуклеотиды. В ферменте
выделяется активный центр(аминокислотные
остатки), каталитический участок, где
происходит связывание, якорный участок,
участвует за ориентацию субстрата,
аллостерический центр – центр регуляции
активности фермента, пространственно
отделен от активного центра и имеется
не у всех ферментов, активаторы и
ингибиторы могут присоединяться к этому
центру. Изоферменты – молекулярные
формы одного фермента, возникшие в
результате небольших различий в первичной
структуре фермента. Мультиферментные
комплексы – несколько ферментов,
соединенных вместе, осуществляющих
цепочку реакций, благодаря им ускоряется
скорость превращения молекул. Специфичность
ферментов основана на комплиментарности
субстрата и активного центра, они
высокоспецифичны. Стереоспецифичность
– катализ одного изомера, абсолютная
– катализ только одного вещества,
групповая – катализ субстратов с общими
структурными особенностями, относительная
групповая специфичность – превращение
субстратов с разными группами. Механизм
специфичности. В ее основы лежат 2
гипотезы. Первая: гипотеза Фишера(ключ-замок),
гипотеза Кошланда (модель рука-перчатка,
подразумевается гибкость активного
центра). Активность фермента – изменение
субстрата под влиянием фермента в
единицу времени. Единицы активности
ферментов.
Преимущества
реакций с участием ферментов: сближение
и ориентация субстрата стабилизация
процесса. Ферменты делятся на простые
и сложные. Простые состоят только из
аминокислот, сложные ферменты(коферменты)
имеют в составе небелковые части(кофактор).
Вещества-коферменты: ионы металлов и
неметаллом, гемы, кислоты, водорастворимые
витамины, нуклеотиды. В ферменте
выделяется активный центр(аминокислотные
остатки), каталитический участок, где
происходит связывание, якорный участок,
участвует за ориентацию субстрата,
аллостерический центр – центр регуляции
активности фермента, пространственно
отделен от активного центра и имеется
не у всех ферментов, активаторы и
ингибиторы могут присоединяться к этому
центру. Изоферменты – молекулярные
формы одного фермента, возникшие в
результате небольших различий в первичной
структуре фермента. Мультиферментные
комплексы – несколько ферментов,
соединенных вместе, осуществляющих
цепочку реакций, благодаря им ускоряется
скорость превращения молекул. Специфичность
ферментов основана на комплиментарности
субстрата и активного центра, они
высокоспецифичны. Стереоспецифичность
– катализ одного изомера, абсолютная
– катализ только одного вещества,
групповая – катализ субстратов с общими
структурными особенностями, относительная
групповая специфичность – превращение
субстратов с разными группами. Механизм
специфичности. В ее основы лежат 2
гипотезы. Первая: гипотеза Фишера(ключ-замок),
гипотеза Кошланда (модель рука-перчатка,
подразумевается гибкость активного
центра). Активность фермента – изменение
субстрата под влиянием фермента в
единицу времени. Единицы активности
ферментов.  Константа
михаэлиса: численно равна концентрации
субстрата, при которой достигается
половина максимальной скорости.
Константа, не меняется при изменении
количества субстрата.
Константа
михаэлиса: численно равна концентрации
субстрата, при которой достигается
половина максимальной скорости.
Константа, не меняется при изменении
количества субстрата.
Ингибирование: обратимое(конкурентное-вызвано веществами, похожими на структуру фермента, и неконкурентное – вызвано веществами, не имеющими структурного сходства с субстратом, а с другими местами молекулы фермента) и необратимое(необратимое связывание или разрушение функциональной группы фермента). Виды ковалентной модификации каталитической активности: частичный протеолиз, ассоциация-диссоциация, фосфорилирование-дефосфорилирование. Витамины – низкомолекулярные органические соединения,которые не синтезируются в организме человека и животных, присутствуют в пище в малых количествах, выполняют роль коферментов. Каждый витамин имеет название буквенное, от автора, открывшего его, и химическое. Так же есть названия от заболеваний, вызванных их недостатком. Жирорастворимые: а,д,е,к,ф. водорастворимые: б1-б6, б12 Ш, ц. черные – витамины, красные – витаминоподобные вещества.
 авитаминоз
– недостаточное поступление витаминов
в организм, гиповитаминоз – нарушение
их всасывания при патологиях жкт,
гипервитаминоз – чрезмерное потребление
витаминов. Причины авитаминоза: экзогенные
и эндогенные(повышенная потребность,
нарушения работы жкт).
авитаминоз
– недостаточное поступление витаминов
в организм, гиповитаминоз – нарушение
их всасывания при патологиях жкт,
гипервитаминоз – чрезмерное потребление
витаминов. Причины авитаминоза: экзогенные
и эндогенные(повышенная потребность,
нарушения работы жкт).
Водорастворимые витамины: тиамин. Хлеб, злаки, дрожжи. 2-3мг. Пиримидиновое кольцо, коферментная форма – тиаминдифосфат. Всасывается в тонком кишечнике, находится в мышцах и печени. Роль – участие в реакциях декарбоксилирование кетокислот, перенос гидроксильных групп. При недостатке нарушается углеводный обмен – болезнь «бери-бери». Б2 – рибофлавин, витамин роста. Источники: печень, почки, молоко. Может образовываться кишечными бактериями. 2-20 мг. Коферментная форма дополнительно содержит фосфорную кислоту. В кишечнике. Функции: участие в овр, при недостатке – нарушения в работе дыхательной цепи и цикла трикарбоновых кислот, обмен нуклеиновых кислот. Первый признак – краснота в уголках рта. Б3 – пантотеновая кислота.
|
|
Коферментная форма |
где |
Сколько |
Роль |
Что нарушается |
B1 |
тиамин |
Пиримидиновое кольцо, тиаминдифосфат |
Хлеб, злаки, дрожжи |
2-3мг |
Декарбоксилирование кислот |
Углеводный обмен, бери-бери |
B2 |
рибофлавин |
+фосфорная кислота |
Молоко, печень |
2-20мг |
Участие в овр |
нарушения в работе дыхательной цепи и цикла трикарбоновых кислот, обмен нуклеиновых кислот. Первый признак – краснота в уголках рта. Б3 – пантотеновая кислота.
|
Б3 |
Пантотеновая кислота |
Коэнзим а |
|
10-15мг |
Реакции переноса ацильных групп |
Окисление кетокислот, биосинтез |
B5, PP |
никотинамид |
никотинадениндинуклеатид |
Рыба, бобовые, молоко, черный хлеб |
20-25мг |
Участие в овр, в дыхательной цепи |
Нарушение цикла трикарбоновых кислот, синтез жирных кислот, стероидных гормонов, пеллагра. Появление язв |
B6 |
Пиридоксин (антидермаатитный) |
|
Печень, почки, бактерии кишечника |
1,5-2мг |
Нарушение синтеза белков, гемов |
Пиридоксинзависимая анемия |
B12 |
кобаламин |
4 пирольных кольца |
Печень, рыба |
2,5-5мг |
Изомеризация |
Пернициозная анемия |
Bc |
Фолиевая кислота |
Тетрагидрофолиевая кислота |
Дрожжи, желток, печень, кишечная микрофлора |
400микрограм |
Перенос углеродных групп |
Синтез аминокислот, белков, углеводов. Анемия, |
Н |
Биотин |
|
Печень, горох, грибы, цветная капуста |
|
Карбоксилирование, декарбоксилирование |
Синтез жирных кислот |
С |
Аскорбиновая кислота |
Производное глюкозы. |
Овощи, фрукты, шиповник, смородина |
От 100мг |
Участвует в гидроксилировании, антиоксидант, |
Синтез коллагена, адреналина, коллагена, серотонина, всасывание железа. Цинга. |
Р |
биофлаваноиды |
Производные флавана |
Зелень, черноплодная рябина, ягоды |
|
Связывают ионы тяжелых металлов, регулируют синтез коллагена, антиоксиданты, ингибирование гиалуронидазы |
|
|
|
|
|
|
|
|
Жирорастворимые витамины:
А |
ретинол |
Похож на каратиноиды |
Печень, морковь, облепиха, морковь, томаты |
1-2,5мг |
Антиоксидант, регуляция эксперссии генов, в фотохимическом акте зрения |
Куриная слепота, родопсин |
|
каратиноиды |
8 изопреновых остатков. Наличие хромофора с двойными связями, от них и зависит наличие окраски |
Водоросли, грибы, высшие растения |
|
Антиоксиданты, поглощение света, фотопротекторная, натуральные пигменты. |
|
D |
кальциферол |
Представлен 2 формами: эргокальциферол и холекальциферол |
Дрожжи, сливки, желток, синтез в коже |
12-25 дети, у взрослых меньше |
Иммуномодулятор, рост и деление клеток. Повышает кальций и фосфор в клетке, |
Нарушение минерализации костей, рахит, остеомаляция. Остеопороз |
Е |
токоферол |
Кольцо + изопреновая цепь. |
Растительные масла, проросшие зерна, яйца |
|
Антиоксидант, антигипоксант, иммунный ответ |
Повышается концентрация активных радикалов*, проницаемость мембран. |
К |
филлохинон |
Филлохинон(к1), менахинон(к2) |
Капуста, шпинат, тыква, арахис |
2мг |
Стимул факторов свертывание, кофермент, карбоксиллирование |
Кровоточивость, геморрагическая болезнь |
F |
Линолевая/ линоленовая кислота |
Полиненасыщенные жирные кислоты |
|
5-10мг |
Часть фосфолипидов мембран, защита витамина А |
Воспаление кожи, иммунодефицит, атеросклероз, поражения почек и печени |
*Свободный радикал – молекула или ее часть, содержащая неспаренный электрон
