
- •Вопросы к экзамену
- •Предмет химии. Химия и окружающая среда. Связь химии с медициной.
- •1.1) Предмет химии. Химия и окружающая среда
- •1.2) Химия и медицина
- •2.1) Основные понятия термодинамики
- •2.2. Типы термодинамических систем
- •2 .3)Параметры системы
- •2.4) Термодинамический процесс
- •3.1. Первое начало термодинамики
- •3.2) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •3.3) Закон Гесса.
- •3.4) Применение первого начала термодинамики к биосистемам.
- •4.1) Энергетические эффекты химических реакций. Факторы, влияющие на энергетический эффект химической реакции.
- •4.2) Термохимические уравнения.
- •4.3) Теплота и энтальпия химической реакции.
- •4.3) Закон Гесса и следствия из него.
- •5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •5.1) Второе начало термодинамики
- •5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
- •5.3) Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •6.1) Изобарный потенциал реакции (свободная энергия Гиббса)
- •6.2) Критерий самопроизвольности реакций.
- •6.3) Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
- •7.1. Скорость химической реакции (средняя и истинная).
- •7.2. Закон действующих масс (к.Гульдберг и п.Вааге)
- •7.3. Молекулярность и порядок химических реакций.
- •Порядок реакции
- •7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
- •7.5. Факторы, влияющие на скорость химической реакции.
- •8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
- •8.1) Энергия активации Уравнение Аррениуса
- •8.2) Экспериментальное определение энергии активации
- •8.3) Катализ (гомогенный, гетерогенный).
- •Особенности катализатора
- •8.4) Автокатализ
- •8.5) Ферментативный катализ
- •8.6) Уравнение Михаэлиса-Ментен.
- •9. Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •10. Общая характеристика растворов. Компонент. Фаза. Гомогенные и гетерогенные системы.
- •11. Способы выражения концентрации растворов.
- •12. Растворимость. Механизмы растворения. Произведение растворимости.
- •Механизм растворения
- •2. Идеальные растворы.
- •3. Закон Рауля и следствия из него.
- •Рауль установил:
- •4. Осмос и осмотическое давление.
- •Закон Вант-Гоффа.
- •Закон Рауля применим для растворов неэлектролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
- •Роль осмоса в биологических системах. Осмотическое давление крови человека – 740 – 780 кПа
- •14. Процесс электролитической диссоциации как взаимодействие веществ.
- •15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
- •18. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •19. Автопротолиз. Ионное произведение воды. РН.
- •1.Автопротолиз
- •2.Ионное произведение воды
- •20. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчет рН.
- •20.1) Гидролиз по катиону и аниону. Необратимый гидролиз
- •21. Буферные растворы, природные буферные системы. Расчет рН буферных систем, буферная ёмкость.
- •Расчет рН буферных систем
- •22. Кислоты и основания по Льюису.
- •23. Гетерогенные равновесия. Произведение растворимости.
- •24. Химическая связь: типы связи, механизмы образования, характеристики.
- •Типы связи
- •Механизмы образования химической связи
- •25. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1. Комплексные соединения (кс). Строение кс.
- •2. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1.Номенклатура кс
- •2.Классификация кс
- •3.Характер связи в кс
- •26. Диссоциация комплексных ионов. Константа нестойкости (устойчивости). Комплексообразование в организме.
- •26.1) Диссоциация комплексных ионов
- •26.2) Константа нестойкости (устойчивости).
- •Чем меньше Кнест, нет более прочно кс
- •26.3) Комплексообразование в организме.
- •27. Изомерия кс. Комплексообразование в организме. Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины.
- •Комплексообразование в организме.
- •28. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •29. Овр и их биологическая роль. Редокс-равновесия и редокс-процессы. Разновидности редокс-реакций. Электродные потенциалы, уравнение Нернста. Эдс гальванического элемента.
- •Классификация овр
- •Прогнозирование направления редокс-процессов по величинам редокс-потенциалов
- •Константа окислительно-восстановительного процесса
- •33. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •34. Методы очистки коллоидных растворов. Диализ, электродиализ, ультрафильтрация.
- •35. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •36. Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •37. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди. Взаимная коагуляция. Значение коагуляции в медицине. Коллоидная защита и пептизация.
- •Значение в медицине
- •Коллоидная защита и пептизация
- •38. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса.
- •38.1) Поверхностные явления и адсорбция.
- •38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
- •38.3) Изотерма Генри
- •Уравнение Гиббса ( , если сравнивается с водой)
- •40. Поверхностное натяжение и методы его определения.
- •41. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция.
- •42. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
- •43. Применение адсорбционных процессов в медицине.
- •44. Хроматография.
- •45. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
- •45.1) Свойства растворов вмс
- •45.2) Особенности растворения вмс как следствие их структуры.
- •45.3) Форма макромолекул
- •45.4) Механизм набухания и растворения вмс
- •П роцесс набухания количественно характеризуется степенью набухания, α:
- •45.5) Зависимости величины набухания от различных факторов.
- •48. Химия биогенных элементов s- блока.
- •49. Химия биогенных элементов d- блока.
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
- •50. Химия биогенных элементов р- блока.
- •Свойства р-элементов
- •Iiiа – группа
- •Iva группа
- •Viia – группа
38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
Адсорбция бывает:
1) Нелокализованная
2) Локализованная
Мономолекулярная локализованная адсорбция описывается уравнением адсорбции Ленгмюра:
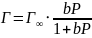 ,
,
Г – величина адсорбции газа,
Г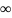 -
максимально возможное количество
адсорбированного вещества при образовании
мономодекулярноо слоя адсорбата, т.е.
предельная адсорбция
-
максимально возможное количество
адсорбированного вещества при образовании
мономодекулярноо слоя адсорбата, т.е.
предельная адсорбция
b – константа адсорбционного равновесия
Р – равновесное давление газа
или
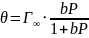 ,
,
где
θ – степень заполнения ( ).
).
Удельная поверхность 1 г адсорбента в уравнении Ленгмюра
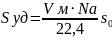
Nа – число Авогадро (6,02*1023 моль-1)
Vм – максимально возможный объем адсобата, полностью покрывающего поверхность 1г адсорбента
22,4л – мольный объем газа (при н.у.)
S0 – площадь, которую занимает 1 молекула адсорбата на поверхности адсобрента.
38.3) Изотерма Генри
При малых концентрациях или давлениях адсорбата величина адсорбции Г пропорциональна давлению или концентрации адсорбата.
Г=КС
(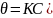
Г=КР (θ = КР)
Уравнение Гиббса ( , если сравнивается с водой)
1)
Г>0, если
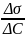 <0
<0
Т.е. положительная адсорбция всегда наблюдается при уменьшении поверхностного натяжения с ростом концентрации адсорбата на поверхности раздела фаз. Такие вещества называются поверхностно-активными(ПАВ)
2)
Г<0, если
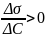 (поверхностно-инактивные вещества)
(поверхностно-инактивные вещества)
3) Г=0, если = 0 (адсорбция вещества отсутствует)
39. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Ориентация молекул в поверхностном слое и структура биомембран.
Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения. Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Однако, ПАВ имеет предел растворимости (так называемую критическую концентрацию мицеллообразования или ККМ), с достижением которого при добавлении ПАВ в раствор концентрация на границе раздела фаз остается постоянной, но в то же время происходит самоорганизация молекул ПАВ в объёмном растворе (мицеллообразование или агрегация). В результате такой агрегации образуются так называемые мицеллы. Отличительным признаком мицеллообразования служит помутнение раствора ПАВ. Водные растворы ПАВ, при мицеллообразовании также приобретают голубоватый оттенок (студенистый оттенок) за счёт преломления света мицеллами. Поверхностно-неактивные вещества стремятся уйти с поверхности в объем жидкости. Это явление называется отрицательной адсорбцией. Они обладают хорошей растворимостью в воде и более высоким поверхностным натяжением. К поверхностно-инактивным веществам относятся все неорганические электролиты – кислоты, щелочи, соли. Вещества, поверхностное натяжение которых равно поверхностному натяжению растворителя, равномерно распределяются между поверхностным слоем и объемом раствора. К таким веществам относится сахар. Поверхностная активность вещества зависит от только от его природы, но и от природы растворителя. Вода обладает большим поверхностным натяжением, и поэтому по отношению к ней многие вещества проявляют поверхностную активность. Спирт обладает значительно меньшим поверхностным натяжением, чем вода. Поэтому некоторые вещества, поверхностно-активные в отношении воды, являются инактивными в отношении спирта. Многие ПАВ, обладающие дифильностью, могут образовывать как истинные, так и коллоидные растворы. Для таких систем существует обратимый переход и соответствующее термодинамическое равновесие . Адсорбция ПАВ из воды на неполярных адсорбентах подчиняется правилу Траубе. Отсюда следует, что чем меньше растворимость вещества в к.-л. среде, тем больше его поверхностная активность на границе с этой средой.
Поверхностно-неактивные вещества не изменяют поверхностное натяжение.
Поверхностно-инактивные вещества незначительно повышают поверхностное натяжение.
Правило Траубе: В гомологичном ряду ПАВ поверхностная активность и адсорбция возрастают при переходе к каждому последующему члену гомологического ряда примерно в 3,2 раза (справедливо только для весьма разбавленных растворов и исключает 3-4 первых члена гомологического ряда).
Ориентация молекул в поверхностном слое и структура биомембран. Молекулы ПАВ, состоящие из полярной группы и неполярного углеводородного радикала, на границе раздела жидкость-газ образуют адсорбционный слой, т.е. пленку, толщиной в одну или несколько молекул. Вероятность образования такого слоя и расположение в нем молекул зависит от их концентрации. При низких концентрациях ПАВ в растворе, а, значит, и в адсорбционном слое, полярная группа дифильной молекулы погружена в воду, а ее гибкий углеводородный радикал лежит на поверхности воды, так как между молекулами воды и атомами H радикала действуют небольшие силы притяжения (водородные связи) (рис. 2.7,а). При увеличении концентрации, молекулы ПАВ сначала объединяются в агрегаты, в которых углеводородные радикалы ориентируются параллельно друг другу и перпендикулярно поверхности воды (рис. 2.7,б), поскольку с увеличением концентрации ПАВ между углеводородными радикалами возрастают гидрофобные связи, которые сильнее единичных водородных, а затем и вся поверхность жидкости покрывается мономолекулярным слоем вертикально ориентированных молекул (рис. 2.7,в), образуя так называемый частокол Ленгмюра. При дальнейшем увеличении концентрации ПАВ поверхностное натяжение раствора практически не изменяется. Зная величину адсорбции Г, при образовании мономолекулярного слоя, можно вычислить площадьS0, занимаемую одной молекулой:
 где
Г∞
- предельное значение адсорбции;
NА
– постоянная Авогадро, равная 6,02•1023
моль-1;
а также толщину монослоя,
исходя из длины молекулы (l), рассчитав
массу вещества на 1 м2:
где
Г∞
- предельное значение адсорбции;
NА
– постоянная Авогадро, равная 6,02•1023
моль-1;
а также толщину монослоя,
исходя из длины молекулы (l), рассчитав
массу вещества на 1 м2:

или, учитывая, что где m – масса вещества; ρ – его плотность; l – длина молекулы. С другой стороны, масса вещества равна произведению предельной адсорбции (Г∞) на молярную массу ПАВ (М), т.е.: Если площадь S0 будет равна 1 м2, то, приравняв оба выражения, получим: Площадь S0, занимаемая молекулой, не зависит от длины углеводородной цепи, а определяется лишь количеством полярных групп дифильных молекул. Кислоты с двумя полярными группами, например, янтарная: НООС-СН2-СН2-СООН, будут занимать в два раза большую площадь, чем однополярная масляная кислота: СН3-СН2-СН2-СООН, с таким же числом атомов углерода. Представления о толщине монослоя, площадях занимаемых молекулами ПАВ, их ориентации в насыщенном адсорбционном слое сыграли значительную роль в развитии учения о структуре и строении биологических мембран. (ред.)
