
- •А. П. Михайловская, е. С. Сашина, в. А. Голубихин
- •191028, Санкт-Петербург, ул. Моховая, 26 Введение
- •1. Токсикологическая характеристика растворителей
- •2. Пожароопасность растворителей
- •3. Правила безопасной работы с растворителями
- •4. Основные физические константы растворителей
- •Лабораторная работа № 1. Определение температуры кипения (ткип)
- •Лабораторная работа № 2. Определение относительной плотности (d420)
- •5. Летучесть органических растворителей
- •Лабораторная работа № 3. Измерение давления пара
- •6. Получение органических растворителей
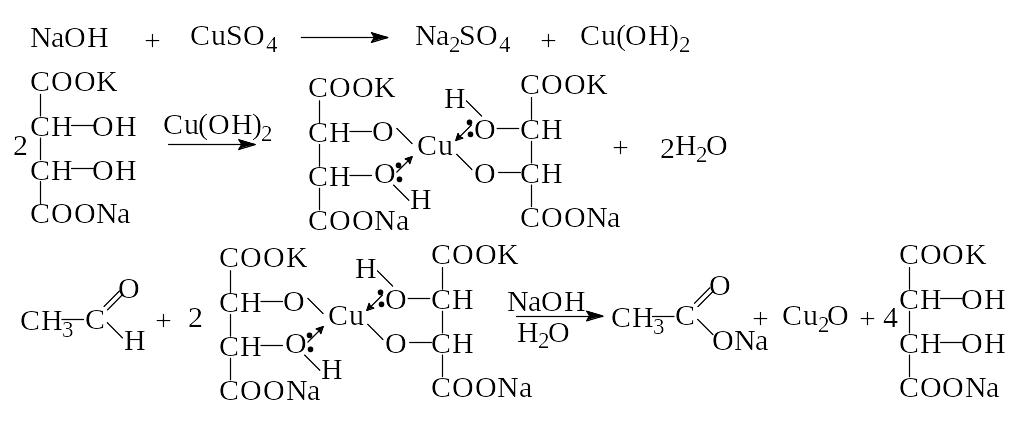
- •Лабораторная работа № 4. Синтез циклогексанона
- •Лабораторная работа № 5. Синтез ацетона
- •Лабораторная работа № 6. Синтез хлороформа
- •Лабораторная работа № 7. Синтез диоксана
- •Лабораторная работа № 8. Синтез дибутилового эфира
- •7. Очистка растворителей
- •Лабораторная работа № 9. Контроль качества растворителей
- •8. Реакционная способность растворителей
- •Лабораторная работа № 10. Основные химические свойства растворителей
- •9. Определение растворимости
- •Лабораторная работа № 11. Определение вещества по его растворимости
- •Лабораторная работа № 12. Одно- и многокомпонентные растворители
- •10. Качественное определение растворимости полимеров
- •Лабораторная работа № 13. Растворимость синтетических карбоцепных полимеров
- •Лабораторная работа № 14. Растворимость целлюлозы и ее производных
- •11. Применение растворителей
- •Лабораторная работа № 15. Химическая чистка изделий с помощью растворителей
- •Краткие указания по приготовлению некоторых реактивов
- •Хлорное железо. Растворяют 17 г FeCl36 h2o в 1 л воды и добавляют 10 мл концентрированной соляной кислоты.
- •Библиографический список
Лабораторная работа № 9. Контроль качества растворителей
Посуда и приборы: штатив с 10 пробирками, водяная баня, делительная воронка, рН-метр.
Реактивы: дистиллированная вода, нитрат серебра (0,2 н.), иодид калия (0,5 н.), крахмальный клейстер, реактив Фелинга 1, реактив Фелинга 2, индикатор бромтимоловый синий.
Растворители: хлороформ (чистый и частично разложившийся), диэтиловый эфир (чистый и загрязненный), перхлорэтилен (чистый и «закисленный»).
Опыт 1. Контроль качества хлороформа
Хлорсодержащие растворители под влиянием света и кислорода воздуха постепенно разлагаются, при этом протекают реакции дегалогенирования и дегидрогалогенирования.
1. Для обнаружения хлористого водорода помещают в две пробирки по 2 капли хлороформа (чистого и частично разложившегося), прибавляют 3 капли дистиллированной воды и 1 каплю 0,2 н. AgNO3. При наличии в хлороформе хлористого водорода появляется белая муть от хлорида серебра:
HCl + AgNO3 → AgCl + HNO3
2. Для выявления свободного хлора в две пробирки помещают по 3 капли хлороформа (чистого и частично разложившегося), добавляют 5 капель дистиллированной воды, 1 каплю 0,5 н. KI и взбалтывают. Если хлороформ испорчен (содержит свободный хлор), то из иодида калия выделится свободный иод, который окрасит нижний слой хлороформа в розовый цвет:
2KI + Cl2 → I2 + 2 KCl
Если розовая окраска получится слабая и возникает сомнение в наличии иода, добавляют в пробирку 1 каплю крахмального клейстера. Синее окрашивание укажет на присутствие иода.
Опыт 2. Контроль качества этилового эфира
Нужно иметь в виду, что даже чистый этиловый эфир под влиянием света и кислорода воздуха окисляется, образуя небольшие количества перекисных соединений. Соединения перекисного типа взрывчаты и часто служат причиной пожаров при работе с эфиром. При окислении эфира образуются также и другие продукты, например уксусный альдегид.
1. Для открытия перекисей наливают в две пробирки 3–4 капли чистого и загрязненного эфира, добавляют в каждую 1 каплю 0,5 н. KI и взбалтывают содержимое пробирок. При наличии перекисных соединений иодид калия окисляется с выделением свободного иода, который окрашивает эфир в желтый цвет.
С2Н5OOС2H5 + 2KI + 2H2O → I2 + 2С2Н5OH + 2KOH
Если окраска трудно различима, добавляют в пробирку 2 капли 0,5 % крахмального клейстера. Синее окрашивание укажет на присутствие иода.
2. Для открытия уксусного альдегида наливают в две пробирки 3–4 капли чистого и загрязненного эфира, добавляют в каждую по 3 капли раствора реактива Фелинга. Для приготовления реактива Фелинга в пробирке смешивают в равных количествах 2 %-й раствор сульфата меди (II) (Фелинг 1) и щелочной раствор сегнетовой соли (Фелинг 2). Пробирку с исследуемым эфиром (после прибавления реактива Фелинга) нагревают на водяной бане. Красное окрашивание указывает на присутствие уксусного альдегида в исследуемом эфире.
Опыт 3. Контроль кислотности перхлорэтилена
По мере эксплуатации перхлорэтилен «закисляется» (частично разлагается), что вызывает необходимость его смены. Уровень закисленности растворителя определяется значением рН водной вытяжки (экстракта). Для химчистки рабочие пределы кислотности перхлорэтилена составляют 7,0–9,5.
Методика определения значения рН
В делительную воронку на 100 мл помещают по 40 мл испытуемого растворителя и дистиллированной воды, закрывают воронку пробкой и энергично встряхивают в течение 1–2 мин. Пробку осторожно открывают и после полного расслоения смеси (2–5 мин) сливают нижний органический слой в отходы, а верхний (водный) анализируют на рН-метре (ионометре).
Экспресс-метод определения кислотности
В две пробирки помещают по 10 мл растворителя (чистого и «закисленного») и 10 мл дистиллированной воды, закрывают пробкой и энергично встряхивают в течение 1–2 мин. Пробку осторожно открывают и после расслоения добавляют 2–3 капли раствора индикатора бромтимоловый синий. Зеленое (зелено-синее) окрашивание говорит о том, что перхлорэтилен пригоден для использования, желтое - о высокой кислотности.
