
диссертации / 128
.pdf
81
Далее мочевой пузырь опорожнялся для исключения экстравезикализа-
ции интрамуральных отделов мочеточников и по нижней полуокружности устья, в подслизистую оболочку мочевого пузыря, параллельно ходу мочеточ-
ника, проводили иглу вглубь на 0,5 – 0,7 см, в позиции на 6 эндоскопических часах, затем подтягивали иглу на себя (перемещая интрамуральный отдел в просвет мочевого пузыря, тем самым, удлиняя его) и в таком положении инъ-
ецировали препарат в объеме 0,3 – 0,7 мл, что зависило от возраста ребенка и степени рефлюкса (зияния устья) по методике STING SubureteralTransurethral Injection (рисунок 24).
Рисунок 24. Эндоскопическая коррекция ПМР с помощью STING методики: а. схема; б. эндоскопическая картина.
При тяжелых степенях ПМР (IV и V степени) мы использовали мето-
дику HIT (Hydrodistention Implantation Technique), когда болюс импланта вво-
дили в по нижней полуокружности устья внутрипросветно (рисунок 25).

82
Рисунок 25. Эндоскопическая коррекция ПМР с помощью HIT методики.
Игла удерживалась в данной позиции в течение 30 секунд, чтобы избе-
жать экструзии препарата. При выведении иглы ни БК, ни КППС не выделя-
лись, если правильно выбрано направление и глубина введения иглы. Эффект от процедуры оценивался визуально: образованный бугорок на вершине имел щелевидное устье в виде перевернутого месяца (рисунок 26).
Рисунок 26. Эндоскопическая коррекция ПМР-введение импланта с формированием бугорка.
Процедуру заканчивали дренированием мочевого пузыря уретральным катетером на 24 ч.
На следующий день выполнялось ультразвуковое исследование с наполненным и опорожненным мочевым пузырем для контроля за состоянием верхних мочевых путей, и при отсутствии признаков нарушения уродинамики ребенок выписывался домой с рекомендацией проведения антибактериальной терапии, при этом целесообразным считаем назначение нитрофуранов в тече-
ние 14 дней или фосфомицина триметамола (монурал) в возрастных дозиров-
ках.
Следует подчеркнуть, что к коррекции рефлюкса мы приступали только после восстановления резервуарной и эвакуаторной функций мочевого пу-
зыря.
83
Пузырно-мочеточниковый рефлюкс выявлен у 46 детей из обеих групп
(у 8 из первой и у 38 из второй). Большое количество диагностированного ПМР у детей 2 группы связано с высокой частотой проведения микционной цистографии – 45 пациентам (82%).
Таблица 14
Распределение больных по степеням ПМР
Степень ПМР |
Количество |
Количество |
% |
|
больных |
мочеточников |
|||
|
|
|||
|
|
|
|
|
I – II ст. |
6 |
8 |
13 |
|
III ст. |
23 |
30 |
50 |
|
IV ст. |
17 |
27 |
37 |
|
Всего |
46 |
65 |
100 |
Эндоскопическое лечение ПМР проведено всего у 39 детей (61 мочеточ-
ник) в обеих группах.
В 1 группе у 3 (5 мочеточников) из 8 детей с выявленным ПМР в воз-
расте 9 – 12 месяцев, в основном, с АМП и АНМП, при сохраняющемся, после восстановления уродинамики нижних мочевых путей, ПМР IV степени, учи-
тывая прогрессирование рефлюкс-нефропатии и некупируемый инфекцион-
ный процесс, была выполнена эндоскопическая коррекция полимером Бычий коллаген. Остальным детям лечение осуществляли уже после 1 года.
Во 2 группе коррекция ПМР выполнена у 36 (53 мочеточника) из 38 де-
тей с выявленым ПМР. Учитывая высокий риск формирования рефлюкс-
нефропатии, эндоскопическую коррекцию ПМР у этой группы больных про-
водили сразу после его выявления, однако это не отменяло проведения лече-
ния, направленного на восстановления уродинамики нижних мочевых путей.
Двум пациентам коррекцию рефлюкса не выполняли в связи в незначительной его степенью (I).
Эндоскопическая имплантация Бычьего коллагена выполнена 20-ти детям второй группы в возрасте от 2 месяцев до 1 года (29 мочеточников) при
84
ПМР II – IV степеней: у 14 пациентов с I – II степенью и у 3-х с III и у 3-х с IV
степенью.
При контрольном обследовании через 6 месяцев рецидив ПМР выявлен у 9 пациентов (14 мочеточников) из обеих групп (39,1 %) с рефлюксом III и IV
степеней, которым коррекция проводилась в возрасте от 9 до 12 месяцев. У 2
детей степень рефлюкса снизилась до II.
В 61% случаев (14 больных, 19 мочеточников) был достигнут положи-
тельный результат – ликвидация рефлюкса и купирование мочевого синдрома.
Это дети с ПМР I – II степени, кому эндоскопическое лечение выполнялось в возрасте от 2 до 7 месяцев.
В нашем исследовании при использовании Бычьего коллагена в качестве объемобразующего вещества, лучшие результаты лечения получены при не-
высоких степенях ПМР у детей в возрасте до 7 месяцев.
Нами проведен статистический анализ при помощи χ2 Пирсона. Если рассчетные значения критерия превышают табличное 3,84 (уровень значимо-
сти α=0,05, т.е. с вероятностью 95%), различия считаются значимыми.
|
|
Таблица 15 |
|
Результаты расчета χ2 Пирсона при коррекции ПМР полимером |
|||
|
Бычий коллаген |
|
|
|
|
|
|
Сравниваемые |
Значения χ2 Пирсона |
Оценка результатов |
|
Степени ПМР |
|||
|
|
||
|
|
|
|
I – II степени |
17,26 |
Различия статистически |
|
|
|
||
III – IV степени |
24,78 |
||
значимы |
|||
|
|
||
I – II и III – IV степени |
67,39 |
||
|
|||
|
|
|
|
При увеличении степени рефлюкса результативность лечения снижается
(статистически обосновано). Зависимость между результатом лечения БК и степенью ПМР подтверждается увеличивающимся значением критерия.
С 2009 года мы начали использование нового синтетического импланта
85
– полимера из Макрочастиц кополимера полиакрилового поливинило-
вого спирта (КППС). К преимуществам указанного объемобразующего веще-
ства относится его синтетическое происхождение, биосовместимость, отсут-
ствие миграции частиц КППС благодаря большим (> 300μm) их размерам, эла-
стичность, быстрая инкапсуляция при небольшой толщине фиброзной кап-
сулы (= 300 um) и долговечность.
Эндоскопическая коррекция рефлюкса с помощью КППС проведена у
16 детей (22 мочеточника): с ПМР II ст. 2 больным и с IV ст. 14 пациентам в возрасте от 7 до 12 месяцев.
После имплантации КППС рецидив рефлюкса через 6 месяцев отме-
чался только у 1 ребенка (6%), изначально с IV степенью ПМР, причем отме-
чено уменьшение его степени до II. У 2 детей через сутки после манипуляции на УЗИ обнаружено расширение дистальных отделов мочеточников, но отсут-
ствие болевого синдрома и инфекционных осложнений позволило нам продол-
жить наблюдение.
В 94% случаев (15 детей, 21 мочеточник) был достигнут положительный результат.
Таблица 16
Результаты эндоскопической коррекции ПМР в завиимости от его
степени и вида объемобразующего вещества (n = 39)
Объемобра- |
|
Положительный |
Отрицательный |
|
||||
Степень |
результат |
|
результат |
|
||||
зующее |
|
|
||||||
ПМР |
|
|
|
|
|
|
|
|
вещество |
Кол-во |
Кол-во |
% |
Кол-во |
Кол-во |
|
% |
|
|
больных |
моч-в |
больных |
моч-в |
|
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
БК |
I – II |
14 |
19 |
61 |
___ |
___ |
|
___ |
|
|
|
|
|
|
|
|
|
III – IV |
___ |
___ |
___ |
9 (2↑) |
14 |
|
39 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
КППС |
I – II |
2 |
3 |
13 |
___ |
___ |
|
___ |
|
|
|
|
|
|
|
|
|
III – IV |
13 |
18 |
81 |
1 (↑) |
1 |
|
6 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
86
У 9 пациентов второй группы с ПМР на фоне НАМП и НМП нам не уда-
лось восстановить адаптационную функцию детрузора в полном объеме на фоне приема М-холинолитиков и режима периодической катетеризации, по-
этому коррекцию ПМР мы сочетали с введением БТТА в детрузор, что позво-
лило избежать рецидива рефлюкса и тем самым, не допустить формирование нефросклероза.
4.3 Эндоскопическая коррекция нерефлюксирующего обструктивного
мегауретера
У 7 детей из обеих групп выявлен нерефлюксирующий обструктивный мегауретер.
Двум детям из первой группы с АНМП и НМП, у которых в возрасте 8
и 10 месяцев диагностирован нерефлюксирующий мегауретер (обструкция в зоне УВС), на 1 году жизни проводился комплекс терапии, направленный на стабилизацию нарушенных основных функций мочевого пузыря.
Оперативное вмешательство (уретероцистонеоимплантация) было про-
ведено в возрасте после 1 года, уже при выявленных нарушениях внутриор-
ганного кровотока и качественных показателей паренхимы по данным УЗИ.
В катамнезе у 1 ребенка в 3 года отмечен рецидив мегауретера на фоне недостаточно компенсированных нарушений уродинамики нижних мочевых путей применением М-холинолитиков и периодической катетеризации (на ре-
троградной цистометрии выявлена дезадаптация детрузора с уменьшением ре-
зервуарной функции мочевого пузыря), что потребовало введения БТТА в дет-
рузор – с положительным результатом в плане восстановления пассажа мочи по мочеточнику на фоне стабилизации адаптационной функции детрузора. Од-
нако к этому возрасту по данным УЗИ с допплерографией и статического РИИ у этого пациента уже имелись выраженные проявления нефросклероза на сто-
роне поражения.
В связи с внедрением в нашей клинике в 2009 году малоинвазивного ме-
87
тода корреции обструктивного нерефлюксирующего мегауретера путем эндо-
скопического стентирования мочеточников – дети из 2 группы – 5 пациентов с мегауретером были пролечены по этой методике уже в раннем возрасте, до
1года.
Увсех 5 детей стентирование выполнялось, как и в случае с ПМР – сразу после 1 этапа лечения, направленного на стабилизацию уродинамики нижних мочевых путей (через 10 – 14 дней). Однако, у 2 пациентов с АНМП и НМП в связи с недостаточной эффективностью применения М-холинолитиков в мак-
симальных дозах для снижения выраженной внутрипузырной сочетанной ги-
пертензии, мы выполняли стентирование мочеточников вместе с внутридетру-
зорным введением БТТА, что позволило восстановить адаптационную функ-
цию мочевого пузыря .
Метод трансуретрального стентирования мочеточников «низкими» стентами был разработан И.Л. Бабаниным (2007г.) и заключается в проведе-
нии стента диаметром 5 Ch в мочеточник во время цистоскопии на расстояние
6 см (у детей в раннем возрасте), т.е. за зону обструкции и дистальный его фрагмент выводится наружу в качестве уретрального катетера. Манипуляция выполнялась под наркозом. Сроки ношения стентов составляли 2 – 4 недели.
В нашем исследовании мы использовали «низкие» стенты несколько иной конфигурации: мочеточниковый фрагмент стента, диаметром 5 Ch и дли-
ной 6 см также имеет пузырный завиток, к его окончанию фиксирована леска,
которая по окончании манипуляции выводится наружу и крепится к коже лей-
копластырем, что обеспечивает при необходимости его эвакуацию без наркоза. (рисунок 27).

88
Рисунок 27. а. вид "низкого" мочеточникового стента; б. устье мочеточника с проведенным катетером.
В тех случаях, когда нам не удавалось выполнить стентирование сразу (это 2 ребенка в возрасте 4 месяцев), мы ограничивались установкой мочеточникового катетера №3 на срок 3 – 5 дней с последующей заменой его на стент № 5 Ch.
Ни в одном случае мы не получили таких осложнений, как кровотечение,
перфорация мочеточника.
У одного ребенка через 10 суток после стентирования отмечено присоединение инфекции мочевых путей, что было купировано сменой уросептической терапии.
Сроки ношения стентов составили в среднем 2 месяца (от 1 до 3 максимально). УЗ исследование мы проводили в сроки 1, 3, 12 и 24 месяца после удаления стента.
Рисунок 28. До лечения: а) расширенный извитой мочеточник; б) расширеннная коллекторная система почки, в) умеренное диффузное обеднение кровотока.
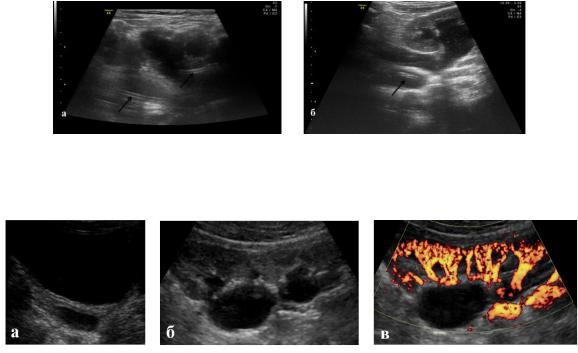
89
Рисунок 29. Через двое суток после стентирования: а) стент в мочевом пузыре и дистальной трети мочеточника; б) проксимальный фрагмент стента в средней трети мочеточника.
Рисунок 30. Через 3 месяца после удаления стента: а) сокращение диаметра мочеточника в нижней трети; б) сокращение размеров ЧЛК; в) улучшение интраренального кровотока.
При динамическом наблюдении у всех 5 детей (100%) из второй группы,
стентированных в возрасте до 1 года, был достигнут клинический эффект в плане нормализации уродинамики верхних мочевых путей к 2 годам. По дан-
ным УЗИ отмечалось сокращение размеров ЧЛК и мочеточников до возраст-
ных значений, восстановление качественных показателей паренхимы и у 3 па-
циентов – улучшение резистивных скоростных характеристик интрареналь-
ного кровотока по данным допплерографии (снижение кровотока по перифе-
рии почек было зафиксировано до начала лечения) (р<0,05).
4.4 Профилактика хронической болезни почек
Поздняя диагностика, а также несвоевременное лечение пузырно-мо-
четочникового рефлюкса и нерефлюксирующего мегауретера, приводят к раз-
витию хронической болезни почек, поэтому мы уделяли большое внимание ее профилактике и лечению.
Предрасполагающими факторами к формированию ХБП являются раз-
личные варианты нарушений уродинамики, особенно протекающие на фоне
90
дисплазии почечной ткани в сочетании с инфекционными осложнениями. У
детей с синдромом спинального дизрафизма нарушения уродинамики нижних мочевых путей – арефлексия в сочетании с нарушением резервуарной и эваку-
аторной функций мочевого пузыря – имеют крайнюю степень выраженности и оказывают огромное влияние на состояние верхних мочевых путей, что в свою очередь, привело к формированию большого процента сопутствующих обструктивных уропатий у детей в исследуемых группах.
Чем меньше емкость мочевого пузыря, тем выше внутрипузырное дав-
ление, соответственно тем больше нарушается адаптация детрузора к накоп-
лению мочи и поддержанию нормальной эвакуации из верхних мочевых пу-
тей.
При ПМР в 2,5 раз чаще, чем при других обструктивных уропатиях раз-
вивается вторичное сморщивание почки, называемое рефлюкс-нефропатия.
Поэтому пациенты исследуемых групп с обструктивными уропатиями, угро-
жающемые по развитию хронической болезни почек, наблюдались нефроло-
гом и урологом и получали терапию, направленную на профилактику вторич-
ного склерозирования паренхимы: антибактериальную терапию при наличии инфекционных осложнений с использованием группы цефалоспоринов II и III
поколения с наименьшим повреждающим воздействием на биоценоз кишеч-
ника (рекомендации проф. Белобородовой Н.В. 2001 г.) , препараты, стабили-
зирующие липидный обмен (витамин Е, эссенциале, липоевая кислота), пре-
параты, усиливающие энергетический потенциал клетки (цитохром С, цито-
флавин, актовегин, L-карнитин), физиолечение и пикамилон (позволяющие снять явления тканевой гипоксии органов малого таза).
Также при уже диагностированной РН, сопровождающейся протеину-
рией, превышающей допустимую возрастную, назначались нефропротекторы
– ингибиторы АПФ (Эналаприл в дозе 0,1 – 0,5 мг/кг/сут). Данные препараты снижают перфузионную нагрузку на почечный гломерулярный фильтр,
уменьшая, с одной стороны, скорость клубочковой фильтрации (СКФ), но, с
другой стороны, уменьшая баротравму интимы клубочковых капилляров и
