
диссертации / 97
.pdfмин после окончания нагревания в полной среде в объеме 100 мкл (30 мин при 4°C). После двукратной отмывки раствором PBA (DPBS с добавлением
0.2% BSA и 0.05% NaN3) проводили окрашивание вторичнымими флуоресцентномечеными антителами в растворе PBA (30 мин при 4°C).
Вновь клетки отмывали, ресуспендировали в PBS и подвергали цитометрическому анализу. Использовали рекомендованное производителем количество антител, в некоторых случаях проводили их предварительную титровку. Уровень поверхностной экспрессии HSP70 вычисляли в условных единицах, аналогично внутриклеточному уровню HSP70.
Аналогичную процедуру иммунофлуоресцентного окрашивания проводили для анализа поверхностной экспрессии СD63, CD66b, CD107a. В
положительном контроле нейтрофилы активировали индуктором окислительного взрыва и дегрануляции fMLP (2 мкМ).
2.3.4. Цитометрическое измерение внутриклеточной продукции
АФК
Спонтанную продукцию АФК в нейтрофилах определяли с помощью
DCFH-DA, уровень флуоресценции которого пропорционально зависит от внутриклеточной концентрации основного продукта АФК – пероксида водорода. К образцам нейтрофилов, переведенных в полную среду в объеме
500 мкл, добавляли DCFH-DA в конечной концентрации 5 мкг/мл. Затем проводили инкубацию образцов при 37°C в атмосфере 5% СО2 в течение 20
мин для проникновения DCFH-DA в клетки, после которой клетки двукратно отмывали холодным DPBS при 4°C. Флуоресценцию клеток, облученных лазером 488 нм, анализировали в канале FL1.
2.4. Анализ внутриклеточного содержания HSP70 методом Вестерн-
блоттинга
Нейтрофилы в количестве 2-5 млн лизировали буфером, содержащим 20
мМ Трис-HCl (pH7.5), 150 мМ NaCl, 1 мМ Na2EDTA, 1% тритон X-100 и
61
смесь ингибиторов протеаз в объеме 100 мкл в течение 5 мин на льду. После центрифугирования при 10000 g в течение 10 мин отбирали надосадок и проводили измерение концентрации тотального белка в лизированных образцах нейтрофилов с использованием реагента Брэдфорда.
Фракционирование белков проводили в условиях денатурирующего электрофореза в полиакриламидном геле с концентрацией разрешающего геля 10%. Общее количество белка, вносимого в лунку, в каждом образце было выравнено и составляло в среднем 50 мкг/лунку. После процедуры переноса на нитроцеллюлозную мембрану, проводили блокирование мембраны в буфере T-TBS (20 мМ Трис-HCl (pH7.6), 138 мМ NaCl, 0.1% Tween 20) c 5% содержанием обезжиренного сухого молока с последующей отмывкой в T-TBS. Затем мембрану окрашивали моноклональными антителами против HSP70 (BRM22) и β-актина (AC-15), разведенных в T- TBS с 5% BSA в течение 12 ч при 4°C с последующей двукратной отмывкой,
а затем антителами против Ig мыши, меченных пероксидазой хрена.
Иммуноблот проявляли, используя субстрат, содержащий диаминобензидин и перекись водорода (0.003%). Результат фиксировали с помощью системы гель-документации (Vilber Lourmat, Франция). Анализ блотов проводили в программе обработки денситомтерических даных ImageJ 1.38х (Wayne Rasband, NIH, США).
2.5. Измерение продукции АФК с помощью люминол-зависимой
хемилюминесценции
Для индукции избыточной продукции АФК нейтрофилы (1 млн/мл)
стимулировали зимозаном A, опсонизированным свеже приготовленной сывороткой от 10 доноров, в конечной концентрации 20 мг/мл. Реакцию проводили при 37°C в 96-луночных темных планшетах (SPL, Корея) в 200
мкл раствора Хэнкса с добавлением 1 µM люминола. Уровень хемилюминесценции в образцах измеряли на хемилюминометре 3603 (Dialog Joint Venture, Moscow), регистрируя число импульсов в минуту (cpm).
62
Спонтанную продукцию АФК измеряли в точке инициации реакции. За уровень зимозан-индуцированной продукции АФК брали максимальное значение cpm, которое регистрировали в течение 30 мин. Каждый образец измеряли в дублях.
2.6. Статистический анализ данных
Анализ данных и статистическую обработку проводили в программе
SigmaPlot версия. 11.0 (Systat Software Inc., США). При наличии нормального распределения для анализа достоверности различий между двумя группами использовали параметрический t-тест для независимых выборок. При отсутствии нормального распределения данных для анализа, применяли непараметрический тест Манна-Уитни (U-test). Для проведения корреляционного анализа использовали метод ранговой корреляции Спирмана. Достоверными считались различия между группами при р<0.05.
2.7. Измерение транскрипционной активности генов HSP70 с помощью
полимеразной цепной реакции в режиме реального времени (qRT-PCR)
Тотальную РНК для каждого образца выделяли из 6х106 нейтрофилов с использованием TRIzol-реагента в соответствии с инструкцией производителя. Образцы выделенной РНК подвергали обработке ДНКазой I с
целью избавления от возможной примеси тотальной ДНК. Измерение концентрации выделенной РНК (нг/мкл) производили на спектрофотометре
NanoVue Plus при длинах волн 260/280 нм (GE Healthcare Life Science,
Великобритания). Концентрацию рассчитывали с использованием калибровочной кривой. Процедуру обратной транскрипции для синтеза кДНК проводили с использованием обратной транскриптазы MINT и
рандомных гексамерных праймеров по методике, указанной в прилагаемой производителем инструкции. Гексамерные праймеры (12 пмоль) добавляли в смесь объемом 10 мкл, содержащую 2 мкг тотальной РНК. Смесь прогревали в течение 2 мин при 70°C, а затем переносили в лед на 10 мин. Для
63
инициации реакции синтеза кДНК, реакционную смесь инкубировали при
42°C и 70°C в течение 120 и 15 мин, соответственно. Специфические праймеры (5’-3’) к отдельным генам белков HSP70 и референсному гену были подобраны с помощью программного обеспечения Primer Blast (www.ncbi.nlm.nih.gov/tools/primer-blast) и программы OligoAnalyzer 3.1.
Были выбраны и синтезированы (Евроген, РФ) следующие последовательности (название гена: прямой праймер, обратный праймер).
HSPA1: AGGTGCAGGTGAGCTACAAG, CTCGGCGATCTCCTTCATC;
HSPA8: TGCTGCTCTTGGATGTCACT, AAGGTCTGTGTCTGCTTGGT; b-актин:CACCACACCTTCTACAATGAG, GTCTCAAACATGATCTGGGTC.
b-Актин использовали в качестве референс-гена, для нормализации количества кДНК в каждой временной точке измерения.
Специфичность подобранных праймеров проверяли после проведения
PCR и электрофореза продуктов PCR в 3% агарозном геле по наличию одного продукта с ожидаемой мол. массой.
2.7.1. Проведение qRT-PCR
Экспрессию генов в режиме qRT-PCR оценивали в образцах интактных,
подвергнутых ТШ при разных режимах ( 43°C, 10 мин; 40°С, 40 мин) спустя разные промежутки времени после окончания тепловой обработки. Каждый образец для проведения qRT-PCR (конечный объем составил 25 мкл)
содержал 5 мкл коммерческой реакционой смеси qPCRmix-HS SYBR, 1 мкл 3 mM праймеров (прямого и обратного), 0.5 мкл кДНК и 17.5 мкл подготовленной (очищенной от РНК) воды. Реакцию амплификации проводили на приборе LightCycler480 (Roche Diagnostics, Германия).
Применяли следующий протокол: прединкубация (95°C, 5 мин), затем 40
циклов, включающих режимы денатурации (95°C,10 с), отжига праймеров
(60°C,10 с), и удлинения ДНК (72°C, 10 с). Перед окончанием реакции амплификации, кривая диссоциации была представлена в виде графика,
чтобы подтвердить специфичность продукта. Каждую точку для
64
амплификации вносили в триплетах. Для коррекции количества внесенного материала в каждой временной точке, анализ результатов проводился с нормализацией по эндогенному референс-гену b-актину.
2.7.2. Статистическая обработка данных RT-PCR
Уровень накопления мРНК оценивали по алгоритму с определением коэффициента эффективности отжига праймеров. Для этого использовали программные приложения LightCycler480 версия SW 1.5.1, Exor4, LinRegPCR, LC480Conversion. Разбросы данных представлены в виде стандартной ошибки среднего.
2.8. Оценка внеклеточного уровня HSP70 с помощью ИФА
Уровень внеклеточного содержания HSP70 оценивали в супернатантах образцов нейтрофилов с помощью наборов для иммуноферментного анализа.
В работе использовали два типа набора: для определения Hsp70 (Enzo Life Sciences, США) и Hsc70 (StressMarq, Канада). Для анализа отбирали культуральную жидкость из образцов, которые не подвергали ТШ
(контроль), сразу после проведения ТШ, а также спустя разные промежутки времени после окончания ТШ. До проведения ИФА супернатанты держали замороженными при -20°С.
Культуральную жидкость, отобранную из восьми идентичных образцов
(2 млн/мл, 500 мкл), концентрировали на приборе SpeedVak Concentrator
(ThermoSavant, CША) в 10 раз. В лунки планшета с иммобилизованными на их поверхности антителами к Hsp70 или Hsc70 наносили стандартные
(раствор антигенного белка определённой концентрации) и исследуемые
(концентрированные супернатанты) образцы. После инкубации (в условиях,
указанных в инструкции производителя) и трехкратной промывки лунок от несвязавшегося антигена входящим в набор буфером для отмывки добавляли биотинилированные антитела к Hsp70 или Hsc70. После получасовой инкубации вновь три раза промывали лунки буфером для отмывки и добавляли в каждую лунку входящий в состав набора раствор конъюгата
65
стрептавидина с пероксидазой хрена. После очередной инкубации и трехкратной отмывки добавляли субстрат тетраметилбензидин (ТМВ) для развития цветной реакции. Реакцию останавливали через 30 мин добавлением в лунки блокирующего буфера на основе серной кислоты.
Измерение оптической плотности образцов проводили на фотометре
Multiscan FC (Thermo Scientific, CША) при длине волны 450 нм (референсной длине волны 620 нм). По стандартным образцам строили калибровочную кривую зависимости величины оптической плотности от концентрации
Hsp70 и Hsc70 (пг/мл), и по ней вычисляли концентрацию исследуемых белков в образцах.
66
III. Результаты
3.1. Внутриклеточное содержание HSP70 в интактных нейтрофилах в
разных возрастных группах
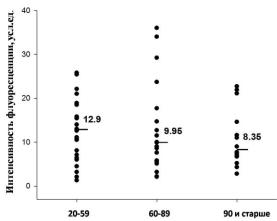
Учитывая, что устойчивость к стрессу, опосредованная системой белков семейства HSP70, является важным фактором, влияющим на процессы клеточного старения, на первом этапе была поставлена задача оценить содержание HSP70 в нейтрофилах в разных возрастных группах: 20-59
(молодые), 60-89 (пожилые) и 90 и более лет (долгожители).
Детекция внутриклеточных HSP70 была проведена методом проточной цитометрии с использованием модифицированной методики фиксации и пермеабилизации клеток. Иммунофлуоресцентное окрашивание проводилось с помощью антител BRM-22, специфичных к консервативному участку белков семейства HSP70, распознающих как индуцированный Hsp70, так и конститутивный Hsc70 белки.
Не было выявлено достоверных возрастных изменений в исходном содержании HSP70 (HSP70базальный) в нейтрофилах (Рис. 1). Однако наблюдалась тенденция к снижению значения медианы этого параметра с возрастом.
Рис. 1. Внутриклеточное содержание HSP70 (HSP70базальный) в нейтрофилах, измеренное в разных возрастных группах методом проточной цитометрии с помощью
антител BRM-22 (распознающих как индуцированный Hsp70, так и конститутивный Hsc70 белки семейства HSP70). Здесь и далее отмечены и даны значения медианы в каждой группе.
67
3.2. Динамика изменения уровня HSP70 в нейтрофилах под действием
теплового шока
Эффективность работы репарационной системы, к которой относятся белки HSP70, опосредована не только содержанием этих белков в интактных клетках: важным параметром является способность клеток реагировать на стресс и индуцировать синтез HSP70. Поэтому на следующем этапе работы была проанализирована способность нейтрофилов индуцировать синтез
HSP70 в ответ на классический индуктор синтеза этих белков – тепловой шок
(далее ТШ). Методами RT-PCR и проточной цитометрии были определены транскрипционная активность генов и содержание белков HSP70, а также динамика изменения этих параметров в нейтрофилах человека в условиях гипертермии, как модели клеточного стресса.
3.2.1. Транскрипционная активность генов белков HSP70 в
нейтрофилах под действием теплового шока
Чтобы подобрать условия ТШ, при котором будет происходить активация транскрипции генов белков HSP70, в работе использовали две модели гипертермии in vitro: 40°C, 40 мин и 43°C,10 мин. Это позволило сравнить кинетический профиль внутриклеточного содержания HSP70,
который сильно зависит не только от типа клеток, но от того,
стрессирующему воздействию какой интенсивности и продолжительности подвергаются клетки или организм [Eid et al., 1987; Wang et al., 2003].
Транскрипционная активность генов семейства HSP70 в ответ на гипертермию оценивали как для гена HSPA1 индуцируемого белка Hsp70, так и для гена HSPA8 конститутивного белка Hsc70.
Для того, чтобы нормировать количество клеток, из которых выделяли мРНК в каждой временной точке, в качестве референс-гена был выбран один из наиболее распространенных и часто анализируемых генов β-актин.
Известно, что ТШ может временно ингибировать синтез большинства белков в клетке. Исследователями было показано, что воздействие ТШ (43°С, 20
68
мин) на мононуклеарные клетки не вызывает статистически значимых отличий уровня экспрессии таких генов белков «домашнего хозяйства», как рибосомальные белки, β-актин, β2-микроглобулин, GAPDH [Sonna et al., 2002].
В нашей работе экспрессия гена 18S-рибосомальной субъединицы была очень низкая, что соотносится с малым количеством рибосом в нейтрофилах,
поэтому этот ген не мог быть использован в качестве референс-гена.
Учитывая это, уровень транскрипционной активности генов белков HSP70
был представлен в виде отношения накопленных мРНК гена HSPA1 или
HSPA8 к гену β-актина (Рис. 2А-Г).
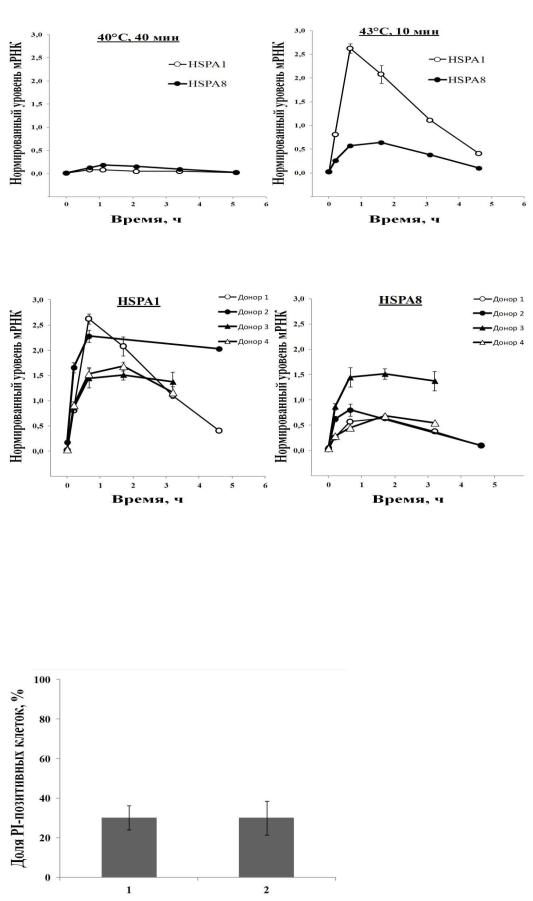
Из представленных данных (Рис. 2А, Б) видно, что индукция синтеза мРНК происходит в режиме проведения ТШ 43°C, 10 мин и практически отсутствует при режиме термообработки 40°C, 40 мин.
Индукция происходит как для генов HSPA1, так и для HSPA8 с
максимальным уровнем накопленной мРНК в интервале между 0.5 и 3 ч
после окончания термической обработки в режиме 43° C, 10 мин (Рис. 2В, Г).
Таким образом, для большинства последующих экспериментов был выбран режим ТШ 43°C, 10 мин.
Было выяснено, что такие условия проведения тепловой обработки существенно не влияют на жизнеспособность нейтрофилов. Об этом свидетельствует отсутствие достоверных отличий в содержании некрозных
(PI-позитивных) клеток между образцами, содержащими интактные либо подвергнутые гипертермии нейтрофилы после их часовой инкубации, а
также в содержании апоптозных нейтрофилов между образцами,
содержащими интактные либо подвергнутые ТШ клетки после их четырехчасовой инкубации (Рис. 3).
69
А |
Б |
В |
Г |
Рис. 2. Транскрипционная активность генов белков HSP70 в нейтрофилах под действием гипертермии. Индукция синтеза мРНК генов HSPA1 и HSPA8 под действием ТШ в режиме 40°C, 40 мин (А) и 43°C, 10 мин (Б). Динамика накопления мРНК генов HSPA1 (В) и HSPA8 (Г) при ТШ 43°C, 10 мин. Уровень мРНК нормировали по содержанию b-актина. Представленные на рисунках (А, Б) данные получены в рамках одного эксперимента на нейтрофилах донора 22 лет, на рисунках (В, Г) представлены данные, полученные на разных донорах в четырех независимых экспериментах.
Рис. 3. Влияние ТШ на жизнеспособность нейтрофилов. Сравнивали % апоптозных (по гиподиплоидному пику) клеток в образцах, содержащих интактные (1) либо подвергнутые ТШ (43°C, 10 мин) (2) нейтрофилы после их 4-часовой инкубации.
Представлены объединенные данные двух экспериментов.
70
