
диссертации / 90
.pdf61
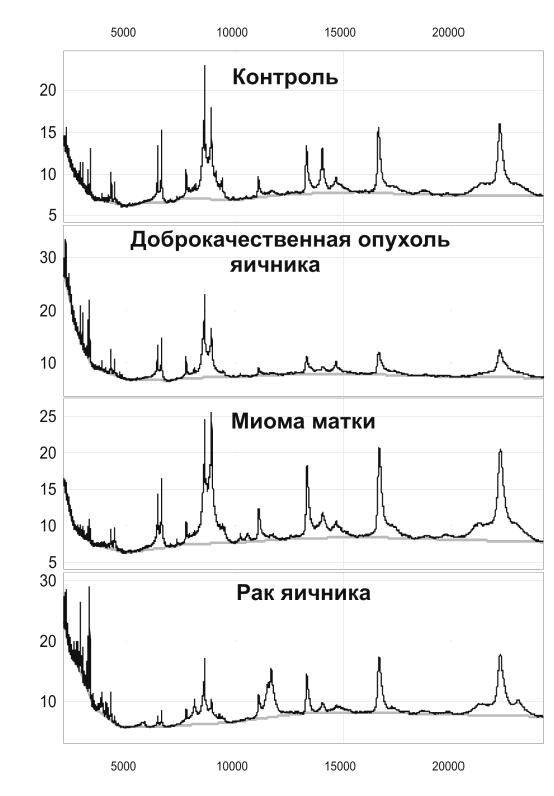
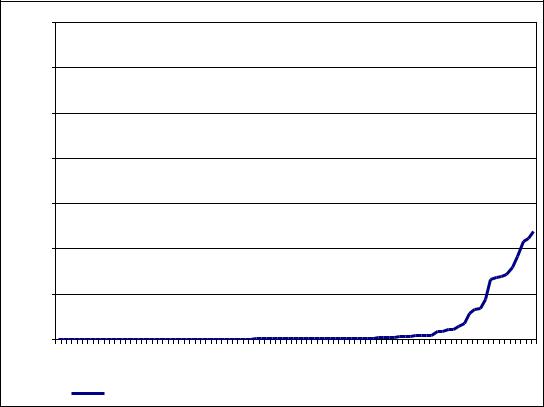
На рисунке 6 показана тенденция к увеличению интенсивности масс-
спектрометрического сигнала, соответствующего сывороточному амилоиду А1α,
с увеличением концентрации последнего, однако это увеличение не является монотонным. Коэффициент корреляции Спирмана между концентрацией A-SAA
в сыворотке и интенсивностью масс-спектрометрического сигнала составил 0,55,
что соответствует умеренной корреляции. Невысокое значение коэффициента корреляции обусловлено тем, что в 72 из 91 пробы сывороточный амилоид А содержался в концентрации ниже 0,180 г/л, что является ниже предела чувствительности определения A-SAA в сыворотке крови. При концентрациях A- SAA выше 1 г/л наступает насыщение и величина масс-спектрометрического сигнала не увеличивается. Кроме того, следует учитывать, что во многих сыворотках крови присутствует несколько пиков разных форм сывороточного амилоида, но иммуноферментный анализ позволяет измерить только его суммарное содержание.
Таким образом, полученные результаты свидетельствуют, что масс-
спектрометрическая детекция A-SAA не является количественной, однако она позволяет определять A-SAA в сыворотке крови при его концентрациях 0,3 г/л и выше. Критический уровень 0,2-0,3 г/л соответствует 1,7-2,6×10-5 M.
Следует отметить, что критический уровень A-SAA, определяемый с помощью масс-спектрометрии SELDI-TOF, очень близок критическому уровню этого белка для ряда воспалительных заболеваний [30] и, поэтому, дает возможность использовать прямое масс-спектрометрическое профилирование для быстрого определения повышенного уровня A-SAA в сыворотке крови.
Масс-спектрометрическое определение масс методом SELDI-TOF-MS
обладает невысокой точностью. Тем не менее, поскольку спектры были откалиброваны с использованием в качестве внешних стандартов белков, близких
62
по массе к A-SAA, погрешность в определении массы A-SAA не превышала 3-5
Да, что позволяет различить различные формы A-SAA в сыворотках с содержанием A-SAA более 0,3 г/л.
Возможность наблюдать различные формы одних и тех же белков является важным преимуществом масс-спектрометрических методов по сравнению с иммунологическими методами детекции белков.
В13 случаев, наряду с пиком 11683 Да, присутствует также пик равной или несколько меньшей интенсивности с m/z 11526 Да, соответствующий форме A- SAA с отщепленным аргинином на N-конце (рис. 7А).
Водном случае присутствует также небольшой пик с m/z 11439, который,
по-видимому, соответствует SAA1 с отщепленными 2-мя N-концевыми аминокислотами аргинином и серином.
В 11 спектрах наблюдается пик более низкой, по сравнению с пиком
SAA1 , интенсивности с m/z примерно 11628 Да, который, по-видимому,
соответствует SAA2 .
В 8 из 11 спектров вместе с этим пиком наблюдается пик с m/z 11472,
соответствующий форме SAA2 с отщепленным N-концевым аргинином (рис. 7А).
На трех масс-спектрах присутствует пик 11649 Да, соответствующий,
предположительно, SAA2 .
На одном масс-спектре присутствуют одновременно пики 11645 Да
(SAA2 ), 11490 Да (SAA2 с отщепленным аргинином), 11404 Да (SAA2 с
отщепленными аргинином и серином (рис. 7В).
Примеры различных форм сывороточного амилоида, детектированных на масс-спектрах, приведены на рисунке 7.
63
Как можно видеть на рисунке 7, в 16 из 18 спектров присутствует пик
массой 11683 Да, соответствующий сывороточному амилоиду 1 альфа.
Рисунок 4. Примеры масс-спектров сывороток, полученных с использованием нормальнофазовых чипов NP20
64
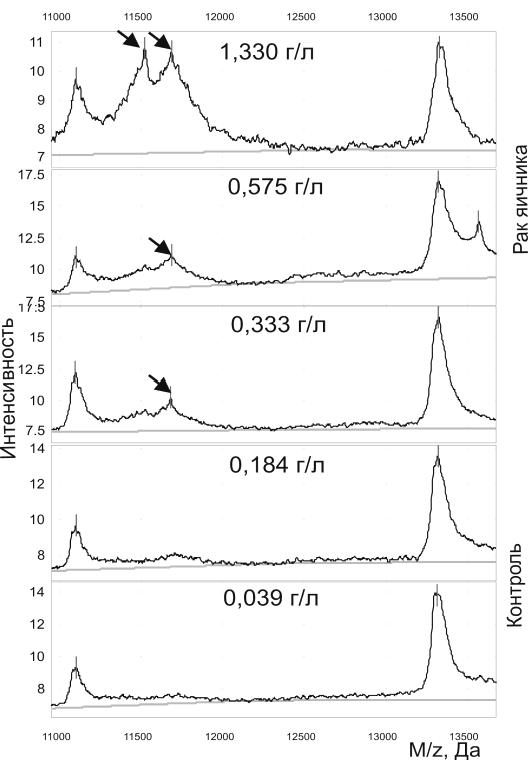
Рисунок 5. Чувствительность определения A-SAA в сыворотке крови с помощью масс-спектрометрии SELDI-TOF. Для каждого спектра показаны значения концентрации A-SAA, измеренные методом иммуноферментного анализа.
Стрелками показаны пики A-SAA на спектрах.
65
14.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
6 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
46 |
51 |
56 |
61 |
66 |
71 |
76 |
81 |
86 |
|
|
Концентрация A-SAA, г/л |
|
Интенсивность пика с m/z 11680 Да |
|||||||||||||
Рисунок 6. Для каждой из 91 пробы приведены значения концентрации |
|||||||||||||||||
сывороточного амилоида А (г/л) и значения интенсивностей пика с m/z 1681, |
|||||||||||||||||
соответствующего основной форме сывороточного амилоида - SAA1 . |
|||||||||||||||||
66
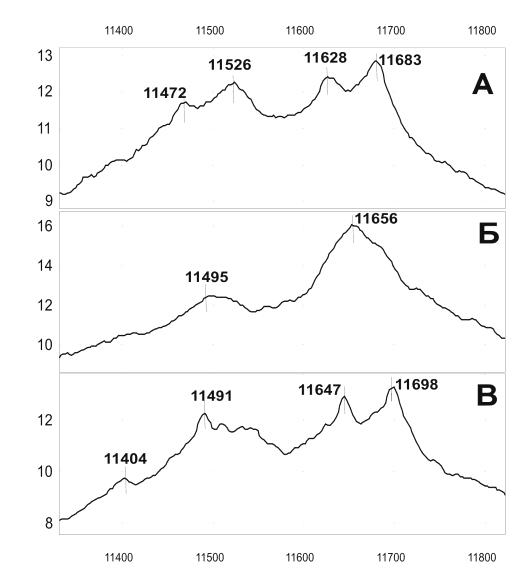
Рисунок 7. На рисунке представлены примеры масс-спектров сывороток,
содержащих различные формы сывороточного амилоида А1 и 2.
А: пики SAA1 (11682,7 Да), SAA1 с отщепленным N-концевым аргинином
(11526,5 Да), SAA2 (11628,7 Да), SAA2 с отщепленным N-концевым аргинином (11472,5 Да);
Б: SAA1 (11654,7Да) и SAA1 с отщепленным N-концевым аргинином (11498,5
Да);
В: SAA2 (11647,8 Да), SAA2 с отщепленным N-концевым аргинином (11491,6
Да), SAA2 с отщепленными аргинином и серином (11404,5 Да).
67
Пик с m/z 11698 Да, предположительно, соответствует окисленной форме SAA1 .
На нескольких масс-спектрах присутствует также пик 11728-11740 Да,
соответствующий, по-видимому, SAA1 , однако на большинстве спектров он плохо разрешен из-за высокой интенсивности соседнего пика SAA1 с m/z 11683
Да.
В одном случае мажорный пик группы сывороточного амилоида имеет m/z
11656 Да и соответствует, по-видимому, SAA1 . Вместе с ним на этом спектре присутствует пик 11495 Да, соответствующий форме SAA1 с отщепленным аргинином (рис. 7Б).
На одном спектре присутствует пик высокой интенсивности с m/z 11698,
который отличается примерно на 16 Да от пика 11683 и может представлять собой окисленную форму последнего.
Полученные нами данные свидетельствуют, что основными аллелями А- SAA в исследуемой выборке являются SAA1 и SAA2 , что соответствует данным других авторов, проанализировавших иммуноаффинными методами с масс-спектрометрической детекцией 96 сывороток крови здоровых людей с целью определения различных модификаций преобладающих в ней белков, в том числе А-SAA. SAA1 и его фрагменты с отщепленными N-концевыми аминокислотами аргинином и серином были определены в 90 из 96 исследованных сывороток крови здоровых людей, а SAA2 и его фрагменты только в 35 из 96 образцов. В 18 образцах сыворотки крови определялся SAA1 и его модификации [78].
В отличие от исследования Nedelkov и соавт., мы определяли А-SAA в
цельной сыворотке и только в образцах с резко повышенным уровнем А-SAA,
поэтому сведения, полученные нами, имеют оценочный характер. Преобладание пика SAA1 в спектрах больных раком яичника позволяет предположить, что при
68
раке яичника в большей степени повышается экспрессия SAA1, а не SAA2.
Следует отметить, что различия в массе между некоторыми аллельными вариантами (например, 11628 Да, 11645 Да и 11655 Да) не превышает 0,2%,
поэтому, при дальнейшей статистической обработке они идентифицировались как один пик.
Всего нами было определено 48 пиков в интервале m/z 5500-17500 Да,
каждый из которых имеет высокую интенсивность (соотношение сигнал/шум > 5)
по крайней мере в одной исследованной пробе. Мы пытались убедиться таким образом, что каждый из рассматриваемых пиков на масс-спектре соответствует реальному белковому продукту, а не является физическим артефактом или производным матрицы. Список интенсивностей полученных пиков для всех сывороток, разделенных на два класса («рак» и «отсутствие рака»), был использован в качестве исходных данных для разработки диагностических алгоритмов с использованием различных статистических методов.
3.4. Результаты классификации масс-спектров SELDI-TOF
методом пар с наибольшим счетом
Классификатор метода пар с наибольшим счетом (TSP) был предложен для обработки данных ДНК-микрочипов и идентификации генов-маркеров [110]. Этот алгоритм классифицирует образцы на основе разностей интенсивностей пиков, а
не абсолютных значений интенсивностей, отбирая одну или несколько (k-TSP)
пар биомаркеров с наибольшей разницей интенсивностей. Так как данные масс-
спектрометрии в целом аналогичны данным ДНК-микрочипов, мы применили
TSP-классификацию к спектрам исследуемой выборки, что позволило выявить только одну пару с наибольшим счетом, состоящую из интенсивностей пиков
11681 Да и 13769 Да. В случае, если разность интенсивностей указанных пиков
69
положительна, исследуемый образец классифицировали как «рак», если отрицательна, то как «отсутствие рака».
Оба пика выбранной пары соответствовали известным маркерам рака яичника. Так, пик с m/z 11681 Да соответствует основной форме A-SAA [75],
концентрация которого при раке яичника повышается, а пик с m/z около 13769
Да, соответствует нативной форме транстиретина, концентрация которого понижается при раке яичника [42].
Пара маркеров, отобранная в нашем исследовании - А-SAA-TTR,
представляет собой новую бинарную переменную (разность интенсивностей,
принимающую положительные или отрицательные значения), которую можно комбинировать с данными иммуноферментного анализа для улучшения классификации.
3.5. Результаты многофакторного анализа
протеомных данных
С целью определения оптимального набора протеомных данных, которые могли бы использоваться для диагностики рака яичников, нами был предпринят многофакторный анализ методами опорных векторов (SVM) и логистической регрессии (LR). В качестве исходных данных были апробированы различные варианты комбинаций протеомных данных, в частности:
1.Концентрации Са125, измеренные методом ИФА.
2.Концентрации CA125 и А-SAA, измеренные методом ИФА.
3.Значения интенсивностей 48 SELDI-MS m/z пиков, определенные методом масс-спектрометрии.
70
4.Концентрации CA125 и А-SAA, измеренные методом ИФА и данные масс-
спектрометрии.
5.Концентрации CA125 и А-SAA, измеренные методом ИФА и формализованные данные масс-спектрометрии (две переменные, отобранные методом пар с наибольшим счетом).
Эффективность диагностических алгоритмов, полученных на основе указанных комбинаций с помощью классификаторов SVM и LR, проверяли путем перекрестной проверки на достоверность. Доверительный интервал вычисляли для доверительной вероятности, равной 0,05.
Значения точности, чувствительности и специфичности полученных диагностических алгоритмов представлены в таблицах № 9 и 10 из которых явствует, что добавление значений концентраций А-SAA к значениям концентраций CA125 не приводит к повышению точности классификации, несмотря на то, что у некоторых больных раком яичников уровень А-SAA был существенно повышен на фоне нормального уровня CA125.
Многофакторный анализ данных масс-спектрометрии методом опорных векторов (таблица № 9) дал лучшие результаты, чем метод логистической регрессии (таблица № 10): точность метода опорных векторов (SVM) для данных масс-спектрометрии оказалась значительно выше, чем при использовании только концентрации CA125 (89,5% против 86,1%, соответственно). LR-классификатор, напротив, дал существенно лучшие результаты, чем SVM при обработке бинарных данных методом пар с наибольшим счетом (TSP) в комбинации с данными ИФА, причем данные TSP существенно повысили точность классификации (90,7% по сравнению с 85-86% только для CA125).
