
диссертации / 46
.pdf
полном отсутствии резервуарной функции мочевого пузыря, тонус замыкательного аппарата был снижен, отмечались признаки детрузорно - сфинктерной диссинергии.
Все больные получали терапию, включающую поведенческую терапию, БОС-терапию и физиолечение, новокаиновые блокады.
Холинолитическую терапию получали 54 пациента, у 6 больных из-за непереносимости холинолитиков фармакотерапия не проводилась.
На основании комплексного анализа полученных данных была выявлена принадлежность пациентов к одной из основных клинических групп (рисунок 21):
I. В первую группу вошли 30 пациентов (50%) с синдромом миелодисплазии, имеющие уродинамические нарушения и получающие стандартную терапию М-холинолитиками (Дриптан).
II. Во вторую группу (исследования) вошли 30 детей (50%) с синдромом миелодисплазии, у которых даже комплексное лечение давало лишь временный, нестойкий эффект. В эту же группу были включены 6 детей, у которых была выявлена непереносимость холинолитиков.
50%

 I группа - группа контроля (терапия М-холинолитиками)
I группа - группа контроля (терапия М-холинолитиками)

 II группа - группа исследования (терапия БТТА)
II группа - группа исследования (терапия БТТА)
50%
Рисунок 21. Распределение больных по группам исследования.
Длительность стандартной терапии детей из II группы составила от 6 – 12 месяцев до 15 лет, однако в этой группе детей даже комплексное лечение давало лишь временный, нестойкий эффект. У пациентов сохранялось недержание мочи (несмотря на периодическую катетеризацию) либо
61
катетеризацию приходилось осуществлялась через 45-60 минут, что значительно ухудшало качество жизни пациентов. Кроме того, у всех больных с арефлекторно-неадаптированным мочевым пузырем имелись признаки нарушения уродинамики верхних мочевых путей и инфекционных осложнений. Поэтому с целью устранения внутрипузырной гипертензии и восстановления резервуарной функции мочевого пузыря пациентам был предложен альтернативный метод лечения – внутридетрузорное введение БТТА. Процедура проводилась с разрешения локального этического комитета Российского Национального Исследовательского Медицинского Университета им. Н.И. Пирогова после заполнения родителями информированного согласия.
Сущность методики введения БТТА заключается в том, что под общей анестезией перед эндоскопической операцией внутридетрузорного введения БТТА мочевой пузырь во время цистоскопии заполняется физиологическим объемом до физиологического объема, затем оценивается состояние слизистой оболочки, наличие ее трабекулярности, характер и ло кализацию воспалительного процесса. Определяли количество, место расположения устье, их конфигурацию, смыкание и перистальтику. В дальнейшем переходили к внутридетрузорному введению БТТА. Следует отметить, что единственным лекарственным препаратом БТТА разрешенным в России для применения в урологии является Лантокс, производства Ланчжоусского Института Биологической продукции, Китай (ФС № 2008/289 от 30 декабря 2008 года).
Доза БТТА (Лантокса) выбиралась из расчета 5-10 ЕД на килограмм веса, но не более 150 ЕД на одну процедуру. Лечебную дозу Лантокса разводили в 5-15мл физиологического раствора (10 ЕД в 1 мл) и вводили в
20-25 точек по заднее-боковой стенке мочевого пузыря за исключением зоны треугольника Льето (рисунок 22). У детей от 4 до 5 лет по 2,5 ЕД на каждый вкол, у детей старше 5 лет – по 5 ЕД на вкол (суммарная доза не более 150 ЕД). Для инъекции использовались иглы № 23 G, глубина инъекции не
62
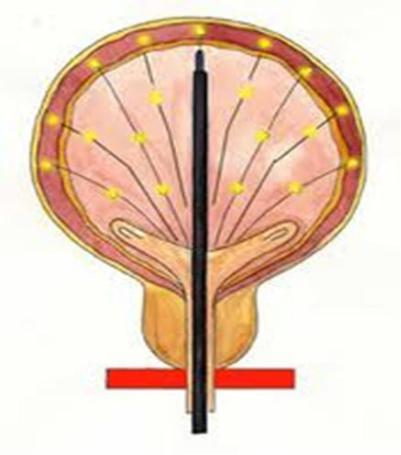
превышала 3мм. С целью профилактики инфекционных осложнений накануне и после манипуляции больной получал фосфомицинтрометамол в возрастной дозировке. Надо отметить, что ни в одном случае эндоскопического внутридетрузоного введения препарата Лантокс не было выявлено каких–либо технических сложностей или осложнений, как в по время операции, так и в послеоперационном периоде. В среднем послеоперационное пребывание пациента в стационаре составило 7 дней.
Рисунок 22. Схема внутридетрузорного введения БТТА.
Данная терапия позволила получить стойкий клинический эффект по восстановлению эффективного объема мочевого пузыря, увеличению сухих промежутков, минимизации мочевого синдрома, что связано с падением внутрипузырного давления и более благоприятной уродинамической ситуацией. Эффект стойко сохранялся от 6 месяцев до 1,5 лет, что у 21
63
больного позволило отказаться от пролонгированного применения М- холинолитиков.
Таким образом, анализ результатов обследования детей с уродинамическими нарушениями на фоне миелодисплазии показал необходимость разработки индивидуального плана лечения для каждо го ребенка.
64
ГЛАВА V
ОБОСНОВАНИЕ ЛЕЧЕБНОГО АЛГОРИТМА И ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ.
5.1 Обоснование лечебного алгоритма.
С позиции оценки состояния верхних мочевых путей, наиболее неблагоприятными вариантами нарушения уродинамики у детей с миелодисплазией являются те, что сопровождаются постоянной или интермитирующей внутрипузырной гипертензией. Именно в этой группе наиболее часто встречаются пузырно-зависимые формы пузырно-
мочеточникового рефлюкса и мегауретера, осложняющиеся хронической болезнью почек. Стартовым методом лечения этой группы больных является перевод их на периодическую катетеризацию, параллельно используется поведенческая терапия, физиолечение, назначаются фармакопрепараты, обладающие холинолитическим действием, улучшающие гемодинамику в стенке детрузора, мембраностабилизаторы.
На первом этапе всем детям назначалась уротерапия: родителям и пациенту предоставлялась информация о сути проблемы, проводилось обучение катетеризации мочевого пузыря родителей и аутокатетеризации детей более старшего возраста, рекомендации по образу жизни – диета для предотвращения запоров, рекомендации по режиму приема жидкости, ведение дневников катетеризации – дефекации.
Физиотерапевтические методы воздействия имеют такое же действие на детрузор, как и М-холинолитики, улучшая кровообращение в стенке мочевого пузыря.
Также всем детям проводилась метаболическая терапия, направленная на устранение циркуляторной и тканевой гипоксии. Фармакотерапия проводилась препаратами представленными в таблице 11.
65
Таблица 11. Метаболические препараты, используемые для устранения циркуляторной и тканевой гипоксии.
Название препарата |
Форма выпуска |
Способ |
Курс лечения |
|
|
введения |
|
|
|
|
|
Янтовит |
Капсулы 100 мг по |
Per os |
1-1,5 мес. |
|
янтарной кислоте |
|
|
|
|
|
|
Элькар |
30% раствор |
Per os |
До 1,5 мес. |
|
|
|
|
Коэнзим Q-10 |
Капсулы по 30 мг |
Per os |
1 мес. |
|
|
|
|
Рибофлавин |
Таблетки по 10 мг |
Per os |
1 мес. |
|
|
|
|
Пиридоксин |
Ампулы 5% раствора |
Per os |
1 мес. |
|
|
|
|
Фолиевая кислота |
Таблетки 1 мг |
Per os |
1 мес. |
|
|
|
|
Витамин Е |
Капсулы 100 мг |
Per os |
10 дней |
|
|
|
|
Витамин А |
Капсулы 5 и 20 МЕ |
Per os |
10 дней |
|
|
|
|
Цитохром-С |
Флаконы 0,25% раствора |
В/м и в/в |
10 дней |
|
– 4,0 |
|
|
|
|
|
|
При наличии инфекционных осложнений мочевыводящих путей детям назначались уросептики, в частности фурамаг (таблица 12). Это обусловлено, в первую очередь, достаточным спектром противомикробного действия соответственно к тем возбудителям, которые чаще всего выявляются в посевах у детей с уродинамическими нарушениями: Escherichia coli, Proteus spp., Enterobacter spp., а также препарат активен в отношении грамположительных кокков: Streptococcus spp., Staphylococcus spp.; грамотрицательных палочек: Salmonella spp., Shigella spp., Klebsiella spp.;
простейших: Lamblia intestinalis и других микроорганизмов, резистентных к антибиотикам. Во-вторых, фурамаг относится к группе нитрофуранов и характеризуется тем, что резистентность к нему развивается медленно и не достигает высокой степени. В-третьих, фурамаг, по сравнению с другими нитрофуранами, более активен в отношении Staphylococcus spp., Escherichia
coli, Aerobacter aerogenes, Bacterium Citrovorum, Proteus mirabilis, Proteus
66
morganii. Наряду с этим препарат малотоксичен по сравнению с другими нитрофуранами и лучше переносится, что имеет большое значение при применении его у детей младшего возраста.
Таблица 12. Применение фурамага в зависимости от возраста детей.
Дети |
|
Суточная доза |
|
|
|
|
|
Возраст |
Масса тела (кг) |
Мг |
Капсулы по 25 мг |
|
|
|
|
1-1,5 |
10-13 |
50-65 |
2-3 |
|
|
|
|
1,5-2 |
14-15 |
70-75 |
3 |
|
|
|
|
3-4 |
16-18 |
80-90 |
3-4 |
|
|
|
|
5-6 |
19-24 |
95-120 |
4-5 |
|
|
|
|
7-10 |
24,5-30 |
122,5-150 |
5-6 |
|
|
|
|
11 лет и старше |
30 |
150 |
6 |
|
|
|
|
При отсутствии положительного эффекта от проводимой комплексной терапии при тяжелой степени расстройств мочеиспускания, у детей младшей возрастной группы до 5 лет и у детей старше 5 лет, у которых отмечались побочные явления, требующие отмены Дриптана, с целью прерывания патологической импульсации проводилась эпидуральная блокада.
Для эпидуральной блокады использовали 2% раствор новокаина, 2%
раствор тримекаина или 2% раствор лидокаина из расчета 1 мл на год жизни. Анестетик вводили в эпидуральное пространство на уровне L3-4 позвонка, т.е в область анатомической локализации парасимпатического отдела спинального центра регуляции акта мочеиспускания. Курс лечения состоял из 1-2 разовых инъекций с интервалом 1-3 дня.
Однако продолжительного клинического эффекта у детей отмечено не
было.
Однако, ни медикаментозное лечение и стимуляция, ни симптоматические операции не дают удовлетворительных стойких
результатов.
67
При клинической неэффективности указанных методов лечения, прежде чем перейти к хирургическим методам, таким как аугментация мочевого пузыря, операция типа Митрофанофф, возможно прибегнуть к альтернативным вариантам лечения: химической денервации. Однако используемые для этой цели фармпрепараты не дают длительного эффекта,
поэтому разработка и внедрение в клиническую практику БТТА (Лантокса) позволило вернуться к решению указанной проблемы уже на новом методологическом уровне.
Поэтому с целью устранения внутрипузырной гипертензии и восстановления резервуарной функции мочевого пузыря пациентам был предложен альтернативный метод лечения – внутридетрузорное введение Лантокса. Процедура проводилась с разрешения локального этического комитета Российского Национального Исследовательского Государственного Медицинского Университета им. Н.И. Пирогова после заполнения родителями информированного согласия.
Данная терапия позволила получить стойкий клинический эффект по восстановлению эффективного объема мочевого пузыря, увеличению сухих промежутков, минимизации мочевого синдрома, что связано с падением внутрипузырного давления и более благоприятной уродинамической ситуацией. Эффект стойко сохранялся от 6 месяцев до 12 месяцев, что у 21
больного позволило отказаться от пролонгированного применения М- холинолитиков.
Таким образом, лечебный алгоритм при нарушении уродинамики нижних мочевых путей у детей с миелодисплазией включает в себя: уротерапию, М-холинолитики, физиотерапевтические методы лечения,
эпидуральные блокады, внутридетрузорное введение БТТА, а также коррекцию инфекционных осложнений и метаболическую терапию. Выбор метода лечения определяется наличием или отсутствием эффекта от выбранной терапии, возрастом больных (у детей младшего возраста М-
68

холинолитики не использовались), а также наличием побочных эффектов от приема М-холинолитиков.
На основании комплексного анализа полученных данных была выявлена принадлежность пациентов к одной из основных клинических групп:
I. В первую группу вошли 30 пациентов (50%) с синдромом миелодисплазии, имеющие уродинамические нарушения и получающие стандартную терапию М-холинолитиками (Дриптан).
II. Во вторую группу (исследования) вошли 30 детей (50%) с синдромом миелодисплазии, у которых даже комплексное лечение давало лишь временный, нестойкий эффект. В эту же группу были включены 6 детей, у которых была выявлена непереносимость М-холинолитиков (сухость во рту, тихикардия, нарушения зрения, запоры).
Анализ результатов проводился через 2 недели, 1, 3, 6 , 12 месяцев по окончании лечения.
5.2 Анализ результатов лечения в группе детей, получавших Дриптан
Указанную группу составили 30 детей. Сравнительные результаты оценки степени тяжести расстройств мочеиспускания представлены в
таблице 13.
Таблица 13. Результаты бальной оценки у детей, получавших Дриптан.
Признак |
|
|
Количество баллов |
|
|
|
|
|
|
||
|
До лечения |
После лечения |
Критерий |
||
|
|
|
|
|
Уилкоксона |
|
|
|
|
|
|
Ср.эф.объем |
2,7 |
0,3 |
1,1 |
0,2 |
Р=0,0351 |
мочевого пузыря |
|
|
|
|
|
|
|
|
|
|
|
Число |
0,7 |
0,1 |
0,2 |
0,1 |
Р=0,0413 |
|
|
|
|
|
|
69

катетеризиций
После курса лечения диапазон оценок достоверно (р 0,05) уменьшился до 7-20 баллов, со средним значением 10,6 0,4 баллов. Нормального ритма катетеризации (каждые 3 часа, в промежутках между катетеризациями отсутствие потери мочи) удалось добиться у 23 (77%) больных. У остальных пациентов добиться адекватного режима катетеризации не удалось.
Отсутствие сухих промежутков при катетеризации через каждый час отмечено у 2 (6,7%) пациентов, что можно расценить как резистентность к терапии М-холинолитиками. Эти детям была выполнена эпидуральная блокада. У одного ребенка клинического эффекта удалось достигнуть после повторной эпидуральной блокады. Уродинамические показатели характеризовались нормализацией резервуарной функции детрузора в виде увеличения емкости мочевого пузыря, снижения внутрипузырной гипертензии. Затем детям была продолжена фармакотерапия и физиотерапия. Данные изменения обусловлены устранением гипервозбудимос ти афферентного и эфферентного звеньев сакральной парасимпатической рефлекторной дуги.
После курса лечения лейкоцитурия сохранялась у одного ребенка, что потребовало продолжения антибактериальной терапии.
У 9 детей с изначальным ПМР I ст. и 3 с ПМР II ст. на фоне лечения отмечалось исчезновение рефлюкса.
После курса лечения цистометрия была проведена 14 детям. При этом выявлено, что достоверно (р 0,05) вырос максимальный объем мочевого пузыря – с 85,4 12,8 до 200,3 14,3 мл (на 134%). Также увеличился объем мочевого пузыря при появлении первого эквивалента позыва – с 57,2 15,6 мл до 110,8 14,4 мл (на 93,7%). Внутридетрузорное давление достоверно снизилось с 19,7 2,4 см.вод.ст. до 13,4 1,7 см.вод. ст. (р 0,05).
70
