
диссертации / 20
.pdfгемостаз проводили исследования именно на таких больных [174, 188]. В
1989 г Jern C, Eriksson E и соавторы в экспериментах с острым ментальным стрессом отметили повышение содержания FVII:C, FVIII:C с одной стороны и повышение концентрации и активности tPA с другой стороны [111]. Zgraggen L, Fischer JE при проведении теста с острым социальным стрессом,
включающим в себя решение задач, проведение собеседования у работодателя, счет в уме, также отметили повышение активности VII:C, VIII:C, увеличение гематокрита (HCT), гемоглобина крови (Hb), уменьшение объема плазмы крови [197], отмечалась тенденция к повышению фибриногена и д-димера, однако изменения не достигли уровня достоверности. При возникновении стрессовых ситуаций активация симпатоадреналовой системы обеспечивает готовность организма к возможным повреждениям [65], однако в здоровом организме до возникновения таковых гиперкоагуляции не происходит, так как под влиянием образовавшихся катехоламинов мобилизуются не только факторы свертывания, но и фибринолиза [181]. В то же время несколько другие изменения происходят, если стрессовое воздействие происходит на фоне атеросклероза коронарных артерий.
Исходя из работы Лавреновой Н.Ю., у больных ИБС на фоне СД при наличии депрессивных расстройств, отмечаются достоверные различия в системе гемостаза по сравнению с контрольной группой здоровых людей.
Отмечалось повышение уровня фибриногена у больных с выраженной степенью тревоги, который составил 495+12,3 мг%, снижение уровня гепарина до 3,2+0,16 МЕ/мл, снижение уровня антитромбина до 69,0+1,3%,
увеличение агрегационной активности тромбоцитов - 85,2+2,2%, повышение концентрации -тромбоглобулина до 43,7+1,5 нг/мл [22]. Способность фибринолитической системы расщеплять образованные тромботические массы при воздействии хронического стресса снижаются, что происходит в результате снижения активности tPA с одновременным повышением уровня
31
ингибитора активатора плазминогена 1 типа (PAI-1), в то время как у здоровых индивидумов при остром стрессе уровень PAI-1 не изменяется
[183]. Интересно отметить, что регулирующие эффекты СНС на систему гемостаза (а именно изменения со стороны Д-димера и фибриногена) после психического стресса являются даже более продолжительными, чем изменения со стороны гемодинамики, включающей АД и ЧСС [168, 189].
Изменения гемостаза при стрессе во многом обусловлены катехоламин-
индуцированным глубоким повреждением эндотелия [41], и наиболее развернуто реализуется у пожилых больных в виде неадекватного усиления гемостатического потенциала (повышение вязкости крови, уровня фибриногена, агрегационной активности эритроцитов) в ответ на менее сильные раздражители [16].
Вторая наиболее распространенная модель исследования влияния СНС на гемостаз – физические тренировки. Известно, что дозированные физические нагрузки для здоровых людей полезны, однако у больных с атеросклерозом коронарных артерий гемодинамический удар при этом может быть причиной разрыва атеросклеротической бляшки с коронароспазмом и тромбозом, что приводит к ОИМ или внезапной смерти [32, 60, 109, 131, 186]. Выдвинуто предположение, что в формировании тромбоза участвуют не только гемодинамические сдвиги, но и непосредственное участие СНС в изменении гемостаза. Об этом говорит повышение FVIII:C [131],
фибринолитической активности, vWF, Д-димера после 4-часового марафона у спортсменов, при этом повышение 2 последних показателей и укорочение АЧТВ сохраняется и на следующее утро [166]. Наблюдается повышение тромбоцитокрита, связанное с их высвобождением из депо – селезенки,
костного мозга, легких. Влияние СНС на фибринолитическую систему не так однозначно: у здоровых наряду с активацией свертывания крови отмечается повышение уровня тканевого активатора плазминогена (tPA), снижение PAI- 1; у тренированных спортсменов при острых физических нагрузках
32
прокоагулянтный потенциал сдерживается, поэтому считается, что регулярные тренировки благотворно влияют на состояние системы гемостаза и снижает риск сердечно-сосудистых событий. Наряду с этим, доказано, что
PAI-1 депонируется в везикулах нейрональных аксонов вместе с катехоламинами и при возбуждении симпатических волокон высвобождается в синаптическую щель [112].
Стоит отметить, что при изолированной стимуляции β2-адренорецепторов формирование фибрина не происходит, для этого необходима одновременная стимуляция α2-адренорецепторов. Неспецифическая медикаментозная блокада β-адренорецепторов ограничивает стресс-индуцированное высвобождение FVIII:C, vWF, но также тормозит фибринолиз [84]. При изучении влияния ВНС на агрегационный гемостаз в зависимости от времени суток, Eisensehr I выявил корреляцию утренней концентрации адреналина крови с агрегацией тромбоцитов. В этих же экспериментах было подтверждено ускорение образования тромбина и растворимых фибрин-
мономерных комплексов под действием СНС [88].. При острой гипоксии мобилизация катехоламинов в кровь сопровождалась в экспериментах повышением агрегации тромбоцитов, которая нивелировалась сразу после двусторонней адреналэктомии и вновь повышалась после в/в введения адреналина [125]. Высокие физиологические дозы адреналина (20 нМоль/л)
способствуют формированию микроагрегатов крови в результате экспрессии активированных GPIIb-IIIa комплексов на поверхности тромбоцитов [136].
Кроме того, Sverre E. Kjeldsen; Alan B. Weder и соавт. выявили интересный факт – при в/в инфузии адреналина здоровым людям в течение 60 минут отмечалось достоверное увеличение числа и размеров тромбоцитов, однако агрегация их in vitro уже парадоксально снижалась в ответ на индукцию адреналина, в то время как при добавлении АДФ или коллагена, оставалась неизменной. Это дает возможность предполагать, что при острой гиперкатехоламинемии мобилизованные тромбоциты сдерживают агрегацию
33
за счет снижения адреналин-индуцированного высвобождения ß-
тромбоглобулина и тромбоцитарного фактора 4 [117]. Petidis K, Douma S
также отметили, что при острой физической нагрузке несмотря на высвобождение тромбоксана В2 (TXB2) из активированных тромбоцитов наблюдается снижение их агрегации с АДФ и коллагеном, что более выражено у здоровых наблюдаемых, чем у больных гипертонической болезнью и ИБС, что по мнению авторов объясняется эндотелиальной дисфункцией у последних групп пациентов с нарушением баланса в системе
TXB2/PGI2, снижением уровня NO [147]. Все эти факты можно рассматривать в рамках распространенной на современном этапе концепции о том, что свертывание крови происходит постоянно в организме и уравновешивается влияниями противосвертывающей системы. При наличии заболевания этот баланс нарушается в сторону гиперкоагуляции [86]
Суммируя все вышесказанное, можно выделить основные точки гемостаза, на которые воздействует активация СНС:
А. Влияние на свертывающую систему.
1) Усиление образования апопротеина III (моноцитами и макрофагами),
высвобождение из сосудистой стенки тромбопластина.
2)Активация высвобождения фосфолипидов из эритроцитов и других форменных элементов крови, из эндотелия.
3)Повышение числа и функциональной активности тромбоцитов,
увеличение гематокрита
4) Спазм сосудов
6) Активированные через альфа-2-адренорецепторы тромбоциты переводят фактор Хагемана (XII) в активную форму XIIа [87], что приводит к запуску внутреннего механизма образования протромбиназы
8)Увеличение активности V, VII, VIII фактора [77, 181]
9)Повышается уровень фактора фон Виллебранда [77, 181]
Б. Влияние на фибринолитическую и антикоагулянтную систему:
34
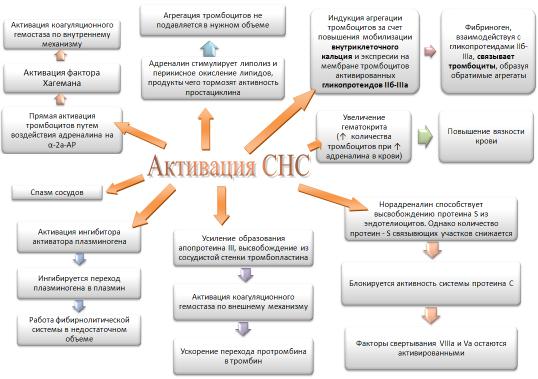
1)При активации СНС из эндотелия выделяются тканевой активатор плазминогена (tPA).
2)Аксонами симпатических нервов синтезируется тканевой активатор плазминогена (tPA), активатор плазминогена урокиназного типа (uPA) [62, 113, 163]
3)Стимуляция Хагеман-зависимого фибринолиза
4)Разнонаправленные изменения со стороны PAI-1 наблюдаются в зависимости от характера воздействия СНС, его продолжительности и наличия либо отсутствия атеросклеротического поражения артерий
[113, 142]
5)Высвобождение протеина S из эндотелиоцитов, однако одновременно
происходит снижение экспрессии протеин S-связывающих участков,
что блокирует активность системы протеина С [70].
Основные положения мы попытались суммировать на схеме 1
Схема 1. Влияние СНС на систему гемостаза
35
1.4. Связь вариабельности сердечного ритма и показателей гемостаза
1.4.1. Общие сведения о связи вариабельности сердечного ритма и показателей гемостаза
При оценке уровня функционирования вегетативной нервной системы ранее использовались преимущественно лабораторные методы, такие как прямое определение катехоламинов крови и их метаболитов в моче.
Лабораторное исследование маркеров функционирования симпатадреналовой системы весьма затруднительно в связи со следующими факторами:
1)Дорогостоимость реактивов
2)Быстрый метаболизм и инактивация катехоламинов, в связи с чем определение их уровня в плазме крови может иметь большие погрешности. В
то же время определение метаболитов катехоламинов в моче
(ваниллилминдальная кислота) имеет ограниченную диагностическую
ценность при снижении фильтрационной функции почек, что часто
наблюдается у больных сердечно-сосудистыми заболеваниями [175].
3)Суточный ритм колебаний катехоламинемии
4)Большая чувствительность к смене внешних условий при заборе крови
(температура окружающей среды, субъективные переживания пациента,
неприятные ощущения от венепункции)
Исследование функционирования вегетативной нервной системы может проводится и с помощью вариабельности сердечного ритма. В отличие от лабораторного измерения катехоламинов и их метаболитов, при анализе ВСР не требуется дорогих расходных материалов, при суточном мониторировании с помощью аппаратов Холтеровского мониторирования учитывается не только тонус симпатического звена в определенный момент времени, но и базовый фон функционирования его на протяжении всего периода, тем более кажется целесообразным разделение на дневной и ночной
36
баланс ПСНС и СНС, так как это два кардинально различающихся времени суток по уровню физической и психоэмоциональной активности пациентов.
К тому же исследование не приносит каких-либо неудобств пациенту, что снижает искажение результатов.
Таким образом, на современном этапе ВСР представляет намного больший интерес в плане оценки ВНС, включая исследование роли ВНС в формировании нарушений коагуляции крови.
Вегетативная регуляция гемостаза вызывает определенный интерес в разных отраслях медицины. Сурина С.В., исследуя беременных, страдающих гестозом в третьем триместре беременности, отметила, что гиперкоагуляция крови наряду с умеренным изменением показателей ВСР (повышение индекса напряжения) является физиологичным явлением, в то время как резкая альтерация ВСР, сопровождающаяся снижением числа тромбоцитов расценивается как срыв адаптации организма [90]. В своей работе Гудков Г.В, Куценко И.И. и соавт. выявили, что у беременных с выраженным преобладанием парасимпатической регуляции значительно чаще встречалась гипокоагуляция (81,5%) с угнетением фибринолиза, в то время как при однонаправленной гиперсимпатикотонии наблюдались состояния с гиперкоагуляцией (37,0%); у беременных с большим объемом кровопотери в родах и послеродовом периоде всегда встречалась односторонняя гиперактивация симпатического либо парасимпатического отдела, в то время как в подгруппах с меньшим объемом кровопотери, а также в контрольной группе, состоящей из беременных с физиологическим течением беременности, чаще наблюдалось вегетативное равновесие либо смешанная активация обоих звеньев вегетативной нервной системы [13].
Connes P, Hue O у 23 больных серповидно-клеточной анемией наблюдали положительную корреляцию между VLF и вязкостью крови, и
отрицательную – между ригидностью эритроцитов и pNN50% [78]. У
больных, оперированных по поводу рака щитовидной железы также
37
обнаружена достоверная положительная корреляция между HF и ПВ и ТВ,
LF/HF и РФМК, отрицательная связь VLF, LF, LF/HF и АЧТВ [52].
1.4.2. Влияние гиперактивации симпатической нервной системы на
гемостаз при сердечно-сосудистых заболеваниях.
|
В патогенезе многих заболеваний, в особенности сердечно-сосудистых, |
|||||
одну |
из |
ведущих |
ролей |
играет |
длительная |
гиперактивация |
симпатоадреналовой системы [66], в связи с этим возможно влияние её на систему гемостаза весьма значимо. Об этом косвенно говорят доказательства об увеличении частоты состояний, характеризующихся повышением свертываемости крови, у больных сердечно-сосудистыми заболеваниями при наличии депрессии и хронического стресса [89, 148, 149, 170, 178, 183, 190, 191], а также отчетливая тенденция развития кардиоваскулярных событий в ранние утренние часы [89, 115, 124] и благоприятное влияние неселективных
β-блокаторов на систему гемостаза [23, 180]. Так, при сравнении эффектов метопролола и карведилола у больных ХСН, de Peuter OR, Verberne HJ, Kok WE и соавт. отметили достоверно большее снижение симпатической активности и уровня vWFво второй группе [83].
Используя указанные методы, некоторые исследователи производят попытки ответить на вопрос, насколько значим вклад СНС в изменения гемостаза у больных кардиоваскулярной патологией.
Ozdemir O и соавт., исследуя вегетативную регуляцию ритма сердца у больных с митральным стенозом и сохраненным синусовым ритмом, сделали вывод о том, что гиперактивация СНС и снижение ВСР – важные детерминанты формирования феномена спонтанного эхо-контрастирования левого предсердия, при этом большую роль играет активация тромбоцитов
[143].
Jafri S.M. и соавторы отмечали наряду с повышенным уровнем норадреналина плазмы повышение концентрации β-тромбоглобулина,
38
тромбоцитарного фактора 4, фибринопептида А, Д-димера у больных ХСН вне зависимости от этиологии заболевания [110].
Otowa K, Takamura M выявили, что со старением организма усиление активности САС приводит к активации ингибитора активатора плазминогена
PAI-1, что может способствовать увеличению частоты кардиоваскулярных событий [142].
Grignani G, Soffiantino F выявили более выраженную АДФ-
индуцированную агрегацию тромбоцитов у больных с ишемической болезнью сердца при воздействии эмоционального стресса,
сопровождающегося повышением уровня катехоламинов крови, в отличие от контрольной группы [170].
Hamaad A, Sosin MD и соавт. отметили связь ВСР с изменениями маркеров гемостаза после острого коронарного синдрома, как в острой фазе,
так и в периоде реабилитации – уровень растворимого P-селектина и Д-
димера коррелировал с величиной среднего RR-интервала [102].
Большое внимание данной проблеме посвятил Ronald von Kanel. Исследуя зависимость состояния системы гемостаза от активности симпатической нервной системы, он отметил повышение уровня Д-димера и фибриногена в зависимости от уровня метаболитов адреналина и норадреналина в собранной за ночь моче [182]. Также он показал, что снижение ВСР и нарушения в автономной регуляции ассоциированы с протромботическим состоянием у женщин с коронарной болезнью сердца, выявив независимую связь мощности LF-диапазона с уровнем фибриногена крови, фактором Виллебранда; HF-диапазона с VIIа-фактором, фибриногеном. VLF, LF,
индекс LF/HF при этом коррелировал с PAI-1 активностью [185]. В
последующей серии экспериментов in vivo у больных артериальной гипертензией Von Kanel R отметил повышение уровня фактора фон Виллебранда при неспецифической стимуляции бета-адренорецепторов изопротеренолом, а при введении неселективного бета-блокатора
39
пропранолола, повышение уровня фактора фон Виллебранда нивелировалось. Таким образом было выдвинуто предположение, что активация адренорецепторов у больных гипертонией может провоцировать тромботические осложнения [84]. И напротив, снижение активности ПСНС
(снижение RMSSD в ночное время) по данным von Känel R, Thayer JF, Fischer JE объясняет 7,8% повышения фибриногена (P = 0.007), при этом корреляция наиболее четко прослеживалась у женщин по сравнению с мужчинами, а на каждое снижение RMSSD на 1 мс наблюдалось повышение фибриногена на
0,41±0,13 мг/дл у всей группы, 0,28±0,13 мг/дл у мужчин, и 1,16±0,41 мг/дл у женщин [187].
В современной кардиологии большое внимание уделяется проблеме синдрома ночного апноэ и его связи с возникновением сердечно-сосудистых событий. Так, Волов Н.А., Шайдюк О.Ю. и Таратухин Е.О. (2008 г)
указывают на возможность повышения прокоагулянтного потенциала крови и агрегационной способности тромбоцитов при повышении активности СНС,
непременно сопровождающую гипоксемию во время эпизодов ночного апноэ
[10].
Все эти результаты исследований наталкивают на мысль о значимости СНС в формировании тромбозов у сердечно-сосудистых больных [101, 183].
40
