
302_p306_B10_2010
.pdfСогласно первому началу термодинамики, количество теплоты, сообщаемое термодинамической системе, идет на изменение ее внутренней энергии dU и на совершение работы δ A :
δQ = dU +δ A .
Если нагревание происходит в условиях, когда объем остается постоянным, то соответствующая теплоемкость называется теплоемкостью при постоянном объеме, или изохорической теплоемкостью, и обозначается Cv :
Cv = δQ .dT v
Так как теплота при этом тратится лишь на изменение внутренней энергии dU (свойство идеального газа), то
δQ = dU и |
|
δQ |
Cv = |
, |
|
|
dT v |
|
откуда
dU = CvdT .
Если же при нагревании остается неизменным давление, то теплоемкость называется теплоемкостью при постояном давлении, или изобарической теплоемкостью, и обозначается CP :
|
δQ |
, |
Cp = |
|
|
dT p |
||
откуда
δQ = CpdT .
Первое начало термодинамики принимает вид:
CpdT = CvdT + PdV ,
откуда
C |
p |
= C + P |
dV . |
|
v |
|
|
|
|
|
dT p |
111

|
Из |
уравнения |
состояния идеального газа |
PV = RT следует, |
что |
|
P |
dV |
= R , т.е. C |
p |
= C + R (уравнение Роберта Майера). Оно показывает, |
||
|
|
|
v |
|
|
|
|
dT p |
|
|
|
|
|
что C p больше Cv на величину универсальной газовой постоянной R . |
|
|||||
Величина отношения |
теплоемкостей газов Cp C |
обозначается γ . |
Она |
|||
|
|
|
|
v |
|
|
зависит от сорта газа, т.е. числа степеней свободы ( i ) молекул газа. В
классической теории теплоемкостей |
γ = |
i + 2 |
. Соответственно |
для |
|
i |
|||||
|
|
|
|
||
одноатомных газов (i = 3), γ =1,67 , для двухатомных ( i = 5 ), γ =1,40 , |
и для |
||||
трех- и многоатомных газов с нелинейными жесткими молекулами (i = 6 ), γ =1,33. Величина γ играет важную роль в теории теплоемкостей газов. Она
входит в уравнение Пуассона ( PV γ =const ). Зная γ , можно не прибегая к непосредственному измерению Cv , которое порой затруднено, оценить эту величину.
Существует несколько способов измерения γ . В данной работе представлен способ оценки величины γ методом Клемана-Дезорма.
ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСТАНОВКИ
Баллон с распределительным краном, U- образный манометр, насос секундомер. Схема установки предоставлена на рис.1.
|
К |
Н |
|
Б |
М |
Рис. 1. Схема экспериментальной установки
112
Установка состоит из стеклянного баллона Б, который может быть соединен с помощью распределительного крана К либо c атмосферой, либо с насосом Н и манометром М. Водяной U -образный манометр измеряет разность между давлением в баллоне и атмосферным давлением в мм. водного столба.
Для определения отношения теплоемкостей γ для газа, находящегося в баллоне, с ним проводят последовательность термодинамических процессов,
представленных |
на P −V -диаграмме |
рис.2. Обозначим через P0,V0,T0 |
||||||||
P |
|
2 |
Открыли |
|
|
|
|
|
||
|
|
|
|
кран |
|
|
|
|
|
|
Р1 |
|
|
|
|
Накачиваем |
|||||
|
|
|
|
|
|
|
|
|
||
3 |
|
|
|
T0=const |
||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||
Р2 |
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|||
|
|
|
|
|
|
|
||||
P2′ |
|
|
|
7 |
|
|
|
|||
|
|
|
|
|
|
P0, V0 ,T0 |
||||
|
|
|
|
|
|
|
||||
P0 |
|
|
|
|
|
|
||||
4 |
6 |
1 |
|
|
|
|
||||
|
|
|
|
|
|
|||||
V
Рис. 2. Диаграмма процессов в газе
исходные величины термодинамических параметров газа в баллоне. Сначала в баллон накачивается воздух (процесс 1-2). При этом газ в баллоне сжимается и нагревается. После изохорического остывания до начальной комнатной температуры T0 газ имеет некоторое давление P1 (процесс 2-3). Затем краном соединяют баллон с атмосферой, и газ, адиабатически расширяясь, охлаждается (процесс 3-4), его давление падает до величины P0 , а температура - до величиныT1 <T0 . В момент достижения давления P0 кран К перекрывается и газ изохорически нагревается до комнатной температуры (процесс 4-5). В конечном состоянии давление газаP2 > P0 , а температура равнаT0 .
113

Масса газа, находящегося в баллоне, в начальном состоянии выражается соотношением:
m0 = P0 V0 µ . R T0
Нетрудно видеть, что в течение всех рассмотренных термодинамических процессов масса газа в баллоне больше или равна m0 .
Назовем массу m0 рабочей массой газа, эта масса остается все время в
баллоне. Накачиваемый и выпускаемый из баллона газ служит лишь для сжатия и расширения рабочей массы газа.
Введем обозначения∆P = P − P |
и∆P = P − P . Тогда |
величина γ |
|||||||
|
1 |
1 |
|
0 |
2 |
2 |
0 |
|
|
оценивается по формуле: |
|
|
|
|
|
|
|
|
|
|
|
γ |
= |
∆P1 |
|
. |
|
(2) |
|
|
|
∆P1 |
− ∆P2 |
|
|||||
|
|
|
|
|
|
|
|||
Вывод выражения ( 2 ) приводится в приложении. |
|
|
|||||||
Измерив значения |
∆P и∆P , |
можно было бы рассчитать величину γ . |
|||||||
|
|
1 |
|
2 |
|
|
|
|
|
Однако при таком методе расчета необходимо выполнение следующих условий:
1.При адиабатическом расширении (процесс 3-4) кран баллона должен быть перекрыт в момент, когда давление в баллоне станет равнымP0 ;
2.Время выпуска газа должно быть достаточно мало, так, чтобы теплообменом с окружающим воздухом можно было пренебречь.
Практически эти условия выполнить трудно, что приводит к ошибкам в определении ∆P1 и ∆P2 , и следовательно в оценке γ .
После открытия крана (процесс 3 - 4) давление в баллоне со временем уменьшается по экспоненциальному закону и через 0.1 секунды отличается от P0 не более чем на 1% .
Однако вручную открыть кран на 0,1 секунды трудно, практически время это оказывается значительно больше. Рассмотрим влияние времени, в
114
течение которого после достижения давления P0 кран К еще остается открытым, не влияет на результат опыта.
Предположим, что после достижения давления P0 кран остается открытым еще некоторое время t , за это время за счет теплообмена со стенками баллона и расширения газа происходит изобарический нагрев газа (процесс 4-6). После того как кран закрывается (точка 6) происходит изохорический нагрев газа (процесс 6-7), давление в баллоне достигает
величины P ′ |
(точка 7). Точка 7 лежит на той же изотерме, что точки 3 и 5, но |
||||
|
2 |
|
|
|
|
∆P2' |
< ∆P2 Очевидно, |
что ∆P2/ зависит от времени выхода газа из баллона, и |
|||
значение γ , рассчитанное по формуле (2) будет иметь погрешность. |
|||||
|
Рассмотрим детальнее процесс нагревания газа на участке 4-6. За счет |
||||
теплопроводности через стенки баллона за |
время dt газ |
будет получать |
|||
количество теплоты |
|
|
|
||
|
|
|
Q =α(T −T0)dt , |
|
|
где |
α = λs . |
Здесь |
T -температура газа |
в баллоне, |
T -температура |
|
d |
|
|
|
0 |
|
|
|
|
|
|
окружающего воздуха, |
α - коэффициент теплопроводности стекла, d и s |
||||
толщина и площадь стенок баллона соответственно(1). |
|
||||
|
Уравнение баланса энергии для газа, находящегося в баллоне, может |
||||
быть записано в виде: |
|
|
|
||
|
|
|
−mC pdT =α(T −To )dt . |
(3) |
|
Разделив переменные и подставив m из уравнения Менделеева-Клапейрона, получим:
− |
dT |
= |
α |
|
dt или |
dT |
= |
αR |
|
dt . |
T −T |
mC |
|
T (T −T ) |
µPVC |
|
|||||
|
|
p |
|
p |
||||||
|
0 |
|
|
0 |
|
|
||||
Последнее выражение можно представить:
115

|
|
1 dT |
− |
1 |
|
dT |
= |
|
αR |
|
dT , |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
T |
|
T |
T T −T |
µPVC |
p |
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
0 |
|
|
|
|
|
|
o |
0 |
|
|
|
|
|
|
|
|
|
|||
его интегрирование дает: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
αRt |
|
|
||||||
|
|
lnT − |
|
ln(T −T0 ) = |
|
|
|
+ A , |
||||||||||||||
|
T |
T |
µPVC |
|
||||||||||||||||||
0 |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
p |
||||
где A постоянная интегрирования. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
− |
1 |
|
ln(T −T0 ) = |
|
|
αRt |
|
+ A |
||||||||||||
|
|
T |
|
µPVC |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
T |
|
p |
|
|
|
|||||||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T −T0 |
= Aexp(− |
αRT0t |
) . |
|
(5) |
|||||||||||||||||
|
|
|||||||||||||||||||||
|
T |
|
|
|
|
|
|
|
|
µPVCp |
|
|
|
|
||||||||
Обозначим температуру газа в баллоне в |
момент t = 0 (точка |
4) через |
T1 , а |
T1 −T0 через T1, тогда постоянная |
интегрирования А |
будет |
равна |
A = T1 T1 .
Окончательно соотношение (5) примет вид:
T −T0 |
= |
T |
= |
T1 |
exp(− |
α t |
) , |
(6) |
T |
|
|
||||||
T |
|
|
T1 |
Cpm0 |
|
|||
где учтено выражение (1) и то обстоятельство, что точки 3 и 7 лежат на одной изотерме.
После того как в момент времени t кран К перекрывается, нагрев газа в баллоне также продолжается, но уже изохорически. Давление газа в конце
концов достигает величины P2' = P0 + P2' . Для изохорического процесса
(PT = const) (участок 6-7) имеем:
P0 + P2' |
= |
P0 |
или |
P2' = |
P0 T |
. |
(7) |
|
|
||||||||
T0 |
T0 − T |
|||||||
|
|
|
T0 − T |
|
||||
С другой стороны из уравнения адиабаты (участок 3-4) имеем:
116
|
|
γ |
|
|
|
γ |
|
PT |
1−γ |
= P (T − T ) |
1−γ |
. |
|||
1 |
0 |
0 |
0 |
1 |
|
|
|
Воспользуемся формулой бинома Ньютона, пренебрегая членами второго порядка малости:
|
|
|
γ |
|
|
|
|
|
γ |
|
|
γ |
|
γ |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
PT |
1−γ |
= P (T |
1−γ |
− |
T |
1−γ |
T ) . |
|||||||||||||||
1−γ |
||||||||||||||||||||||
|
1 0 |
|
|
0 |
|
0 |
|
|
0 |
|
1 |
|||||||||||
И учитывая, что P0 = P1 − P1 получим |
|
|
|
|
|
|
|
|
|
|||||||||||||
P1 = |
|
γ P1 T1 |
и |
|
|
T1 |
= |
γ −1 P1 |
. |
(8) |
||||||||||||
|
1−γ |
|
|
T |
|
|
|
T |
|
|
γ |
|
|
P |
||||||||
|
|
|
|
|
|
0 |
|
|
0 |
|
|
|
|
|
|
1 |
|
|
||||
Решая совместно уравнения (6),(7),(8) и снова пренебрегая слагаемыми второго порядка малости, получим:
P1 |
= |
γ |
exp( |
αt |
) . |
(9) |
||
|
|
|
|
|||||
P2 |
′ |
|
γ −1 |
|
m0Cp |
|
||
Это уравнение учитывает как теплообмен с окружающей средой, так и уход
части газа из баллона в процессе нагрева. |
Уравнение позволяет найти γ по |
|||||||||||||||
измеренным при разных |
|
величинах |
t |
|
значениями |
P и |
P ′. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
Прологарифмируем выражение (9) |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
ln |
|
P1 |
= ln |
|
|
γ |
|
+ |
|
α |
t . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
P2 |
′ |
|
1 |
−γ |
|
|
m0Cp |
|
|
|||
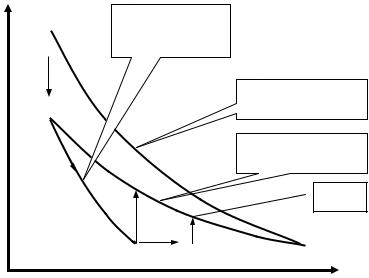
График зависимости |
ln |
P1 |
|
от |
t является |
линейной |
функцией. |
Если |
||||||||
P' |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
экстраполировать этот график по t =0, то он будет отсекать на оси ординат отрезок
b = ln( |
γ |
) . |
(10) |
|
(γ −1) |
||||
|
|
|
Потенцируя выражение (10) и преобразуя его, получим
117

γ = ebe |
b |
(11) |
−1. |
ХОД РАБОТЫ
Закрыть кран и накачать воздух в баллон (процесс1-2) так, чтобы величина P , показываемая манометром, составляла 20-25 см водного столба. Выждать не менее 2 минут, пока температуры воздуха в баллоне и окружающем пространстве не станут одинаковыми (процесс 2-3). Измерить установившееся значение величины P1. Повернув кран, соединить баллон с атмосферой и одновременно включить секундомер. Спустя t= 55 секунд снова закрыть кран баллона (точка 6). Через некоторое время (не менее 2 минут), необходимое для выравнивания температуры газа в баллоне и
окружающей среде (процесс 6-7) снова записать показание манометра |
P' . |
|
2 |
Аналогично провести измерения для времени выдержки t=50, 40, 30, 20,15, 10 и 5 секунд. Для каждого времени выдержки опыт повторить 2 раза.
ОБРАБОТКА РЕЗУЛЬТАТОВ
Используя полученные данные, необходимо построить график
ln ∆P1
∆P2
b |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
t, с |
||||
10 |
20 |
|
||||||||
Рис. 3. График зависимости ln |
∆P1 |
от t |
||||||||
∆P |
||||||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
2 |
|
||
118

зависимости ln( P1 P2' ) от t и экстраполировать его до пересечения с осью
ординат (рис.3). Величина отрезка «b», отсекаемая на отрезке ординат позволяет найти величину γ по формуле (11).
В данной работе зависимость ln( P1 P2' ) от t и оценка величины γ
статистически обрабатывается с помощью метода наименьших квадратов, который описан в приложении (возможно выполнение этой части программы в дисплейном классе на готовой программе).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что называется теплоемкостью газа?
2.Какова размерность этой физической величины?
3.Что понимается под удельной и малярной теплоемкостями газа?
4.Как они связаны между собой? Какова связь между Cp и Cv и числом степеней свободы молекул газа?
5.Получите уравнение Роберт Майера. Сколько степеней свободы имеют молекулы газов Нe, Н2, СО2?
6.Какие это степени свободы? В каком газе показатель адиабаты γ имеет наибольшее значение – N2, Нe, СН4?
7.Почему в данном эксперименте целесообразно использовать сосуд возможно большего диаметра?
8.Получите уравнение адиабаты в перемененных PT и TV. Какие явления нарушают адиабатичность расширения газа?
9.Как повлияет на ход эксперимента наличие паров воды в воздухе?
ЛИТЕРАТУРА
1. Матвеев А.Н. Молекулярная физика. -М.: Высшая школа, 1988.
119
2.Булкин П.С., Попова И.И. Общий физический практикум. -М.:
МГУ, 1988.
3.Основы физики. Курс общей физики. Т.2. Квантовая и статистическая физика / Под. ред. Ю.М. Ципенюка. -М.: Физ.-
мат. лит., 2001.
120
