фенол
.docx
Ф едеральное
государственное бюджетное образовательное
учреждение высшего образования
едеральное
государственное бюджетное образовательное
учреждение высшего образования
«Российский химико-технологический университет имени Д.И. Менделеева»
Лабораторная работа № 2
«Полуэмпирический расчет молекулы фенола методом AM1»
Выполнили:
Проверил(a):
Москва 2022 г.
Полуэмпирический расчет молекулы фенола методом АМ1.
Общий вид молекулы Общий вид молекулы с нумерацией атомов

Цель работы. Знакомство с программным комплексом HyperChem. Проведение полуэмпирического квантовохимического расчета по методу AM1 с помощью программного комплекса HyperChem и химическая интерпретация полученных результатов.
Интерпретация полученных результатов
С
 троение
молекулы фенола.
троение
молекулы фенола.
-
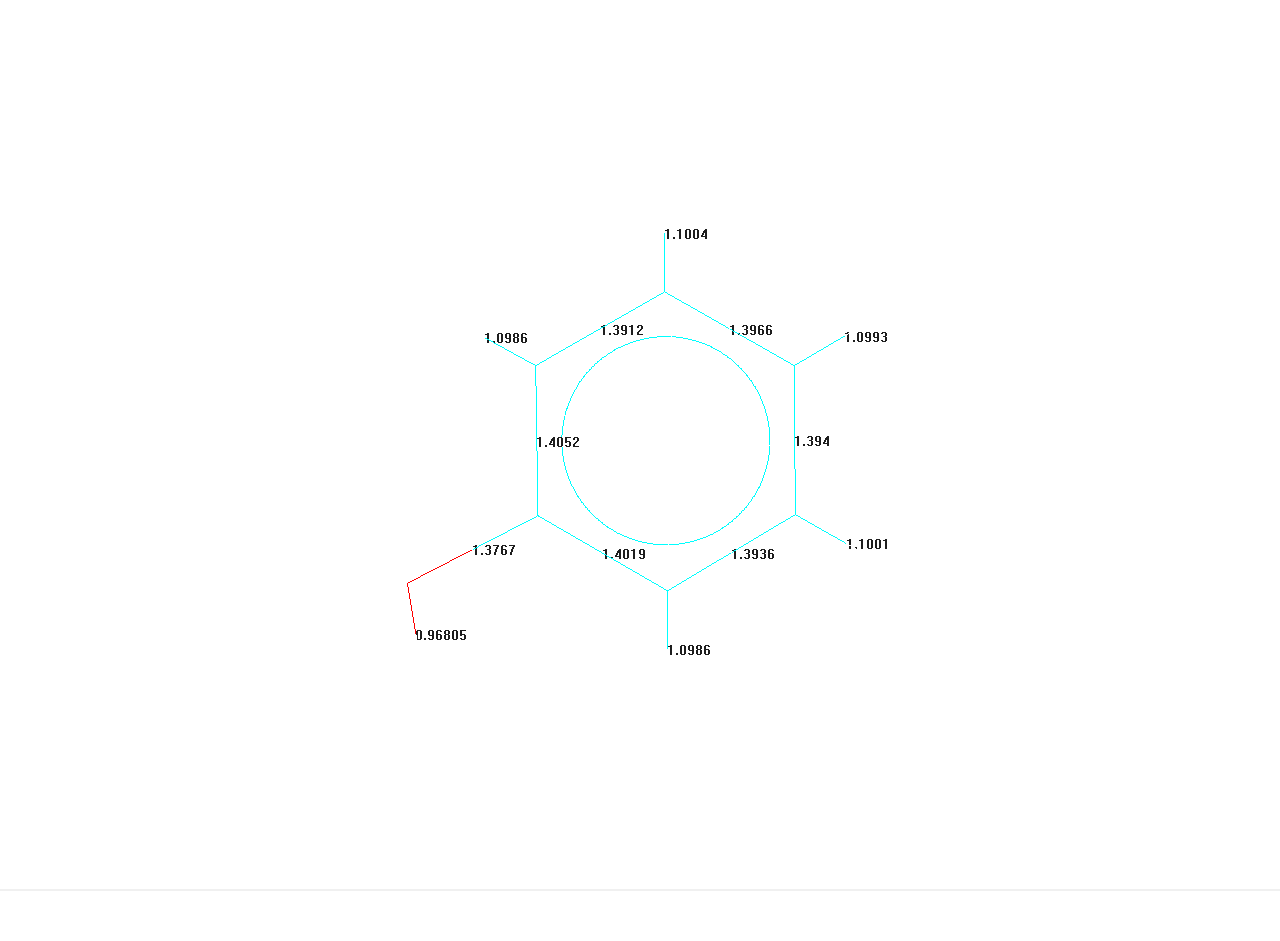
Длина связи
Данные AM1 расчета
Данные MM+ расчета
О1 – Н8
0,96805
0,943
О1 – С2
1,3767
1,360
С2 – С3
1,4052
1,399
С3 – С4
1,3912
1,397
С3 – Н9
1,00986
1,102
С4 – Н10
1,1004
1,103
С4 – С5
1,3966
1,395
С5 – Н11
1,0993
1,103
С5 – С6
1,394
1,395
С6 – С7
1,3936
1,394
С6 – Н12
1,1001
1,103
С7 – Н13
1,0986
1,101
С7 – С2
1,4019
1,399
Точность проведенного расчета составляет 0.02 Å
2. Построение диаграммы энергетических уровней. Графическое изображение ВЗМО и НВМО.
Энергия ВЗМО (№18) –9.11468 эВ; Энергия НВМО (№19) 0.39735 эВ
Энергетическая диаграмма

Вид ВЗМО Вид НВМО

3. Вклады атомных орбиталей в ВЗМО и НВМО.
|
орбиталь |
ВЗМО |
НВМО |
О1 |
Pz |
0,38416 |
-0,05555 |
С2 |
Pz |
-0,47644 |
0,17466 |
С3 |
Pz |
-0,37372 |
0,40044 |
С4 |
Pz |
0,17780 |
-0,56096 |
С5 |
Pz |
0,53194 |
0,12957 |
С6 |
Pz |
0,25445 |
0,42510 |
С7 |
pz |
-0,32626 |
-0,54210 |
Положительные значения коэффициентов при атомных орбиталях дают связывающие вклады в МО, отрицательные значения - разрыхляющие вклады
4. Определение нуклеофильных и электрофильных свойств
Энергия НВМО положительна, следовательно фенол – нуклеофил.
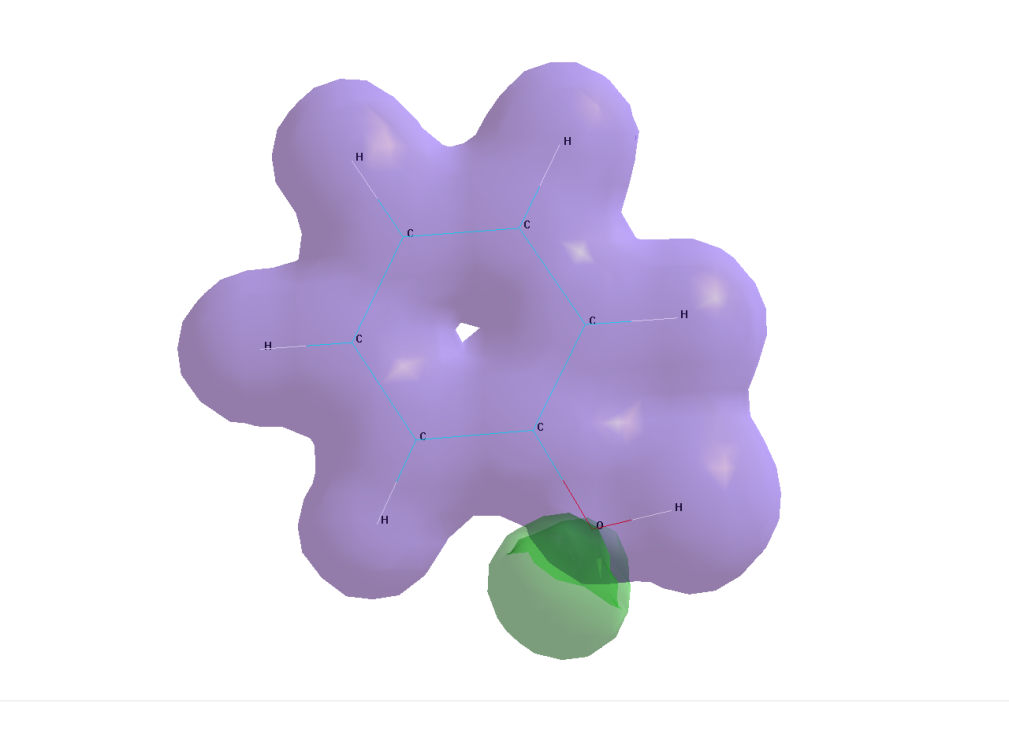
5. Построение распределения электростатического потенциала
|
Данный рисунок показывает области положительного и отрицательного распределения электростатического потенциала и визуализирует неподеленные электронные пары на атомах кислорода (зелёный цвет говорит об отрицательном значении потенциала). Это позволяет, например, сделать предположение о взаимодействии молекулы с растворителем. Очевидно, что катионы стремятся подойти к области отрицательного потенциала, анионы - к положительной области. |
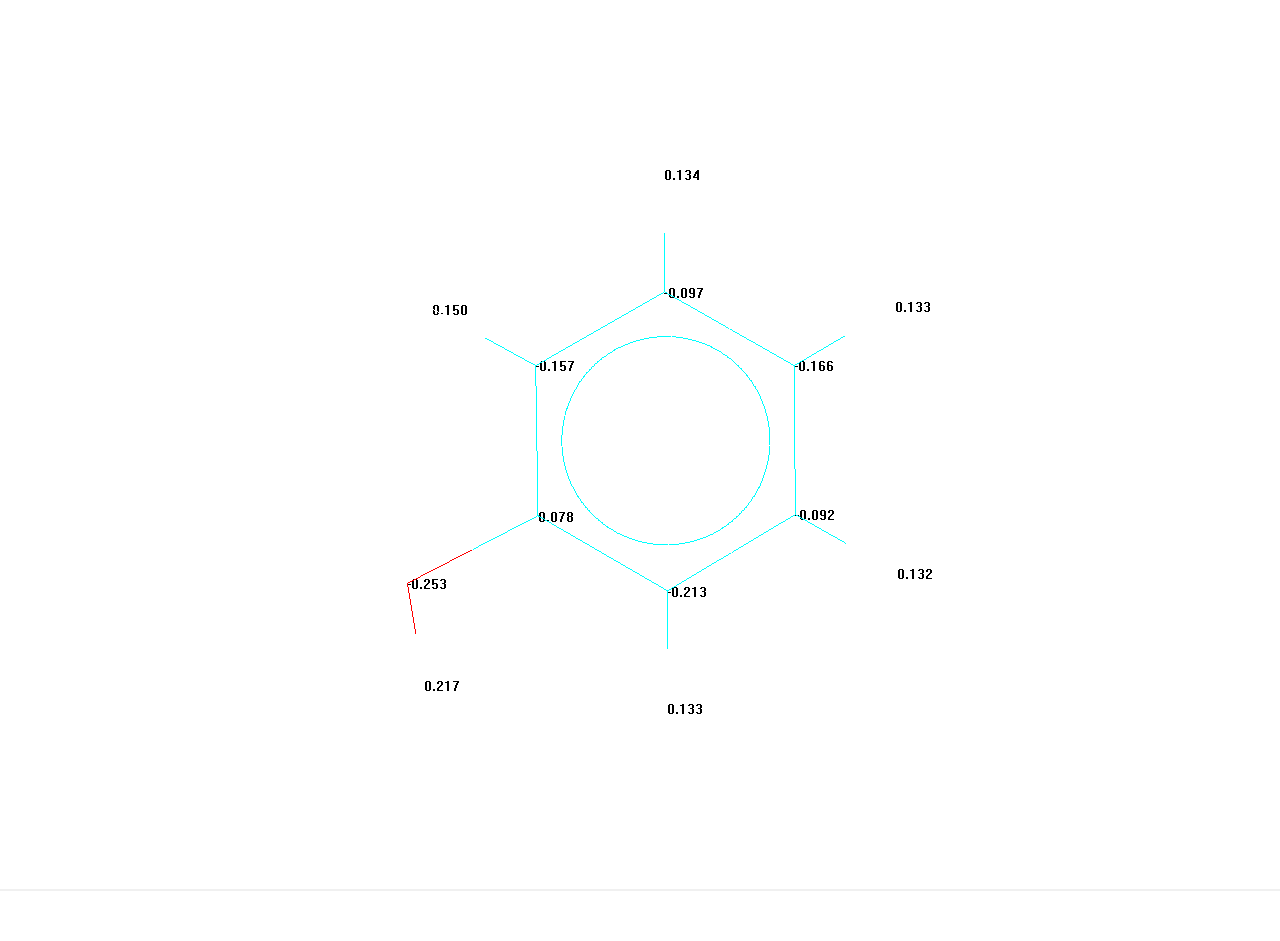
6. Квантово-химическое обоснование модели резонансных структур.
В случае молекулы фенода представляет интерес сравнить распределение заряда с классическими представлениями.
|
Атом |
Заряд |
О1 |
-0.252594 |
|
С2 |
0.077817 |
|
С3 |
-0.156698 |
|
С4 |
-0.096907 |
|
С5 |
-0.165648 |
|
С6 |
-0.091468 |
|
С7 |
-0.213520 |
|
Н8 |
0.217309 |
|
Н9 |
0.149705 |
|
Н10 |
0.133920 |
|
Н11 |
0.133292 |
|
Н12 |
0.132140 |
|
Н13 |
0.132651 |
Наблюдаемое распределение зарядов на атомах согласуется с существующим представлением, что введение в молекулу бензола донорного заместителя приводит к возрастанию отрицательного заряда в орто- и пара- положениях, в то время как в мета-положениях частичный отрицательный заряд остается незначительным по величине. Полученные результаты дают количественную оценку данного эффекта.
Полученные результаты дают количественную оценку данного эффекта.

ENERGIES AND GRADIENT
Total Energy = -27003.1469026 (kcal/mol)
Total Energy = -43.032248409 (a.u.)
Binding Energy = -1419.9192106 (kcal/mol)
Isolated Atomic Energy = -25583.2276920 (kcal/mol)
Electronic Energy = -102767.9355575 (kcal/mol)
Core-Core Interaction = 75764.7886549 (kcal/mol)
Heat of Formation = -22.4082106 (kcal/mol)
Gradient = 0.0494047 (kcal/mol/Ang)
Dipole (Debyes) = 1.233