
Пример выполнения расчетного задания. Даны молекулы LiH и VCl2.
1. Для атомов элементов, входящих в каждую из заданных молекул, запишите краткие электронные конфигурации.
–Молекула LiH (гидрид лития) состоит из атомов элементов Li и H. Краткая электронная конфигурация атомов определяется их
положением в периодической системе элементов Д.И. Менделеева (ПСЭ).
–Н находится в первом периоде в первой группе, основная подгруппа (координаты 1,I,а), значит внешний энергетический уровень – 1 (номер периода), на котором находится один электрон (номер группы). Краткая электронная конфигурация атома водорода: Н.…1s1.
–Li находится во втором периоде в первой группе, основная подгруппа (координаты 2,I,а), значит внешний энергетический уровень – 2 (номер периода), на котором находится один электрон (номер группы). Краткая электронная конфигурация атома лития: Li …2s1.
–Молекула VCl2 (хлорид ванадия) состоит из атомов элементов V и Cl.
–Cl находится в третьем периоде в седьмой группе, основная подгруппа (координаты 3,VII,а), значит внешний энергетический уровень – 3 (номер периода), на котором находятся 7 электронов (номер группы). Каждый энергетический уровень начинается с s-подуровня, затем идет р- подуровень. Два электрона расположены на s-подуровне и остальные 5 электронов – на р-подуровне. Краткая электронная конфигурация атома хлора: Cl …3s23p5.
–V находится в четвертом периоде в пятой группе, побочная подгруппа (координаты 4,V,b), значит внешний энергетический уровень – 4 (номер периода). Общее количество электронов на внешнем и предвнешнем уровнях – 5 (номер группы). 4s-подуровень полностью заполнен и на нем находятся два электрона. Остальные 3 электрона распределены на 3d- подуровне, т.к. ванадий находится в побочной подгруппе, следовательно, после 4s-подуровня происходит заполнение 3d-подуровня (правило Клечковского). Таким образом, краткая электронная конфигурация атома ванадия: V…3d34s2.
2.Покажите распределение валентных электронов по орбиталям для каждого атома в рассматриваемых молекулах.
Для графического изображения электронной конфигурации атомную орбиталь обозначают клеткой, а электрон – стрелкой, учитывая, что на s- подуровне – 1 орбиталь, на p-подуровне – 3 орбитали, на d-подуровне – 5 орбиталей, на f-подуровне – 7 орбиталей. На каждой орбитали согласно принципу Паули не может быть более двух электронов. Электроны заселяют орбитали в порядке возрастания энергии орбиталей.
–Для атома водорода: Н.…1s1 
–Для атома лития: Li.…2s1 

– Для атома хлора: Cl …3s23p5
3s 3p
– Для атома ванадия: V…3d34s2
3d 4s
3. В каждом атоме заданных молекул определите формирующий электрон и для него укажите квантовые числа.
Формирующим называется электрон, который по правилам и принципам распределения электронов по атомным орбиталям в атоме завершает электронную конфигурацию.
– Для атома водорода: Н.…1s1
Главное квантовое число определяет энергию электронной орбитали. n = 1 (формирующий электрон на первом энергетическом уровне) Орбитальное квантовое число определяет форму атомной орбитали.
l |
0 |
1 |
2 |
3 |
4 |
|
|
|
|
|
|
|
|
Энергетический |
s |
p |
d |
f |
g |
|
подуровень (АО) |
||||||
|
|
|
|
|
||
|
|
|
|
|
|
l = 0 (формирующий электрон на s-подуровне)
Магнитное квантовое число характеризует ориентацию орбитали в пространстве, принимает целочисленное значение от – l до l, включая ноль.
ml = 0
Спиновое квантовое число соответствует различным направлениям проекции вектора импульса электрона.
ms = +½ или –½
– Для атома лития: Li.…2s1
Главное квантовое число определяет энергию электронной орбитали. n = 2 (формирующий электрон на втором энергетическом уровне) Орбитальное квантовое число определяет форму атомной орбитали. l = 0 (формирующий электрон на s-подуровне)
Магнитное квантовое число характеризует ориентацию орбитали в пространстве, принимает целочисленное значение от – l до l, включая ноль.
ml = 0
Спиновое квантовое число соответствует различным направлениям проекции вектора импульса электрона.
ms = +½ или –½

– Для атома хлора: Cl …3s23p5
3s 3p
Главное квантовое число определяет энергию электронной орбитали. n = 3 (формирующий электрон на третьем энергетическом уровне) Орбитальное квантовое число определяет форму атомной орбитали. l = 1 (формирующий электрон на р-подуровне)
Магнитное квантовое число характеризует ориентацию орбитали в пространстве, принимает целочисленное значение от – l до l, включая ноль. ml = –1,0,1 (одно из значений)
Спиновое квантовое число соответствует различным направлениям проекции вектора импульса электрона.
ms = +½ или –½
– Для атома ванадия: V…3d34s2
3d 4s
Главное квантовое число определяет энергию электронной орбитали. n = 3 (формирующий электрон на третьем энергетическом уровне) Орбитальное квантовое число определяет форму атомной орбитали. l = 2 (формирующий электрон на d-подуровне)
Магнитное квантовое число характеризует ориентацию орбитали в пространстве, принимает целочисленное значение от – l до l, включая ноль. ml = –2,–1,0,1,2 (одно из значений)
Спиновое квантовое число соответствует различным направлениям проекции вектора импульса электрона.
ms = +½ или –½
4. Перечислите электронные аналоги элементов, входящих в каждую из заданных молекул.
Элементы с аналогичными электронными структурами называются элементами-аналогами. В ПСЭ они расположены в одной подгруппе.
Для водорода и лития элементами-аналогами являются элементы I группы главной (А) подгруппы:
Na …3s1 K …4s1 Rb …5s1 Cs …6s1 Fr …5s1
Для хлора элементами-аналогами являются элементы VII группы главной (А) подгруппы (галогены):
F |
…2s22p5 |
Br |
…4s24p5 |
I …5s24p5 At …6s24p5
Для ванадия элементами-аналогами являются элементы V группы побочной (В) подгруппы:
Nb
Ta
Db
5. Укажите возможные валентности атомов в основном и возбужденном состояниях.
Валентность (В) – способность атомов присоединять или замещать определенное число других атомов с образованием химических связей, которые, согласно методу валентных связей (ВС), образуются между атомами, имеющими неспаренные электроны (расположенные по одному на каждой орбитали).
Для атома лития и атома водорода возможная валентность В=1. Для атома хлора в основном состоянии В=1.
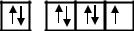
Cl …3s23p5
При сообщении атому энергии (в результате столкновения с другим атомом, поглощения кванта света и т.п.) один или несколько электронов в атоме могут перейти на подуровни с более высокой энергией в пределах только одного энергетического уровня. В этом случае атом становится возбужденным и такой атом принято изображать со звездочкой (*)
Сl* …3s13p33d3
.
Cl* |
|
|
|
|
|
|
|
|
|
|
|
|
B* = 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl* |
|
|
|
|
|
|
|
|
|
|
|
|
B* = 5 |
Cl* |
|
|
|
|
|
|
|
|
|
|
|
|
B* = 7 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5s |
|
|
5p |
|
|
|
5d |
|||||
|
|
|
|
|
|
|
|
|
|||||
Валентность хлора в возбужденном состоянии B*= 3,5,7
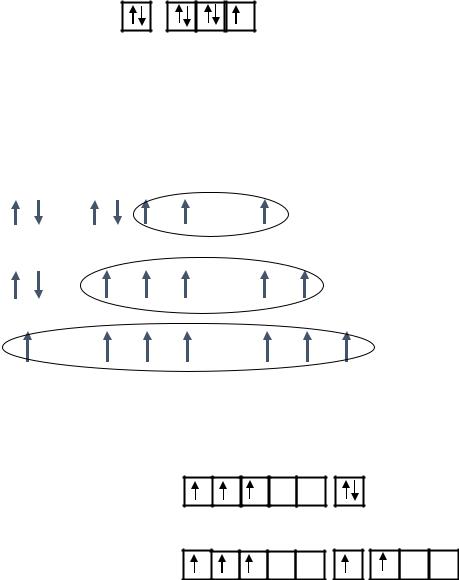
Для атома |ванадия в основном состоянии В=0, т.к. на внешнем энергетическом уровне нет неспаренных электронов.
V…3d34s2
В возбужденном состоянии:
V…3d34s14p1
Валентность ванадия в возбужденном состоянии B*= 2,3,4,5.
6. Охарактеризуйте и объясните положение каждого атома заданных молекул (порядковый номер, период, группа, подгруппа) в периодической системе элементов Д.И. Менделеева (короткопериодный вариант).
См. теоретическую часть в учебнике Н. В. Коровин. Общая химия. М.: Высшая школа, 2008 (и позже).
