
новая папка 1 / 287894
.pdf
2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ
Задачи 161–173. Определите направление самопроизвольного протекания окислительно-восстановительной реакции, протекающей в гальваническом элементе. Ответ мотивируйте. Напишите уравнения анодной и катодной полуреакций. Рассчитайте измене-
ние стандартной энергии Гиббса реакции rG2980 , используя значения стандартных редокс-потенциалов.
№ |
Уравнение |
φ0, В |
п/п |
окислительно-восстановительной реакции |
|
|
|
0 |
|
2 |
|
= – 0,48 |
|||||
161 |
3S + 6KOH = 2K2S + K2SO3 + 3H2O |
S/S |
|
|
|
|
|
|
|
||
0 |
2 |
|
|
|
= 0,45 |
||||||
|
|
/S |
|
||||||||
|
|
SO3 |
|
|
|
|
|||||
|
|
Cr0 |
|
O2 |
/Cr3 = 1,33 |
||||||
162 |
3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O |
2 |
|
|
7 |
|
|
|
|||
0 |
2 |
|
|
|
= 0,17 |
||||||
|
|
SO4 |
|
|
/SO2 |
||||||
|
5S + 2MnSO4 + 8H2O + K2SO4 = 2KMnO4 + |
0 |
|
|
|
|
|
|
= 0,14 |
||
163 |
S/H2S |
|
|
|
|||||||
0MnO4 /Mn2 = 1,51 |
|||||||||||
|
+ 3H2SO4 + 5H2S |
||||||||||
|
|
0 |
|
|
|
|
|
= 1,36 |
|||
164 |
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl+ 2CrCl3 + 7H2O |
Cl2 /Cl |
|
|
|
||||||
Cr0 |
|
O2 |
/Cr3 = 1,33 |
||||||||
|
|
2 |
|
|
7 |
|
|
|
|||
|
|
0 |
|
|
|
|
|
= 1,36 |
|||
165 |
3Cl2 + KI + 3H2O = KIO3 + 6HCl |
Cl2 /Cl |
|
|
|
||||||
0 |
|
|
|
|
|
|
|
= 1,09 |
|||
|
|
|
/I |
|
|
||||||
|
|
IO3 |
|
|
|
|
|||||
|
2MnSO4 + 8H2O + 5I2 + 6K2SO4 = 2KMnO4 + |
0 |
|
|
|
|
= 0,62 |
||||
166 |
I2 /I |
|
|
|
|
|
|
||||
+ 8H2SO4 + 10KI |
0 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
MnO4 /Mn2 = 1,51 |
|||||||||
|
|
0F /F = 2,87 |
|||||||||
167 |
2KF + 2FeCl3 = F2 + 2FeCl2 + 2KCl |
2 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
2 = 0,77 |
|||
|
|
3 |
/Fe |
||||||||
|
|
Fe |
|
|
|
|
|||||
|
KВr + 2KNO2 + 2H2SO4 = Вr2 + 2NO + 2K2SO4 + |
0 |
|
|
|
|
|
= 1,06 |
|||
168 |
Br2 /Br |
|
|
|
|||||||
|
+ 2H2O |
0 |
|
|
|
|
|
|
|
|
|
|
|
NO2 /NO = 1,2 |
|||||||||
11

№ |
Уравнение |
φ0, В |
п/п |
окислительно-восстановительной реакции |
|
|
|
|
0 |
|
|
|
|
= 1,36 |
|
169 Cl2 + 2KOH = KClO + KCl + H2O |
|
Cl2 /Cl |
|
|
|||||
|
0 |
|
|
|
|
|
= 1,63 |
||
|
|
|
|
|
|
|
|
||
|
|
|
ClO |
|
/Cl2 |
||||
|
|
|
0 |
|
|
|
|
= 1,36 |
|
170 2KMnO4 + 2KCl = Cl2 + 2K2MnO4 |
|
Cl2 /Cl |
|
|
|||||
|
0 |
|
|
|
|
|
2 = 0,56 |
||
|
|
|
|
|
|
|
|
||
|
|
|
MnO4 |
/MnO4 |
|||||
|
|
|
0 |
|
|
|
|
= 1,36 |
|
171 2NaCl + Fe2(SO4)3 = 2FeSO4 |
+ Cl2 |
+ Na2SO4 |
Cl2 /Cl |
|
|
||||
0 |
|
|
|
|
|
2 = 0,77 |
|||
|
|
|
3 |
/Fe |
|||||
|
|
|
Fe |
|
|
|
|
||
|
|
|
0 |
|
|
|
|
= 1,36 |
|
172 KClO3 + 5KCl + 3H2O = 3Cl2 |
+ 6KOH |
Cl2 /Cl |
|
|
|||||
0 |
|
|
|
|
|
= 1,47 |
|||
|
|
|
|
|
|
|
|
||
|
|
|
ClO3 |
/Cl2 |
|||||
173 3Na2S + K2Cr2O7 + 7H2SO4 = 3S + Cr2(SO4)3 + |
0 |
|
2 = – 0,48 |
||||||
S/S |
|
|
|
|
|||||
Cr0 |
|
O2 /Cr3 = 1,33 |
|||||||
+ 3Na2SO4 + K2SO4 + 7H2O |
|
|
|
||||||
|
|
|
2 |
|
|
7 |
|
|
|
12

Задачи 174–185. По приведенным полуреакциям и значениям стандартных редокс–потенциалов напишите ионно–молекулярное уравнение самопроизвольного протекания окислительно–восста– новительной реакции, протекающей в гальваническом элементе. Ответ мотивируйте. Рассчитайте ЭДС и стандартное изменение
энергии Гиббса реакции rG2980 .
№ |
Уравнения полуреакции |
φ0, В |
п/п |
|
|
MnO2 + 4Н+ + 2 e |
Mn2+ + 2H2O |
0MnO2 /MnO2 = 1,23 |
||||||||||
174 |
|
|
|
|
|
|
|
|
|
|
|
|
Вr2 + 2 e |
2Вr – |
0Br /Br = 1,06 |
||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
||
Sn4+ + 2 e Sn2+ |
Sn0 |
4 /Sn2 = 0,15 |
||||||||||
175 |
|
|
|
|
|
|
|
|
|
|
|
|
H2O2 + 2Н+ + 2 e 2H2O |
0H2O2 /H2O = 1,78 |
|||||||||||
– |
+ |
|
|
MnO2 + 2H2O |
0 |
|
|
|
|
|
|
= 1,69 |
MnO4 + 4Н + 3 e |
|
MnO4 |
/MnO2 |
|||||||||
176 |
|
|
|
|
|
|
|
|
|
|
|
|
Вr2 + 2 e |
2Вr – |
0Br /Br = 1,06 |
||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
||
– |
+ |
|
2+ |
0 |
|
|
|
|
/Mn |
2 = 1,51 |
||
MnO4 + 8Н + 5 e |
|
|
Mn + 4H2O |
MnO4 |
|
|||||||
177 |
|
|
|
|
|
|
|
|
|
|
|
|
NO3– + 3Н+ + 2 e |
НNO2 + H2O |
0 |
|
|
|
|
|
= 0,94 |
||||
|
|
|
|
|
NO3 |
/HNO2 |
||||||
Fe3+ + e |
Fe2+ |
|
0Fe3 /Fe2 = 0,77 |
|||||||||
178 |
|
|
|
|
0 |
|
|
|
|
|
|
|
ClO3– + 6H+ + 6 e |
Cl– + 3H2O |
|
|
|
|
= 1,45 |
||||||
|
|
|
|
|
ClO3 |
/Cl |
|
|
||||
Fe3+ + e |
Fe2+ |
|
0Fe3 /Fe2 = 0,77 |
|||||||||
179 |
|
|
|
|
Cr0 |
|
|
|
|
|
|
|
CrO42– + 8Н+ + 3 e |
Cr3+ + 4H2O |
|
O2 /Cr3 = 0,55 |
|||||||||
|
|
|
|
|
2 |
|
|
4 |
|
|
|
|
Fe3+ + e |
Fe2+ |
|
0Fe3 /Fe2 = 0,77 |
|||||||||
180 |
|
|
|
|
0 |
|
|
|
|
|
|
|
I2 + 2 e 2I – |
|
|
|
|
|
= 0,62 |
||||||
|
|
|
|
|
I2 /I |
|
|
|
|
|
||
13
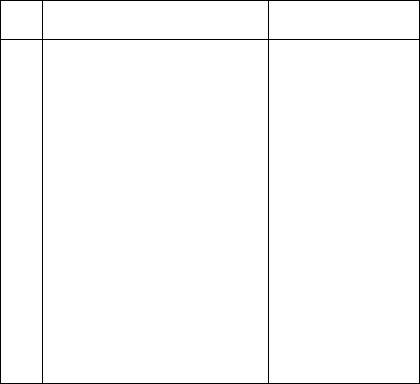
№ |
Уравнения полуреакции |
φ0, В |
п/п |
|
|
2– |
+ 8 e |
|
+ 10Н |
+ |
H2S + 4H2O |
0 2 |
/H2S |
= 0,30 |
||||||||
SO4 |
|
|
|
SO4 |
|
|
|
|||||||||
181 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вr2 + 2 e |
2Вr – |
|
|
|
0Br /Br = 1,06 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
– |
+ |
|
|
|
2+ |
+ 4H2O |
0 |
|
|
/Mn |
2 = 1,51 |
||||
MnO4 |
+ 8Н + 5 e |
|
Mn |
MnO4 |
|
|||||||||||
182 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вr2 + 2 e |
2Вr – |
|
|
|
0Br /Br = 1,06 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
Fe3+ + e |
Fe2+ |
|
|
|
0Fe3 /Fe2 = 0,77 |
|||||||||||
183 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
MnO4– + 8Н+ + 5 e |
Mn2+ + 4H2O |
|
|
/Mn |
2 = 1,51 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
MnO4 |
|
|||||
– |
+ H2O + 2 e |
|
|
– |
|
– |
0 |
|
|
/Cl |
= 0,89 |
|||||
ClO |
|
Cl + 2OН |
|
ClO |
|
|
|
|
||||||||
184 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I2 + 2 e 2I – |
|
|
|
|
|
0 |
= 0,62 |
|||||||||
|
|
|
|
|
|
|
|
|
|
I2 /I |
|
|
|
|
|
|
|
– |
+ |
|
|
MnO2 + 2H2O |
0 |
|
|
|
|
= 1,69 |
|||||
MnO4 |
+ 4Н + 3 e |
|
MnO4 |
/MnO2 |
||||||||||||
185 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MnO2 + 4Н+ + 2 e |
Mn2+ + 2H2O |
0MnO2 /Mn2 = 1,23 |
||||||||||||||
14
Задачи 186–205. Рассчитайте значения редокс-потенциала полуреакции по известным значениям рН, стандартного редокспотенциала и активностей окисленной и восстановленной форм ионов. При каких значениях рН окислительные свойства процесса выражены сильнее?
№ |
Полуреакция |
0ОФ , В |
рН |
аОФ; аВФ, |
||
п/п |
|
|
ВФ |
|
моль/л |
|
186 |
MnO4(p) 8 H 5e Mn(p)2 4 H2O |
1,53 |
3 |
0,1; |
0,01 |
|
187 |
СlO3 (p) H2O 2e |
ClO2(p) 2 OH |
0,26 |
11 |
0,002; 0,02 |
|
188 |
Cr2O72 (p) 14H 6e 2Cr3 (p) 7H2O |
1,33 |
1 |
0,003; 0,05 |
||
189 |
FeO42 (p) 8H 3e Fe3 (p) 4 H2O |
1,90 |
2 |
0,009; 0,02 |
||
190 |
2СlO (p) 2H2O 4e 2Cl (p) 4OH |
0,92 |
9 |
0,008; 0,03 |
||
191 |
BrO4 (p) 2H 2e |
BrO3 (p) H2O |
1,76 |
5 |
0,007; 0,04 |
|
192 |
СlO2 (p) H2O 2e |
ClO (p) 2OH |
0,68 |
8 |
0,006; 0,05 |
|
193 |
NO3 (p) H2O 2e NO2(p) 2OH |
0,01 |
10 |
0,005; 0,06 |
||
194 |
NiO(OH)(т) 3H e Ni2 (p) 2 H2O |
2,25 |
2 |
0,004; 0,07 |
||
195 |
PbO2(т) 4H 2e |
Pb2 (p) 2H2O |
1,46 |
4 |
0,003; 0,08 |
|
196 |
HSO3 (p) 5H 4e S(т) 3H2O |
0,48 |
5 |
0,003; 0,09 |
||
197 |
SO42 (p) 5H2O 8e HS (p) 9OH |
–0,7 |
9 |
0,001; 0,001 |
||
198 |
SO42 (p) 3H 2e HSO3 (p) H2O |
0,11 |
1 |
0,09; |
0,002 |
|
199 |
NO3 (p) 10 H 8e NH4 (p) 3H2O |
0,88 |
3 |
0,08; |
0,003 |
|
200 |
MnO4 (p) 2H2O 3e MnO2(т) 4OH |
0,62 |
8 |
0,07; |
0,004 |
|
201 |
HIO(p) H 2e I (p) H2O |
0,99 |
4 |
0,06; |
0,005 |
|
202 |
ClO3 (p) H2O 2e ClO2 (p) 2OH |
0,27 |
10 |
0,05; |
0,006 |
|
203 |
ClO4 (p) 8H 8e Cl (p) 4 H2O |
1,39 |
2 |
0,04; |
0,007 |
|
204 |
HCrO4 (p) 7 H 3e Cr3 (p) 4 H2O |
1,36 |
5 |
0,03; |
0,008 |
|
205 |
IO3 (p) 6 H 6e I (p) 3H2O |
1,08 |
3 |
0,02; |
0,009 |
|
15

Задачи 206–215. Концентрационный гальванический элемент состоит из двух металлических электродов с разной концентрацией соли металла в катодном ( С1 ) и анод-
ном ( С2 ) пространствах. Определите максимальную работу
гальванического элемента, если масса катода увеличилась на т грамм. Коэффициенты активности ионов примите равными единице.
№ п/п |
Металл |
Соль |
С1, моль/л |
С2 , моль/л |
т, г |
|
|
|
|
|
|
206 |
Cu |
CuSO4 |
0,01 |
0,005 |
5,0 |
207 |
Zn |
ZnSO4 |
0,02 |
0,004 |
4,5 |
208 |
Fe |
FeSO4 |
0,03 |
0,003 |
4,0 |
209 |
Cr |
CrCl3 |
0,04 |
0,002 |
3,5 |
210 |
Co |
CoCl2 |
0,05 |
0,001 |
3,0 |
211 |
Ni |
NiSO4 |
0,04 |
0,009 |
2,5 |
212 |
Mn |
MnSO4 |
0,03 |
0,008 |
2,0 |
213 |
Sn |
Sn(NO3)2 |
0,02 |
0,007 |
1,5 |
214 |
Pb |
Pb(NO3)2 |
0,01 |
0,006 |
1,0 |
215 |
Ag |
AgNO3 |
0,009 |
0,005 |
0,5 |
Задачи 216–225. Рассчитайте время электролиза расплава электролита при известных значениях силы тока и массы выделившегося на катоде металла. Напишите уравнения электродных процессов.
№ п/п |
Электролит |
m, г |
I, А |
|
|
|
|
216 |
NaOH |
200 |
27 |
217 |
LiCl |
240 |
10 |
218 |
MgCl2 |
115 |
24 |
219 |
KF |
320 |
37 |
220 |
RbCl |
190 |
13 |
221 |
CsOH |
407 |
19 |
222 |
KCl |
370 |
12 |
223 |
NaF |
510 |
25 |
224 |
LiOH |
250 |
16 |
225 |
BaCl2 |
560 |
20 |
16
Задачи 226–235. Рассчитайте объем выделившегося на катоде водорода при электролизе водного раствора сульфата натрия Nа2SO4 с инертным анодом, если известны время электролиза и объем выделившегося на аноде кислорода.
№ |
VO2 , мл |
t, мин |
|
п/п |
|||
|
|
||
|
|
|
|
226 |
22,4 |
8 |
|
227 |
84,0 |
15 |
|
228 |
56,0 |
22 |
|
229 |
112,0 |
39 |
|
230 |
50,4 |
20 |
|
231 |
117,0 |
45 |
|
232 |
61,6 |
28 |
|
233 |
103,0 |
31 |
|
234 |
40,8 |
12 |
|
235 |
11,2 |
4 |
Задачи 236–245. Рассчитайте молярную массу эквивалентов металла, выделившегося на катоде, если известны масса выделившегося металла, сила тока и время электролиза.
№ |
m, г |
I, А |
t, мин |
|
п/п |
||||
|
|
|
||
|
|
|
|
|
236 |
2,96 |
5 |
30 |
|
237 |
12,88 |
16 |
12 |
|
238 |
9,31 |
12 |
19 |
|
239 |
1,79 |
11 |
8 |
|
240 |
2,81 |
6 |
27 |
|
241 |
1,75 |
10 |
5 |
|
242 |
22,42 |
12 |
29 |
|
243 |
6,91 |
15 |
32 |
|
244 |
20,15 |
13 |
42 |
|
245 |
6,05 |
7 |
20 |
17
Задачи 246–255. Для нанесения металлического покрытия изделие с площадью поверхности S поместили в электролизер. Определите толщину слоя покрытия , если процесс протекает в
течение t мин при известных силе тока |
I, выходе по току и |
|||||||
плотности металла М. |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Металл |
|
2 |
I, А |
|
|
, % |
М, |
№ п/п |
покрытия |
Электролит |
S, м |
|
t, мин |
кг/м3 |
||
246 |
Co |
CoSO4 |
3,0 |
4,0 |
|
100 |
76 |
8900 |
247 |
Ni |
NiCl2 |
2,8 |
3,5 |
|
200 |
82 |
8900 |
248 |
Cu |
CuSO4 |
2,6 |
3,0 |
|
300 |
91 |
8920 |
249 |
Ag |
AgNO3 |
2,4 |
2,5 |
|
400 |
98 |
10490 |
250 |
Fe |
FeSO4 |
2,2 |
2,0 |
|
500 |
70 |
7860 |
251 |
Cd |
CdSO4 |
2,0 |
1,5 |
|
600 |
83 |
8640 |
252 |
Zn |
ZnCl2 |
1,8 |
1,0 |
|
700 |
85 |
7140 |
253 |
Pb |
Pb(NO3)2 |
1,6 |
2,0 |
|
800 |
92 |
11350 |
254 |
Sn |
Sn(NO3)2 |
1,4 |
3,0 |
|
900 |
90 |
7280 |
255 |
Cr |
CrCl3 |
1,2 |
4,0 |
|
1000 |
74 |
7200 |
18
3. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Задачи 256–265. Расчетами ЭДС коррозионного элемента и энергии Гиббса rG2980 коррозионного процесса определите воз-
можность коррозии металлического изделия в деаэрированном растворе при известных значениях водородного показателя рН и
активности ионов корродирующего металла aMZ . Напишите
уравнения электродных процессов. Парциальное давление водорода над раствором примите равным стандартному.
№ |
Металл |
0 Z+ , |
рН |
a |
M |
Z ·103, |
№ |
Металл |
0 Z+ , |
рН |
a |
M |
Z ·103, |
п/п |
изделия |
M B/M |
|
|
п/п |
изделия |
M B/M |
|
|
||||
|
моль/л |
|
моль/л |
||||||||||
256 |
Mg |
−2,366 |
6,0 |
|
|
1,5 |
261 |
Ni |
−0,256 |
5,8 |
|
|
4,6 |
257 |
Zn |
−0,763 |
8,1 |
|
|
6,2 |
262 |
Sn |
−0,136 |
7,4 |
|
|
0,5 |
258 |
Cо |
−0,278 |
4,5 |
|
|
0,8 |
263 |
Pb |
−0,126 |
6,5 |
|
|
7,7 |
259 |
Fe |
−0,440 |
5,2 |
|
|
1,3 |
264 |
Cu |
+0,337 |
3,2 |
|
|
0,3 |
260 |
Al |
−1,662 |
8,4 |
|
|
0,6 |
265 |
Cd |
−0,403 |
4,8 |
|
|
2,5 |
Задачи 266–275. Контактирующие изделия из металлов М1 и М2 находятся в аэрированном растворе при известных значениях водородного показателя рН и активности ионов корродирующего
металла aMZ . Определите, какой металл корродирует. Напишите
уравнения электродных процессов и суммарной реакции. Рассчитайте ЭДС коррозионного элемента и энергию Гиббса rG2980
коррозионного процесса. Парциальное давление кислорода над раствором примите равным стандартному.
№ |
М1 |
0 Z+ |
, B |
М2 |
0 Z+ |
, B |
рН |
a |
M |
Z ·103, моль/л |
п/п |
|
M1 |
/M1 |
|
M2 |
/M2 |
|
|
|
|
266 |
Al |
−1,662 |
Fe |
−0,440 |
7,8 |
|
|
4,6 |
||
267 |
Zn |
−0,763 |
Cd |
−0,403 |
8,6 |
|
|
0,5 |
||
268 |
Fe |
−0,440 |
Zn |
−0,763 |
7,0 |
|
|
7,7 |
||
269 |
Sn |
−0,136 |
Mg |
−2,366 |
6,2 |
|
|
0,3 |
||
270 |
Ni |
−0,256 |
Ag |
0,799 |
5,7 |
|
|
2,5 |
||
271 |
Cu |
0,337 |
Sn |
−0,136 |
5,2 |
|
|
0,8 |
||
272 |
Ag |
0,799 |
Ni |
−0,256 |
4,8 |
|
|
1,3 |
||
273 |
Pb |
−0,126 |
Al |
−1,662 |
8,8 |
|
|
0,6 |
||
274 |
Fe |
−0,440 |
Sn |
−0,136 |
7,0 |
|
|
1,8 |
||
275 |
Mg |
−2,366 |
Cu |
0,337 |
6,5 |
|
|
5,6 |
||
19
Задачи 276–285. В результате влажной атмосферной коррозии металлического изделия образовалось m грамм гидроксида M(OH)2. Напишите уравнения электродных процессов и суммарной реакции. Вычислите массу прокорродировавшего металла и объем (при н. у.) поглощенного газа.
№ |
Металл изделия |
mM(OH)2, г |
п/п |
|
|
276 |
Sn |
0,018 |
277 |
Pb |
0,112 |
278 |
Cd |
0,241 |
279 |
Fe |
0,125 |
280 |
Zn |
0,262 |
281 |
Mn |
0,304 |
282 |
Ni |
0,115 |
283 |
Mg |
0,096 |
284 |
Cu |
0,214 |
285 |
Mn |
0,157 |
Задачи 286–295. На сколько уменьшилась масса анода за время t, если в коррозионном элементе катодный процесс протекает с поглощением кислорода? Объем газа приведен при Т = 298 K и p = 101,3 кПа.
№ |
Металл анода |
VO2 , мл |
t, мин |
|
п/п |
||||
|
|
|
||
|
|
|
|
|
286 |
Al |
50,4 |
1,0 |
|
287 |
Ni |
67,2 |
5,0 |
|
288 |
Fe |
56,0 |
1,5 |
|
289 |
Co |
84,0 |
4,0 |
|
290 |
Zn |
106,4 |
3,5 |
|
291 |
Sn |
112,0 |
5,0 |
|
292 |
Mn |
28,0 |
2,5 |
|
293 |
Pb |
61,6 |
4,5 |
|
294 |
Mg |
78,6 |
3,0 |
|
295 |
V |
117,6 |
2,0 |
20
