
- •1. Опишите классификацию и номенклатуру оксидов, приведите примеры соединений
- •2.Опишите способы получения оксидов, приведите примеры химических реакций .
- •3. Опишите химические свойства оксидов
- •4.Опишите классификацию и номенклатуру основания, приведите примеры
- •5.Опишите способы получения оснований
- •6.Опишите химические свойства оснований
- •8.Опишите способы получения кислот
- •9.Опишите химические свойства кислот
- •10.Опишите классификацию и номенклатуру солей, приведите примеры
- •11.Опишите способы получения средних солей
- •17) Атомный радиус
- •19.Параметры химической связи
- •20)Зависимость потенциальной энергии
- •21)Основное и возбужденное состояния атома
- •22. Подходы к описанию химической связи в молекулах( с позиций квантово механической теории)
- •23. Механизмы образования ковалентной связи:
- •24) Способы перекрывания электронных облаков
- •25.Виды гибридизации
- •26)Свойства ковалентной связи
- •27.Ионная связь.
- •28.Водородная связь
- •29.Межмолекулярное взаимодействие
- •30.Виды растворов: Газообразный р-р Жидкий р-р Твердый
- •31. Осмос
- •32.Основные положения тэд Аррениуса
- •33.Электролитическая диссоциация
- •44. Общие правила:
- •45. Механизм: донорно – акцепторный Комплексообразователь – акцептор (имеет вакантные орбитали на валентном уровне Лиганд – донор (имеет неподеленные электронные пары на валентном уровне)
- •46. Описывает влияние природы (кристаллического поля) лигандов на электронные орбитали комплексообразователя и свойства комплексных соединений.
44. Общие правила:
1.Большинство комплексных соединений соли и называется сначала анион а потом катион в родительном падеже.
2.Внутренняя сфера называется одним длинным словом.
3.Название нейтральных лигандов соответствует названиям молекул за исключением: Н2О – аква NH3 – аммин CO - карбонил
4. Название анионных лигандов: + суффикс [о] Cl- - хлоро, Br- -бромо, OH- - гидроксо, СN- - циано, SO42- -сульфато
5.Количество лигандов указывается в приставках: 2 – ди, 3 – три, 4-тетра, 5 – пента, 6 – гекса, 7 – гепта
[Cu(NH3)4]Cl2 Заряд комплексного иона [Cu(NH3)4]2+ Комплексообразователь - Cu2+ Лиганды - NH3 Координационное число - 4 [Cu(NH3)4]. Название: хлорид тетраамминмеди (II)
45. Механизм: донорно – акцепторный Комплексообразователь – акцептор (имеет вакантные орбитали на валентном уровне Лиганд – донор (имеет неподеленные электронные пары на валентном уровне)
ФОРМА комплексной частицы определяется с использованием КОНЦЕПЦИИ ГИБРИДИЗАЦИИ
Л. Полинг установил, что число орбиталей центрального атома, участвующих в образовании комплексного соединения, равно числу окружающих лигандов
Позволяет
определить: форму внутренней координационной
сферы магнитные свойства Не позволяет
определить: оптические свойства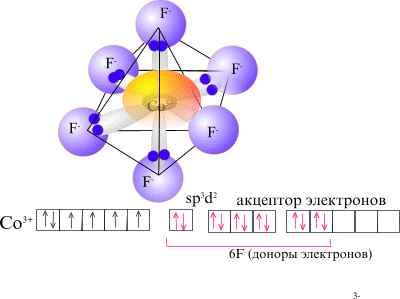
[CoF6]3-
Комплексообразователь: Co3+ 3d64s0 Лиганды: F-
Высокоспиновый, Парамагнитный (пример стр 17, 9 лекция)
46. Описывает влияние природы (кристаллического поля) лигандов на электронные орбитали комплексообразователя и свойства комплексных соединений.
Позволяет определить: форму внутренней координационной сферы магнитные свойства оптические свойства
ЛИГАНДЫ имеют заряд или обладают дипольным моментом, следовательно образуют вокруг комплексообразователя электростатическое поле. РЕЗУЛЬТАТ: расщепление валентных орбиталей комплексообразователя
Позволяет определить: форму внутренней координационной сферы магнитные свойства оптические свойства

47. 1.Параметр ( энергия) расщепления – Δ Параметр расщепления определяется как разность в энергиях между расщепленными подуровнями под действием электростатического поля лигандов ( е - дважды вырожденное состояние, t - трижды вырожденное)
Δ зависит от:
1.Числа лигандов
2.Типа химической связи между лигандами и комплексообразователем
3.Геометрии комплекса
4.Степени окисления комплексообразователя

Δтетр = 4/9 Δокт
48.
ИЗОМЕРАМИ называются соединения, имеющие
одинаковый
состав, но разное строение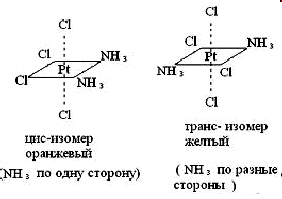
1.ГЕОМЕТРИЧЕСКАЯ ( cis-trans )Проявляется для комплексов с разными лигандАМИ.
2. ИОНИЗАЦИОННАЯ ИЗОМЕРИЯ – различное распределение ионов между внутренне й и внешней координационными сферами
[Pt(NH3)4Br2]Cl2 [Pt(NH3)4Cl2]Br2
яркая бледная
оранжево-желтая окраска
![]()
3. СОЛЬВАТНАЯ ИЗОМЕРИЯ – различное распределение молекул растворителя между внутренней и внешней координационными сферами
Растворитель H2O – ГИДРАТНАЯ изомерия
[Cr(NH3)6]3+ × nH2O

4. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (ЗЕРКАЛЬНАЯ) - связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая.
5. КООРДИНАЦИОННАЯ ИЗОМЕРИЯ - различное распределение лигандов во внутренних координационных сферах комплексов. Присуща соединениям, состоящим из комплексного катиона и комплексного аниона, центральные атомы которых различны
[Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4] [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6]
49. [Ag(NH3)2]Cl
1.Первичная диссоциация: Процесс диссоциации комплексной соли на внутреннюю сферу + ионы внешней сферы ( как сильный электролит) [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- 2. Вторичная диссоциация: Процесс ступенчатого отщепления лигандов от иона комплексообразователя ( как слабый электролит) [Ag(NH3)2]+ = [Ag(NH3)]+ + NH3 [Ag(NH3)]+ = Ag+ + NH3 / [Ag(NH3)2]+ = Ag+ + 2 NH3
[Ag(NH3)2]+ = Ag+ + 2 NH3
КОНСТАНТА УСТОЙЧИВОСТИ
Бета= [[Ag(NH3)2]+] / [Ag+] [NH3]2
Чем выше константа устойчивости, тем
прочнее комплексная частица
