
- •1. Опишите классификацию и номенклатуру оксидов, приведите примеры соединений
- •2.Опишите способы получения оксидов, приведите примеры химических реакций .
- •3. Опишите химические свойства оксидов
- •4.Опишите классификацию и номенклатуру основания, приведите примеры
- •5.Опишите способы получения оснований
- •6.Опишите химические свойства оснований
- •8.Опишите способы получения кислот
- •9.Опишите химические свойства кислот
- •10.Опишите классификацию и номенклатуру солей, приведите примеры
- •11.Опишите способы получения средних солей
- •17) Атомный радиус
- •19.Параметры химической связи
- •20)Зависимость потенциальной энергии
- •21)Основное и возбужденное состояния атома
- •22. Подходы к описанию химической связи в молекулах( с позиций квантово механической теории)
- •23. Механизмы образования ковалентной связи:
- •24) Способы перекрывания электронных облаков
- •25.Виды гибридизации
- •26)Свойства ковалентной связи
- •27.Ионная связь.
- •28.Водородная связь
- •29.Межмолекулярное взаимодействие
- •30.Виды растворов: Газообразный р-р Жидкий р-р Твердый
- •31. Осмос
- •32.Основные положения тэд Аррениуса
- •33.Электролитическая диссоциация
- •44. Общие правила:
- •45. Механизм: донорно – акцепторный Комплексообразователь – акцептор (имеет вакантные орбитали на валентном уровне Лиганд – донор (имеет неподеленные электронные пары на валентном уровне)
- •46. Описывает влияние природы (кристаллического поля) лигандов на электронные орбитали комплексообразователя и свойства комплексных соединений.
31. Осмос


32.Основные положения тэд Аррениуса
1. Электролиты в растворе диссоциируют на ионы Ион - атом или группа атомов, имеющая заряд К+ - катионы; А- - анионы
2. Ионы в растворе устойчивы и по свойствам резко отличаются от их атомов. NaCl = Na+ + Cl–
3. Ионы в растворе перемещаются хаотично. Если в раствор электролита опустить электроды и наложить внешнее электрическое поле, то пойдет электрический ток - ионы имеют направленное движение: катионы – к катоду (–), анионы – к аноду (+).
4. Наряду с процессом диссоциации в растворе электролита идет процессассоциации (моляризации), т.е образование молекул из ионов. NaClNa+ + Cl– диссоциация моляризация

33.Электролитическая диссоциация

34. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ

35.СТЕПЕНЬ ДИССОЦИАЦИИ (α)ЗАВИСИТ ОТ:
•Природы растворителя (чем более полярна молекула растворителя, тем выше степень диссоциации)
•Температуры (электролитическая диссоциация-эндотермический процесс, т.о. если Т↑, то α ↑; если Т↓, тоα ↓
•Концентрации раствора ( чем больше разбавление раствора, тем выше α )
36 вопрос:опишите виды электролитов в зависимости от их силы,приведите примеры.

37 вопрос:охарактеризуйте константу диссоцииацииэлектролитов,от каких факторов она зависит,приведите выражения для константы диссоциации кислоты и соли.


38 вопрос:опишите связь между ионным произведением воды,pH и кислотностью растворов.


39 вопрос:какие типы солей подвергаются гидролизу,приведите примеры реакций.





40 вопрос:укажите типы окислительно-восстановительных реакций,приведите примеры реакций.


41вопрос:опишите положения метода электроного баланса, приведите пример расстановки коэффицентов в окислительно-восстановительной реакции.

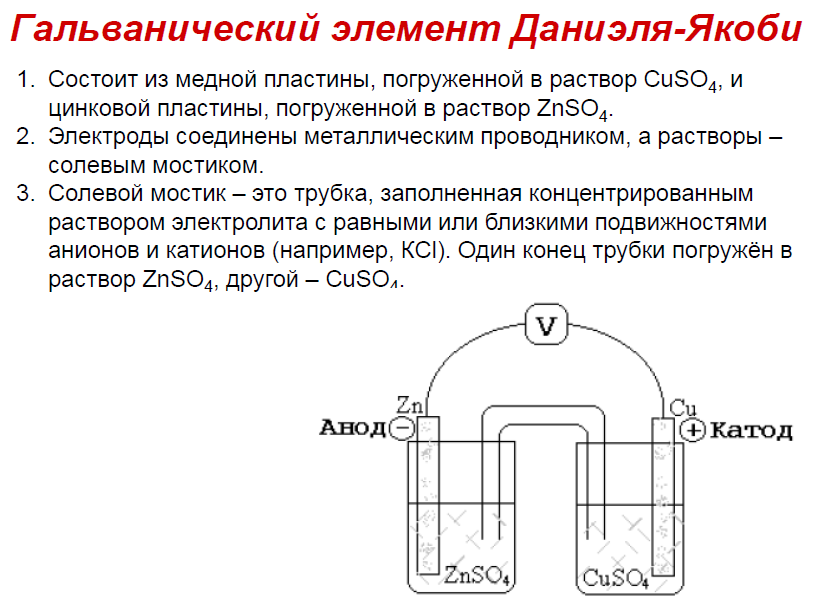
42вопрос:опишите строение гальванического элемента Якоби-Даниэля и процессы,протекающие в нем.



43. Альфред Вернер выдвинул координационную теорию:
•Помимо «главных» валентностей атомы и даже целые молекулы могут обладать «побочными» валентностями.
•При реализации «побочных» валентностей образуются устойчивые соединения, которые называются комплексными или координационными соединениями.
Комплексное соединения- это соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома ( акцептора электронов), окруженного лигандами ( донорами электронов)
Комплексное соединение– это соединение, образованное из простых частиц ( атомов, ионов или молекул), способное к самостоятельному существованию
Состоит из комплексообразователя ,внешней и внутренней сферы.
Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
(Пример стр
7,9 лекция) 
