
- •1. Опишите классификацию и номенклатуру оксидов, приведите примеры соединений
- •2.Опишите способы получения оксидов, приведите примеры химических реакций .
- •3. Опишите химические свойства оксидов
- •4.Опишите классификацию и номенклатуру основания, приведите примеры
- •5.Опишите способы получения оснований
- •6.Опишите химические свойства оснований
- •8.Опишите способы получения кислот
- •9.Опишите химические свойства кислот
- •10.Опишите классификацию и номенклатуру солей, приведите примеры
- •11.Опишите способы получения средних солей
- •17) Атомный радиус
- •19.Параметры химической связи
- •20)Зависимость потенциальной энергии
- •21)Основное и возбужденное состояния атома
- •22. Подходы к описанию химической связи в молекулах( с позиций квантово механической теории)
- •23. Механизмы образования ковалентной связи:
- •24) Способы перекрывания электронных облаков
- •25.Виды гибридизации
- •26)Свойства ковалентной связи
- •27.Ионная связь.
- •28.Водородная связь
- •29.Межмолекулярное взаимодействие
- •30.Виды растворов: Газообразный р-р Жидкий р-р Твердый
- •31. Осмос
- •32.Основные положения тэд Аррениуса
- •33.Электролитическая диссоциация
- •44. Общие правила:
- •45. Механизм: донорно – акцепторный Комплексообразователь – акцептор (имеет вакантные орбитали на валентном уровне Лиганд – донор (имеет неподеленные электронные пары на валентном уровне)
- •46. Описывает влияние природы (кристаллического поля) лигандов на электронные орбитали комплексообразователя и свойства комплексных соединений.
25.Виды гибридизации

26)Свойства ковалентной связи
1.Энергия связи 2. Длина связи 3. Кратность связи 4. Насыщаемость 5. Направленность 6. Полярность 7. Поляризуемость
Виды ковалентной связи

27.Ионная связь.

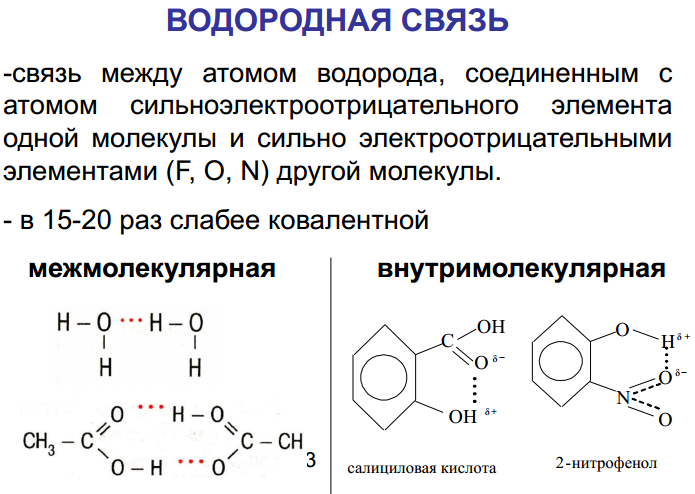
28.Водородная связь
29.Межмолекулярное взаимодействие
Они включают в себя три составляющие: 1) диполь-дипольное 2) индукционное 3) дисперсионное взаимодействия.
Диполь-дипольное взаимодействие(ориентационное).
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Между постоянными и наведенными диполями возникает притяжение. Энергия индукционного взаимодействия возрастает с увеличениемполяризуемостимолекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля.
Дисперсионное притяжение
В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. Дисперсионное притяжение В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Для неполярных молекул дисперсное взаимодействие является единственной составляющей ван-дер-ваальсовых сил
Межмолекулярное взаимодействие имеет электростатическую природу.
30.Виды растворов: Газообразный р-р Жидкий р-р Твердый

