Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот:
|
С2Н4О2 |
|
O |
|
O |
|
СН3—С |
|
Н—С |
OH |
|
OCH3 |
Уксусная кислота |
|
Метилформиат |
|
|
(сложный эфир) |
Электронное строение
Карбоксильная группа содержит высокополяризованную карбонильную группу >С=О. Атом «С» карбонильной группы, имеющий частичный положительный заряд, оттягивает на себя электроны связи С—О. Неподеленная пара электронов атома кислорода гидроксильной группы взаимодействует с электронами π-связи карбонильной группы. Это приводит к большему оттягиванию электронов от атома «Н» гидроксильной группы и увеличению полярности связи О—Н по сравнению со спиртами, а также уменьшению положительного заряда на атоме «С» карбонильной группы кислот по сравнению с альдегидами. В результате свойства гидроксильной и карбонильной групп в карбоновых кислотах отличаются от свойств соответствующих групп в спиртах и альдегидах.
Во-первых, кислоты в отличие от спиртов диссоциируют
собразованием ионов водорода Н+. Во-вторых, для кислот,
вотличие от альдегидов, не характерны реакции присоединения по двойной связи >С=О.
Физические свойства
НСООН |
CH3COOH … С9Н19СООН |
С10Н21СООН… |
⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎬ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪ ⎭ |
⎪ ⎪ ⎬ ⎪ ⎪ ⎭ |
|
Жидкости |
Твердые вещества |
Смешиваются с водой во всех отношениях Растворимость в воде уменьшается
t° кип. увеличивается
В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей:
Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот больше температур кипения соответствующих спиртов.
В водных растворах кислоты образуют линейные димеры:
Химические свойства
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Это определяется главным образом реакциями карбоксильной группы (разрыв связей О—Н и С—О), а также реакциями замещения атомов «Н» у α-угле- родного атома:
1. Реакции с разрывом связи О—Н
(кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
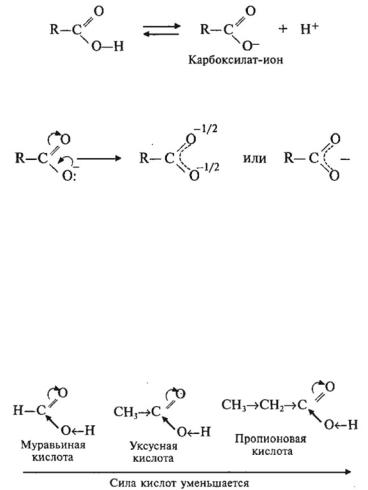
1.Диссоциация
Вводных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона:
Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:
Делокализация стабилизирует карбоксилат-ион. Карбоновые кислоты являются слабыми кислотами. Наи-
более сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа —СООН связана с атомом водорода. Алкильные радикалы в молекулах следующих членов гомологического ряда обладают положительным индукционным эффектом (+I) и уменьшают положительный заряд на атоме углерода карбоксильной группы. Это в свою очередь ослабляет полярность связи О—Н, и тем в большей степени, чем больше УВ радикал. Поэтому в гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2. Образование солей:
а) взаимодействие с активными металлами: 2НСООН + Mg (HCOO)2Mg + H2 ;
Формиат магния
б) взаимодействие с основными оксидами: 2СН3СООН + СаО (СН3СОО)2Са + Н2О;
Ацетат кальция
в) взаимодействие со щелочами (реакция нейтрализации): СН3СН2СООН + КОН СН3СН2СООК + Н2О;
Пропионат калия
г) взаимодействие с аммиаком или гидроксидом аммония: СН3СООН + NH3 CH3COONH4
Ацетат аммония
СН3 СООН + NH4OH CH3COONH4 + Н2О;
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
2СН3СООН + Na2CO3 2CH3COONa + CO2 + Н2О;
Ацетат натрия
СН3СН2СН2СООН + NaHCO3
CH3CH2CH2COONa + CO2 + Н2О
Бутират натрия
П. Реакции с разрывом связи С—О
(замещение ОН-группы)
1. Взаимодействие со спиртами с образованием сложных
О
эфиров R—С (реакция этерификации):
(реакция этерификации):
ОR’ |
|
|
О |
|
О |
|| |
конц. H2SO4, t’° |
|| |
СН3—С—ОН + С2H5ОН |
СН3—С—ОС2Н5 + Н2О |
Уксусная кислота |
|
Этилацетат |
2. Взаимодействие с аммиаком с образованием амидов кислот
О
R—C
NH2
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
О |
О |
|
|
О |
|| |
|| |
t’° |
|
|| |
СН3—С—ОН + NН3 |
СН3—С—ОNН4 |
|
|
— СН3—С—NH2 |
Уксусная кислота |
|
–H |
O |
Ацетамид |
|
2 |
|
(этанамид, амид уксусной кислоты)
3.Взаимодействие с галогенидами фосфора (РСl5, PCl3 ) или тионилхлоридом SOCl2 с образованием галогенангидридов
карбоновых кислот |
О |
|
|
|| |
|
R—C—Hal: |
О |
О |
|| |
|| |
СН3—С—ОН + РСl5 CH3—C—Cl + РОСl3 + НСl
Н—С—ОН + SOCl2 Н—С—Сl + SO2 + НСl
Формилхлорид
4.Межмолекулярная дегидратация карбоновых кислот с образованием ангидридов
R—C—O—C—R
|| ||
ОО
Ангидриды представляют собой производные кислот, состоящие из двух соединенных через кислород кислотных радикалов (ацилов).
Ангидриды получают при пропускании паров кислот над водоотнимающим средством (Р2О5):
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты:
Аналогично можно получать ангидриды, содержащие остатки одной кислоты.

III. Реакции с разрывом связей С—Н у α-углеродного атома
(реакции с участием радикала)
Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галоген-карбо- новых кислот:
СН3СООН + Сl2 |
PCl5, hv, t° |
+Cl2 |
———— СlСН2СООН —— |
Уксусная |
–НСl |
Монохлоруксусная –НСl |
кислота |
|
кислота |
|
|
+Cl2 |
—— Сl2СНСООН —— ССl3СООН |
Дихлоруксусная –НСl Трихлоруксусная |
кислота |
кислота |
Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
1.В отличие от других карбоновых кислот в молекуле му-
равьиной кислоты функциональная карбоксильная груп-
О
па —С |
связана не с углеводородным радикалом, а с ато- |
ОH
мом водорода. По этой причине, как уже было отмечено выше, муравьиная кислота является наиболее сильной кислотой по сравнению с другими членами своего гомологического ряда.
2.В молекуле муравьиной кислоты наряду с карбоксильной группой можно выделить также альдегидную группу:
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот (см. свойства предельных монокарбоновых кислот), так и для альдегидов. В частности, как и альдегиды, НСООН проявляет восстановительные свой-
ства. Муравьиная кислота легко окисляется до угольной кислоты:
В роли окислителей могут выступать аммиачный раствор оксида серебра (I) Ag2O и гидроксид меди (II) Cu(ОН)2. Таким образом, особенностью муравьиной кислоты является то, что для нее характерны качественные реакции на альдегиды:
а) реакция «серебряного зеркала»:
О |
|
|
|
|
|
|
|
|
|
|| |
NH4OH |
|
+ Н |
|
|
|
Н—С—ОН + Ag |
O ———— СО |
|
О + 2Ag |
2 |
|
|
t° |
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
б) реакция с гидроксидом меди (II): |
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|| |
|
|
t° |
|
+ 3Н |
|
О + Cu |
O |
Н—С—ОН + 2Cu(OH) |
2 |
— СО |
2 |
|
|
2 |
|
|
|
2 |
|
Осадок кирпичнокрасного цвета
3.Специфическим свойством муравьиной кислоты является также ее способность разлагаться на оксид углерода (II) и воду под действием концентрированной серной кислоты (эта реакция — еще одно доказательство того, что H2SO4
является хорошим водоотнимающим агентом):
H2SO4 (k)
НСООН ———— CO + Н2O
Способы получения предельных монокарбоновых кислот
I. Общие способы получения
1 . Окисление первичных спиртов и альдегидов под действием различных окислителей:
|
О |
+[O] |
О |
R—CH2OH + [О] —— R—C |
|
—— R—C |
|
–Н2O |
H |
|
OH |
|
|
2.Окисление алканов кислородом воздуха (в присутствии катализаторов — солей марганца или при нагревании под
давлением).
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
кат.
2СН3—СН2—СН2—СН3 + 5О2 —— 4СН3СООН + 2Н2О
3. Омыление сложных эфиров (т. е. их щелочной гидролиз):
|
О |
О |
R—C |
+ NaOH — R—C |
+ R’ OH |
OR’ |
ONa |
|
О |
О |
R—C |
+ HCl — R—C |
+ NaCl |
|
ONa |
OH |
4. Гидролиз галогенангидридов кислот: |
|
|
О |
О |
R—C |
+ Н2О — R—C |
+ НСl |
|
Cl |
OH |
II. Способы получения важнейших кислот
НСООН
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) и подкислением образующегося формиата натрия серной кислотой:
t°, P
NaOH + СО — HCOONa
Формиат натрия
2HCOONa + H2SO4 2HCOOH + Na2SO4
Муравьиная кислота образуется также при нагревании щавелевой кислоты:
Разложение карбоновых кислот, при котором они с выде-
лением СО2 теряют карбоксильную группу, называется реакцией декарбоксилирования.
СН3СООН
1.Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино,
пиво):
ферменты
СН3—СН2ОН + О2 ———— СН3СООН + Н2О
(воздух)
2, Синтетическую уксусную кислоту для химической промышленности получают различными методами:
а) окислением бутана (см. выше); б) окислением ацетальдегида:
О |
О |
CH3—C |
+ [О] — CH3—C |
H |
OH |
в) синтезом из метанола и оксида углерода (II):
t°, кат.
СН3ОН + СО ——— СН3СООН
Применение важнейших насыщенных монокарбоновых кислот
Растворители |
|
|
|
|
|
|
|
|
Лекарственные |
|
|
|
|
|
|
|
|
|
|
|
|
HCOOH |
|
|
|
средства |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пестициды |
|
|
|
|
|
|
|
|
Консервирование |
|
|
|
|
|
|
|
|
|
фруктовых соков, |
|
|
|
|
|
|
|
|
|
Формиаты |
|
|
|
|
|
|
|
|
зеленых кормов |
(соли и эфиры) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дезинфекция |
Крашение тканей |
|
|
|
|
|
|
|
|
емкостей в пищевой |
|
|
Обработка кожи |
|
и бумаги |
|
|
|
промышленности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для пищевых |
|
|
|
Растворитель |
|
Ацетаты |
целей |
|
|
|
|
|
|
|
|
(соли и эфиры) |
|
|
|
|
|
|
|
|
Инсектициды |
|
|
|
СН3СОOH |
|
|
|
(СН3СО)2O |
|
|
|
|
|
|
|
Уксусный ангидрид |
|
|
|
|
|
|
|
Красители |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|| |
Лекарственные |
|
|
|
СlСН2СООН |
|
СН3—С—Сl |
средства (аспирин, |
|
|
Монохлоруксусная |
|
Ацетилхлорид |
фенацетин) |
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
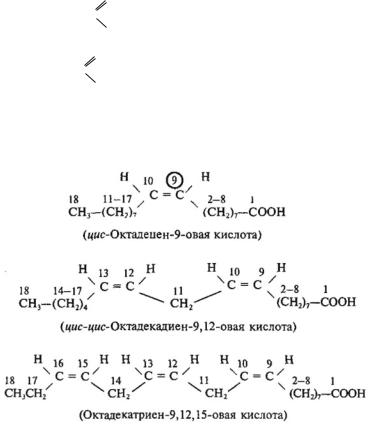
НЕНАСЫЩЕННЫЕ (НЕПРЕДЕЛЬНЫЕ) МОНОКАРБОНОВЫЕ КИСЛОТЫ
Непредельные монокарбоновые кислоты — это производные алкенов, алкинов, алкадиенов и других ненасыщенных УВ. Наибольшее значение имеют непредельные кислоты с двойными связями.
Важнейшие представители
Для ненасыщенных монокарбоновых кислот чаще всего используют тривиальные названия:
О
СН2=СН—С |
Акриловая (пропеновая) кислота |
OH
О
Метакриловая (α-метилакриловая, 2-метилпропеновая) кислота
Важнейшими высшими непредельными карбоновыми
кислотами являются:
Олеиновая кислота С17Н33СООН
Линолсвая кислота C17H31COOH
Линоленовая кислота С17Н29СООН





 (реакция этерификации)
(реакция этерификации)