X = Алкил (СН3—, СН3—Н2—, СН3—СН2—СН2—,
СН3—СН—СН3…)
|
I-эффект передается по цепи σ-связей и быстро уменьшается при удалении от заместителя, вызывающего этот эффект:
δ˝+ δ´+ δ–
СН3 СН2 Сl δ´+ > δ˝+
Мезомерный эффект (эффект сопряжения) М характерен для соединений с сопряженными связями, в которых простые связи чередуются с кратными связями или (и) с атомами, имеющими неподеленные электронные пары (О, S, N).
Мезомерный эффект — это поляризующее влияние атома или группы атомов, проявляющееся в смещении электронов π-связей или неподеленных электронных пар отдельных атомов (О, S, N) в сторону атомов с недостроенной до октета электронной оболочкой. В результате на противоположных концах системы появляются одинаковые по величине, но разные по знаку заряды. Электронное смещение обозначается изогнутой стрелкой:
Электронодонорные группы, способные к частичной или полной передаче пары электронов, обладают положительным мезомерным эффектом (+М), а электроноакцепторные группы, поляризующие систему в противоположном направлении, — отрицательным (–М).
Мезомерный эффект передается по цепи сопряженных связей без ослабления.
Мезомерный эффект атомов или группы атомов может совпадать по знаку с индуктивным эффектом, но может иметь и противоположный знак, например, атом хлора обладает отрицательным индуктивным эффектом и положительным мезомерным эффектом.

|
|
|
|
Таблица 47 |
|
Электронные эффекты заместителей |
|
|
|
|
|
Заместитель |
|
Электронные эффекты |
Суммарное электрон- |
|
|
|
|
ное влияние заместителя |
|
|
индук- |
мезо- |
|
|
тивный |
мерный |
в сопряженных системах |
|
|
|
|
|
Алкил (—СН3, |
|
+I |
– |
Электронодоноры |
—С2Н5 и т. д.) |
|
|
|
|
—NH2, |
|
|
|
|
—NHAlk, |
|
–I |
+М |
Электронодоноры |
—NAlk2 |
|
|
|
(+М –I) |
—ОН |
|
–I |
+М |
Электронодонор |
|
|
|
|
(+М > –I) |
|
|
|
|
|
Алкокси |
|
|
|
|
(—ОСН3, |
|
–I |
+M |
Электронодоноры |
—ОС2Н5 и т. д.) |
|
|
|
(+М > –I) |
Галогены |
|
–I |
+M |
Электроноакцепторы |
|
|
|
|
(–I > + М) |
|
|
|
|
|
—NO2 |
|
–I |
–M |
Электроноакцептор |
—COOH |
|
–I |
–M |
Электроноакцептор |
|
|
|
|
|
—SO3H |
|
–I |
–M |
Электроноакцептор |
C=O |
|
–I |
–M |
Электроноакцептор |
|
|
|
|
|
В целом при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать суммарное действие индуктивного и мезомерного эффектов. Все заместители в зависимости от того, повышают они или понижают электронную плотность в молекуле, рассматривают как электронодонорные или электроноакцепторные (табл. 47).
Вопросы для контроля
1.Какие типы эффектов заместителей существуют?
2.Что такое индуктивный эффект?
3.Какие заместители проявляют положительный индуктивный эффект, а какие — отрицательный?
4.Как изменяется индуктивный эффект по мере удаления от заместителя?
5.Какие системы называются сопряженными?
6.Что такое мезомерный эффект?
7.Какие заместители проявляют +М-, а какие –М-эффект?
8.Как изменяется мезомерный эффект по мере удаления от заместителя?
9.Назовите примеры заместителей, которые смешают электронную плотность по индуктивному и мезомерному эффектам в разных направлениях.
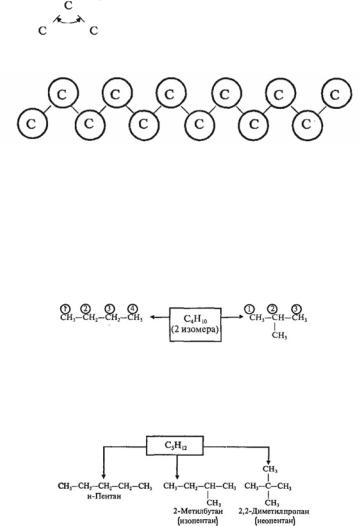
§ 9.3. Предельные углеводороды (алканы)
Общая классификация углеводородов (УВ) может быть представлена следующей схемой:
АЛКАНЫ (предельные или насыщенные УВ, парафины)
СnН2n+2, n 1
• Алканы — это нециклические УВ, в молекулах которых все атомы углерода находятся в состоянии sp3-гибридизации и связаны друг с другом только σ-связями;
Гомологический ряд алканов
Молекулярная |
Название |
Молекулярная |
Название |
формула |
алкана |
формула одно- |
алкила |
алкана |
|
валентного УВ |
(алкильного |
|
|
|
|
|
|
|
|
радикала (алкила) |
радикала) |
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
CnН2n+1 |
|
СН4 |
Метан |
–СН3 |
Метил |
С2Н6 |
Этан |
–C2H5 |
Этил |
С |
|
Н |
8 |
|
Пропан |
–C |
|
H ** |
Пропил |
|
3 |
|
|
|
|
3 |
7 |
|
С |
4 |
Н |
10 |
|
Бутан |
–C |
H *** |
Бутил |
|
|
|
|
|
4 |
|
9 |
|
С5Н12 |
Пентан |
–C5H11 |
Пентил (амил) |
С6Н14 |
Гексан |
–C6H13 |
Гексил |
С7Н16 |
Гептан |
–С7Н15 |
Гептил |
С8Н18 |
Октан |
–С8Н17 |
Октил |
С9Н20 |
Нонан |
–С9Н19 |
Нонил |
С10Н22 |
Декан |
–С10Н21 |
Децил |
|
|
|
|
|
|
|
|
|
|
|
|
*Получается при отнятии одного атома водорода от молекулы алкана.
**Существует в виде двух изомеров:
н-Пропил (нормальный пропил). |
Изопропил (вторичный пропил). |
Свободная валентность находится |
втор-пропил). Свободная валентность |
у первичного атома «С» |
находится у вторичного атома «С» |
*** Существует в виде четырех изомеров:
Каждый атом углерода в молекуле алкана связан простыми связями с четырьмя атомами («С» или «Н») и не может присоединять другие атомы. Поэтому алканы и называют
предельными или насыщенными углеводородами.
Строение алканов. Все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации, угол между свя-
зями составляет 109°28’ , поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг):
Длина связи С—С в предельных углеводородах равна 0,154 нм (1 нм = 10–9 м):
0,154 нм
}
—С—С—
Изомерия и номенклатура алканов
Возможна только изомерия цепи. Первые три члена гомологического ряда алканов (СН4, С2Н6, С3Н8) изомеров не имеют.
Четвертый член гомологического ряда существует в виде двух изомеров:
Нормальный бутан |
Изобутан (2-метилпропан), |
(н-бутан), имеет нераз- |
имеет разветвленную |
ветвленную цепь |
цепь углеродных атомов |
углеродных атомов |
|
Для пятого члена гомологического ряда алканов возможно существование трех изомеров:
Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью.
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Найти самую длинную (главную) неразветвленную цепь углеродных атомов.
Таким образом, в данном соединении главная цепь содержит 6 углеродных атомов.
Пронумеровать атомы углерода главной цепи. Номер атома углерода, у которого находится заместитель (алкильный радикал), должен быть наименьшим.
Указать положение заместителя (номер атома углерода, у которого находится алкильный радикал).
Назвать алкильный радикал.
Назвать алкан, соответствующий главной цепи.
В молекуле с несколькими одинаковыми заместителями нужно указать положение каждого заместителя. Сумма номеров положений заместителей должна иметь наименьшее значение. Число одинаковых заместителей обозначают греческими числительными: ди- (два), три-(три), тетра- (четыре), пента- (пять) и т. д.
Разные заместители называют в алфавитном порядке. Сумма номеров положений заместителей минимальная.
Физические свойства алканов
CH4… C4H10 |
C5H12… C15H32 |
C16H34… |
Газы |
Жидкости |
Твердые вещества |
(без запаха) |
(имеют запах) |
(без запаха) |
t° кипения и t° плавления увеличиваются
Алканы — бесцветные вещества, легче воды, плохо растворяются в воде.
Химические свойства алканов
Тривиальное (историческое) название алканов — «парафины» — означает «не имеющие сродства». Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С—С и С—Н в их

молекулах вследствие почти одинаковой электроотрицатель-
ности атомов углерода и водорода.
Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитическое расщепление ковалентных связей, т. е. они осуществляются по свободнорадикальному (цепному) механизму.
1. Реакции замещения (разрыв связей С—Н)
RH + XY RX + HY
или
1. Галогенирование (замещение атома водорода атомом
галогена — F, Cl, Br с образованием галогеналкана RHal).
Алканы очень активно реагируют с фтором. Хлорирование протекает под действием света и является фотохимической цепной реакцией. Теорию цепных реакций разработал
советский ученый, один из основоположников химической физики, академик Н. Н. Семенов (1896—1986), за что в 1956 г. был удостоен Нобелевской премии. Низшие алканы (СН4, С2Н6, C3H8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов:
|
+Cl2 |
|
+Cl2 |
+Cl2 |
|
+Cl2 |
CH4 |
— CH3Cl — CH2Cl2 |
— CHCl3 |
— CCl4 |
|
–HCl |
|
–HCl |
–HCl |
–HCl |
Метан |
Хлор- |
Дихлор- |
Трихлор- |
Тетра- |
|
|
метан |
метан |
|
метан |
метан |
Механизм реакции
Реакция осуществляется в три стадии (цепь реакций):
а) инициирование (зарождение цепи) — гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:
hv
Cl •|• CI Сl• + •Cl
Свободные
радикалы
Свободные радикалы — это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…);
б) развитие цепи — взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т. д.:
в) обрыв цепи (происходит при соединении двух радикалов друг с другом): Сl• + •Сl Сl2
СН3• + •СН3 СН3—СН3 СН3• + •Сl СН3Сl
2. Нитрование (замещение атома водорода нитрогруппой — NO2 с образованием нитроалканов R— NO2). Нитру-
ющий реагент — азотная кислота HNO3(HO— NO2). Обычно для нитрования алканов используется разбавлен-
ная азотная кислота при t ° = 140 °C и при повышенном или нормальном давлении (реакция М. И. Коновалова).
|
140° |
+ H2O |
СН3—СН3 + HO—NO2 —— СН3—СН2—NO2 |
(разб.) |
нитроэтан |
|
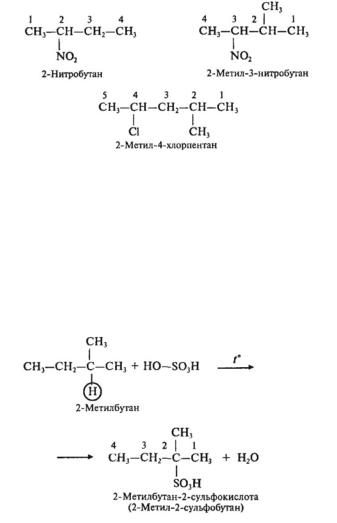
Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее — у вторичного, наиболее трудно — у первичного; например:
Номенклатура нитро- и галогеналканов
В основе названия нитроили галогеналкана лежит название самой длинной неразветвленной цепи. Заместители перечисляют в алфавитном порядке. Атомы «С» нумеруют так, чтобы заместитель, который пишется первым, имел меньший номер.
3. Сульфирование (замещение атома водорода сульфогруппой — SO3H с образованием алкансульфокислот
RSO3H). Сульфирующий реагент — серная кислота H2SO4 (HO—SO3H).
Сульфирование алканов происходит при действии очень концентрированной H2SO4 при небольшом нагревании.
t°
СН4 + HOSO3H —— СН3SO3H + H2O
сульфометан
Наиболее легко замещается атом водорода у третичного атома углерода: