Принципиального различия между органическими и не-
органическими веществами нет.
Однако типичные органические вещества имеют ряд свойств, которые отличают их от типичных неорганических веществ. Это объясняется различием в характере химической связи:
Типичные неорганические |
Типичные органические |
вещества |
вещества |
Ионные или полярные |
Неполярные или слабополярные |
ковалентные связи |
ковалентные связи |
Электролиты |
Неэлектролиты |
Твердые вещества с высокой |
Жидкости или твердые вещества |
температурой плавления |
с низкой температурой плавления |
|
|
Плавятся без разрушения |
Разрушаются при нагревании |
Не окисляются на воздухе, |
Окисляются на воздухе, горючи |
негорючи |
|
|
|
Растворимы в воде |
Нерастворимы или плохо |
|
растворимы в воде |
|
|
Характер химических связей и валентность углерода в органических соединениях
Атом углерода образует только ковалентные связи. Это объясняется тем, что углерод имеет электроотрицательность (ЭО) = 2,5, что является промежуточной величиной между значениями ЭО типичных металлов (ЭО = 0,7—1,5) и ЭО типичных неметаллов (ЭО = 3,0—4,0).
Рассмотрим валентные возможности атома углерода:
6 |
C 1s22s22р2 |
C* 1s22s12р3 |
валентные
электроны
основное состояние, |
возбужденное состояние, |
валентность II |
валентность IV |
Во всех органических соединениях атом С находится в возбужденном состоянии, поэтому валентность С равна IV.

Важнейшее свойство углерода — способность его атомов соединяться друг с другом с образованием цепей:
|| | |
—C—C—C—C—
|| | |
Поэтому существует очень много органических веществ.
Атом углерода в органических соединениях может находиться в трех валентных состояниях (табл. 46). Этим вален-
тным состояниям соответствуют различные типы гибриди-
зации электронных орбиталей (облаков) атома углерода
(о гибридизации см. § 3.8).
Основные положения теории химического строения органических соединений
Эту теорию разработал русский ученый А. М. Бутлеров
(1858—1861).
I положение. Атомы в молекулах органических веществ
соединяются друг с другом в определенной последовательности согласно их валентности.
Последовательность соединения атомов в молекуле называется химическим строением (структурой).
Формулы |
|
|
эмпирические — |
структурные — |
показывают только |
показывают химическое |
состав веществ |
строение веществ |
С2Н4, С2Н6, С2Н6О |
H |
С=С |
H |
|
H |
H |
|
|
|
(Н2С = СН2) |
H H |
H H |
| |
| |
| |
| |
H—C—C—H |
H—C—C—O—H |
| |
| |
| |
| |
H H |
H H |
(СН3—СН3) (СН3—СН2—ОН)
гибридизации атома углерода |
Таблица 46 |
|
|
|
Схематическое изображение |
Примеры молекул |
электронных облаков |
|
Образуются четыре новых гибридных облака, которые направлены в пространстве к вершинам
тетраэдра
Образуются три новых гибридных облака, которые располагаются в одной плоскости под углом 120°.
Электронное облако, не участвующее
вгибридизации, перпендикулярно
кэтой плоскости
Образуются два новых гибридных облака, которые располагаются на линии под углом 180°. Электронные облака, не участвующие в гибридизации, взаимно перпендикулярны

Ворганических соединениях, как уже отмечалось, атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет).
Вобразующихся цепях атом углерода может быть связан либо с одним соседним атомом углерода, либо с двумя, либо
стремя, либо с четырьмя. Соответственно различают первичные, вторичные, третичные и четвертичные атомы углерода.
В зависимости от наличия тех или иных атомов углерода цепи
бывают:
а) прямые (неразветвленные) — содержат два первичных атома углерода (крайние в цепи), остальные атомы — вторичные; например:
|| | | | |
—C—C—C—C—C—C—
| | | | | |
б) разветвленные — содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:
|| | |
—C—C—C—C—
| | | |
—C—
|
третичный атом углерода
в) замкнутые (циклы) — не содержат первичных атомов углерода; например:
II положение. Свойства веществ зависят не только от со-
става, но и от строения их молекул.
Например, существуют два различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:
СН3—СН2—ОН |
СН3—О—СН3 |
Этанол (жидкость, взаимо- |
Диметиловый эфир (газ, |
действует с Na) |
не взаимодействует с Na) |
Этанол и диметиловый эфир по отношению друг к другу
являются изомерами.
Изомеры — это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства.
Изомерия — явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
С4Н10 — 2 изомера, С10Н22 — 75 изомеров.
|
Типы изомерии |
1. Структурная изомерия |
Изомерия |
Изомерия положения |
цепи: |
кратной связи: |
Изомерия положения функциональной группы:
2. Пространственная изомерия (геометрическая изомерия, цис-транс-изомерия)
Цис- и транс-изомеры имеют одинаковое химическое строение (т. е. порядок соединения атомов в молекулах), но различное пространственное расположение атомов и атом-
ных групп.
3. Межклассовая изомерия — изомерия веществ, принадлежащих к разным классам органических соединений. В сущности, межклассовая изомерия является одним из видов структурной изомерии. В таблице приведены важнейшие примеры межклассовой изомерии.
Классы |
Общая |
|
Примеры |
формула |
|
|
|
|
|
Алкены |
|
|
СН2=СН–СН2–СН2СН2–СН3 |
|
|
|
Гексен-1 |
|
|
|
|
Цикло- |
СnН2n |
С6Н12 |
|
алканы |
|
|
|
|
|
|
Циклогексан |
|
|
|
|
Алкины |
|
|
CH=C—CH3 |
|
СnН2n–2 |
С3Н4 |
Пронин |
Алкади- |
CH2=C=CH2 |
ены |
|
|
Пропациен |
Алка- |
|
|
СН3—СН2—CH2—СН2—ОН |
нолы |
СnН2n+2O |
С4Н10O |
Бутанол-I |
Простые |
СН3—СН2—О—СН2—СН3 |
эфиры |
|
|
Диэтиловый эфир |
|
|
|
(этоксиэтан) |
|
|
|
|
Классы |
Общая |
|
Примеры |
формула |
|
|
|
|
Одноос- |
|
|
O |
новные |
|
|
СН3–СН2–СН2–С |
карбо- |
|
|
OH |
новые |
|
|
н-Бутановая |
кислоты |
СnН2nO2 |
С4Н8O2 |
кислота |
Слож- |
|
|
|
|
ные |
|
|
O |
эфиры |
|
|
СН3–СН2–С |
карбо- |
|
|
О–СН3 |
новых |
|
|
Метилпропионат |
кислот |
|
|
|
|
|
|
|
Альде- |
|
|
O |
|
|
СН3–СН2–С |
гиды |
|
|
|
|
H |
|
|
|
|
СnН2nO |
С3Н6O |
Пропаналь |
|
O |
|
|
|
|| |
Кетоны |
|
|
CH3—C—CH3 |
|
|
|
Пропанон |
|
|
|
(ацетон) |
|
|
|
|
IIIположение. В молекулах органических веществ атомы
игруппы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
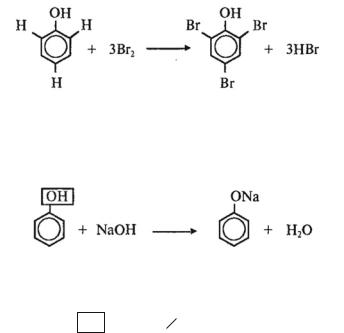
Рассмотрим, например, влияние ОН-группы на подвижность атомов «Н» в цикле бензола*:
*В приведенной ниже структурной формуле бензола С6Н6 выделен только замещающийся атом водорода.
В бензольном ядре замещается один атом водорода.
При наличии группы —ОН в бензольном ядре замещаются три атома водорода.
С другой стороны, углеводородный радикал влияет на подвижность атома водорода в ОН-группе:
Если группа —ОН связана с бензольным кольцом, атом водорода в ней является подвижным и может замещаться на атом металла при взаимодействии со щелочью.
СН3—СН3—ОН + NaOH реакция не идет
Если группа —ОН связана с алкильным радикалом, подвижность атома водорода в ней невелика, и он не может замещаться на металл при действии щелочи.
Гомологический ряд. Гомологи
Гомологический ряд — это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу CH2. Сходные по химическим свойствам
соединения, образующие гомологический ряд, называются
гомо@логами. Труппа СН2 называется гомологической разностью.
Например: СН4, С2Н6, С3Н8, C4H10, C5H12… СnН2n+2.
Состав всех членов гомологического ряда может быть выражен общей формулой.
Существует понятие «ближайшие гомологи». Это члены гомологического ряда, отличающиеся друг от друга на одну группу —CH2—. Например, ближайшими гомологами пропа-
на С3Н8 являются этан С2Н6 и бутан C4H10.
Члены гомологического ряда характеризуются сходными, но не всегда одинаковыми химическими свойствами. Многие физические свойства (температура кипения, температура плавления и др.) в гомологических рядах изменяются закономерно.
Классификация органических веществ
Как и неорганические соединения, органические вещества классифицируются, т. е. разделяются на классы.
Большинство органических соединений можно представить формулой: R—X, где R — углеводородный радикал; X — ф;ункциональная группа.
Функциональные группы — это группы атомов, которые
определяют наиболее характерные химические свойства органических соединений. Углеводородные радикалы — остат-
ки УВ, связанные с функциональными группами.