
Справочники / Репетитор по химии - Белов Н.В
..pdf
Примеры |
+2 –2 |
+3–2 |
+1 –2 |
+1 –2 |
соединений: |
CaO |
Al2S3 |
H2Se |
H2Te. |
Сверху вниз в подгруппе, как и у галогенов, окислительная способность халькогенов уменьшается: О0 S0 Se0
Te0.
Халькогенид-ионы могут только отдавать e#-ны и поэтому являются восстановителями:
Э–2 – 2e# = Э0
халькогенид-ион (восстановитель)
Восстановительная способность халькогенид-ионов в указанном направлении увеличивается: О–2 S–2 Se–2
Te–2.
Элементы-халькогены образуют соединения с водородом одного типа — Н2Э, где Э — элемент: Н2О — вода, H2S — сероводород, H2Se — селеноводород, Н2Те — теллуроводород. При обычных условиях Н2О — жидкость, остальные халькогеноводороды — газообразные вещества, раствори-
мые в воде. При растворении их в воде образуются соответствующие кислоты: H2S — сероводородная, H2Se — селено-
водородная, Н2Те — теллуроводородная кислота. В ряду кислот H2S H2Se H2Te происходит усиление кислотных свойств.
Для халькогенов известны оксиды с общими формула-
ми: ЭО2 и ЭО3. Кислотным оксидам такого типа соответствуют кислоты Н2ЭО3 и Н2ЭО4. В кислотных оксидах
и в кислотах проявляются характерные степени окисления +4 и +6.
H2SO3 |
|
H2SO4 |
|
|
|||
Сернистая |
|
Серная |
|
кислота |
|
кислота |
Стрелками |
|
|
|
|
H2SeO3 |
|
H2SeO4 |
показано увеличение |
Селенистая |
|
Селеновая |
силы кислот |
кислота |
|
кислота |
|
H2TeO3 |
|
Н2ТеО4 |
|
Теллуристая |
|
Теллуровая |
|
кислота |
|
кислота |
|
|
|
390
КИСЛОРОД
Кислород — элемент с порядковым номером 8, его относительная атомная масса 15,999 ≈ 16. Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше.
В большинстве своих соединений кислород имеет степень окисления –2. В пероксидах водорода и металлов (Н2О2, Na2O2, СаО2 и др.) степень окисления кислорода –1. Существует единственное соединение, в котором кислород имеет положительную степень окисления +2, это фторид кислорода OF2 (фтор — единственный элемент, ЭО которого больше ЭО кислорода, равной 3,5).
Нахождение в природе
Природный кислород состоит из 3 стабильных изотопов: 16О, 17О и 18О (преобладает 16О).
Кислород в виде простого вещества О2 входит в состав атмосферного воздуха (≈ 21 % по объему). В связанном виде элемент кислород — составная часть воды, различных минералов, многих органических веществ. На долю кислорода приходится 47,2 % массы земной коры. Кислород составляет 50—85 % массы тканей растений и животных. Вообще он является самым распространенным элементом на Земле.
Физические свойства
В свободном виде кислород существует в двух аллотроп-
ных модификациях: О2 и О3, Простое вещество О2, как и элемент, называется кислородом. Простое вещество О3
имеет название озон. Озон существует в верхних слоях атмосферы и образует так называемый «озоновый слой», который защищает Землю и ее обитателей от губительного ультрафиолетового излучения Солнца.
Обычный кислород О2 — газ без цвета и запаха, температура кипения — 183 °С (тяжелее воздуха, плотность 1,43 г/л, В воде малорастворим: в 1 л ее при н. у. растворяется 0,04 г кислорода.
391
Электронное строение молекулы кислорода
Характер химической связи в молекуле кислорода О2, а соответственно и некоторые свойства молекулярного кислорода необъяснимы с позиций теории общих электронных пар, рассмотренной в § 3.7. Однако они становят-
ся понятны при использовании другого способа описания ковалентной связи — метода молекулярных орбиталей. Не
вдаваясь в суть этого метода, укажем лишь некоторые его постулаты:
1.При образовании ковалентной связи между атомами из их атомных орбиталей (АО) образуются молекулярные орбитали (МО), Число МО равно числу АО, участвующих в их образовании.
2.Молекулярные орбитали делятся на связывающие, энергия которых меньше энергии АО, и разрыхляющие, энергия которых больше энергии АО.
3.Молекулярные орбитали, как и ковалентные связи, бывают двух типов: σ- и π-орбитали.
4.Электроны заполняют МО, как и АО, в соответствии с принципом Паули, принципом наименьшей энергии и правилом Гунда.
5.Молекула является устойчивой только в том случае, если число электронов на связывающих МО больше числа электронов на разрыхляющих МО, так как именно в этом случае энергия молекулы будет меньше, чем суммарная энергия изолированных атомов, участвующих в образовании этой молекулы.
На рис. 27 показана схема образования МО в молекуле О2
(учитываются только валентные 2p-электроны атомов кислорода). Наличие двух неспаренных электронов на разрыхляющих π-МО обусловливает парамагнитные свойства молекулярного кислорода.
Получение
Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его дальнейшей фракционной перегонке. Вначале из жидкого воздуха отгоняется газообразный азот (так как его темпе-
392
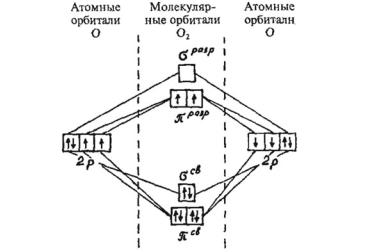
Рис. 27. Схема образования молекулярных орбиталей в молекуле кислорода
ратура кипения ниже, чем у кислорода), а в жидком состоянии остается почти чистый кислород.
Лабораторные методы получения О2 достаточно многочисленны. Укажем наиболее часто используемые:
1.Разложение бертолетовой соли (хлората калия) при нагревании в присутствии оксида марганца (ГУ) в качестве катализатора:
t°
2КСlO3 ===MnО22КСl + 3O2
2. Термическое разложение перманганата калия:
t°
2КMnO4 = К2MnО4 + MnО2 + О2
3. Термическое разложение нитратов щелочных металлов,
например:
t°
2NaNO3 = 2NaNO2 + O2
4. Каталитическое разложение пероксида водорода:
MnО2
2H2O2 === 2H2O + O2
393
5.Взаимодействие пероксидов щелочных металлов с углекислым газом:
2Na2O2 + 2СО2 = 2Na2CO3 + О2
6. Электролиз водных растворов щелочей или солей кислородсодержащих кислот. Сущность происходящих при этом процессов сводится к разложению воды под действием электрического тока:
электролиз
2Н2O ======= 2H3 + О2
Химические свойства
Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов (Не, Ne, Ar), причем со всеми простыми веществами, кроме фтора, хлора, золота и платиновых металлов, он взаимодействует непосредственно.
Во всех реакциях О2 играет роль окислителя.
При взаимодействии кислорода с простыми веществами — металлами и неметаллами — обычно образуются оксиды; например:
|
|
60 °С |
4Li + O2 = 2Li2O |
4P + 5O2 === 2P2O5 |
|
|
|
250 °С |
2Са + О2 = 2СаО |
S + О2 |
==== SO2 |
300 °С |
|
700 °С |
2Cu + О2 ==== 2CuО |
С + О2 |
==== СО2 |
Однако имеются и исключения. Например, при окислении таких щелочных металлов, как натрий и калий, образуются главным образом пероксиды:
2Na + О2 = Na2O2 |
(Na—O—O—Na) |
Почти все реакции с участием О2 зкзотермичны, за редким исключением; например:
>1500 °С
N2 + O2 2NO – Q.
Характерной особенностью многих реакций соединения
с кислородом является выделение теплоты и света. Такие реакции называются горением.
394
В кислороде могут окисляться (в частности, гореть) многие сложные неорганические и органические вещества.
Например, при горении аммиака в кислороде (на воздухе) образуются азот и вода:
t°
4NH3 + 3О2 = 2N2 + 6Н2О,
а при каталитическом окислении аммиака — оксид азота (II) и вода:
P, t°
4NH3 + 5О2 === 4NO + 6Н2О
Сероводород H2S в избытке кислорода сгорает с образованием оксида серы (IV) и воды:
2H2S + 3О2 = 2SO2 + 2Н2О,
а при недостатке кислорода медленно окисляется до свободной серы:
2H2S + О2 = 2S + 2Н2О
В кислороде сгорают практически все органические вещества. Продуктами полного сгорания углеводородов и кислородсодержащих органических соединений являются углекислый газ и вода; например:
СН4 + 2О2 СО2 + 2Н2O С2Н5ОН + 3О2 2СО2 + 3H2О
При сгорании азотсодержащих органических веществ кроме СО2 и Н2О образуется свободный азот; например:
4CH3NHa + 9О2 4СО2 + 2N2 + 10Н2О
Кроме реакций горения существует много реакций неполного окисления различных органических веществ, которые будут подробно рассмотрены в ч. III настоящего пособия.
Еще более сильным окислителем, чем O2, является озон O3. В частности, в отличие от O2, он окисляет йодид калия до свободного йода, что используется для качественного и количественного определения озона:
О3 + 2KI + H2О = I2 + 2KОH + O2
(Выделяющийся йод обнаруживают по посинению крахмала.)
395
Роль кислорода в природе и его применение
Кислород играет исключительно важную роль в природе. При участии кислорода совершается один из важнейших процессов — дыхание. Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов. Важное значение имеет и другой процесс,
вкотором участвует кислород, — тление и гниение погибших животных и растений; при этом сложные органические вещества превращаются в более простые (в конечном
итоге в СО2, Н2О и N2), а последние вновь вступают в общий круговорот.
Единственным источником, пополняющим атмосферу кислородом, является жизнедеятельность зеленых растений (процесс фотосинтеза). Поэтому серьезной экологической проблемой является сохранение растительного мира нашей планеты.
Свыше 60 % всего промышленного кислорода используется в металлургии. При выплавке чугуна и стали (в доменном, кислородно-конверторном и мартеновском производствах) для интенсификации процессов окисления применяется кислородное дутье или дутье обогащенным кислородом воздухом. Кислород в смеси с ацетиленом используют также для сварки и резки металлов. Широкое применение кислород находит практически во всех отраслях химической промышленности. Кислород используют
влечебных целях в медицине (кислородные подушки, кислородные коктейли и др.).
Вопросы для контроля
1.Какие элементы относятся к халькогенам?
2.Где расположены халькогены в периодической системе элементов Д. И. Менделеева?
3.Сколько электронов в атомах халькогенов на внешнем электронном слое? Какова общая конфигурация внешнего электронного слоя атомов халькогенов?
4.Сколько неспаренных электронов имеют атомы халькогенов в невозбужденном состоянии?
5.Какую валентность имеет кислород? Почему валентность кислорода является постоянной величиной?
396
6.Какую валентность могут проявлять сера, селен и теллур?
7.Какова общая форма водородных соединений элементов подгруппы халькогенов?
8.Что образуется при растворении халькогеноводородов в воде?
9.Как называются халькогеноводородные кислоты, какая из них наиболее сильная?
10.Какие оксиды характерны для халькогенов? Какие кислоты им соответствуют?
11.Напишите молекулярные и графические формулы селенистой и селеновой кислот. Какая из них более сильная?
12.Какие степени окисления может иметь кислород в своих соединениях? Какая из степеней окисления для него наиболее характерна?
13.Какие аллотропные модификации образует кислород?
14.Каковы физические свойства простого вещества кислорода?
15.Как получают кислород в промышленности?
16.Каковы лабораторные способы получения кислорода?
17.С какими простыми веществами кислород непосредственно не взаимодействует?
18.Какие реакции называются реакциями горения?
19.К какому классу отяосятся вещества, которые обычно образуются при окислении кислородом металлов и неметаллов?
20.Какова роль кислорода в природных процессах?
21.Какое применение в промышленности находит кислород?
Упражнения и задачи для самостоятельны работы
1.Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения;
а) КСlО3 О2 СО2 О2 Н2О О2 Р2О5;
б) KNO3 О2 Na2O2 О2 СО2 СО СН3ОН СО2
S SO2 SO3 H2SO4.
2.Найдите, какая масса кислорода вступила в реакцию, если получено: а) 71 г оксида фосфора (V); 6} 4,4 г оксида углерода (IV); э) 4 г оксида магния; г) 4,5 г оксида азота (II).
3.Какова масса 1 л смеси, содержащей 10 об.% озона и 90 об.% кислорода (н. у.)?
397
4.Рассчитайте, в каком случае выделяется больше кислорода: при раз-
ложении 1 моль пероксида водорода H2O2 или 1 моль хлората калия KClO3.
5.Плотность смеси озона с кислородом по водороду равна 18. Найдите, исходя из этого, объемный состав смеси.
6.Какой из оксидов железа — Fc3O4 или Fe3O3 — богаче железом?
7.Запишите уравнение реакции горения по следующим данным: простое вещество реагирует с кислородом в массовых отношениях 5:2, при этом образуется оксид двухвалентного металла.
8.При полном сгорании сероводорода объемом 11,2 л (н. у.) выделилось 251,2 кДж теплоты. Определите, сколько теплоты выделится при сжигании сероводорода количеством 2 моль.
9.При полном разложении 56,1 г смеси КСlО3 и КMnО4 образовалось
8,96 л кислорода. Определите состав исходной смеси в процентах (по
массе).
10.При нагревании 245 г бертолетовой соли часть ее разложилась с выделением кислорода, а остальная часть соли — с образованием перхлората калия и хлорида калия. Определите процентное содержание перхлората калия в твердом остатке, если выделилось 13,44 л кислорода (н. у.).
11.Методом электронного баланса найдите коэффициенты в уравнениях следующих окислительно-восстановительных реакций:
Fe(OH)2 + О2 + Н2O Fe(OH)3 Cu(NO3)2 CuO + NO2 + O2
Н2O2 + K3[Fe(CN)6] O2 + K4[Fe(CN)6] + K2H2[Fe(CN)6]
§ 8.5. Сера и ее важнейшие соединения
Положение элемента в периодической системе Д. И. Менделеева. Сера — это элемент, находящийся в главной под-
группе VI группы, в 3-м периоде. Порядковый (атомный) номер 16. Заряд ядра атома равен +16. Относительная атомная
масса приблизительно равна 32.
Строение атома серы изучите, используя материал по об-
щей характеристике халькогенов.
398
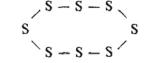
Физические свойства
Известны три аллотропные модификации серы: ромбическая, или α-сера; моноклинная, или β-сера, и пластическая, или каучукоподобная. Наиболее устойчивая модификация — ромбическая, именно в таком виде сера встречается в природе в свободном состоянии. Ромбическая сера состоит из циклических молекул S8, в которых атомы серы соединены одинарными ковалентными связями:
Ромбическая сера — твердое кристаллическое вещество желтого цвета, не растворяется в воде. Хорошо растворяется в сероуглероде CS2 и некоторых других органических растворителях. Температура плавления ромбической серы +112,8°, при температуре +444,6° сера кипит.
Нахождение в природе
Вприроде сера находится как в свободном состоянии, так и
ввиде соединений. Важнейшие из них следующие: FeS2 — пирит, или железный (серный) колчедан, CuS — медный блеск,
Ag2S — серебряный блеск, PbS — свинцовый блеск. Сера часто встречается в виде сульфатов: гипса — CaSO4 · 2Н2О; мирабилита, или глауберовой соли Na2SO4 · 10Н2О; горькой (английской) соли MgSO4 · 7Н2О и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Получение
Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах — автоклавах.
В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
399
