
Справочники / Репетитор по химии - Белов Н.В
..pdfВзаимодействие с простыми веществами
Как сильный окислитель хлор реагирует: а) с водородом:
hv
Сl2 + Н2 = 2НСl
хлороводород
(hv — кванты света, в темноте реакция не идет); б) с металлами:
Сl0 |
|
t° |
+1 –1 |
|
|
+ 2Na0 = 2NaCl |
|
хлорид натрия, |
|||
2 |
|
|
|
|
|
3Сl0 |
t° |
+3 –1 |
|
||
+ 2Fe0 = 2FeCl |
3 |
хлорид железа (III); |
|||
|
2 |
|
|
|
|
в) с некоторыми менее электроотрицательными неметал-
лами: |
|
t° |
+3–1 |
|
|
3Сl0 |
|
||||
+ 2Р0 = 2РСl |
3 |
хлорид фосфора (III), |
|||
|
2 |
|
|
|
|
Сl0 |
|
t°+2–1 |
|
|
|
+ S0 = SCl |
2 |
|
хлорид серы (II). |
||
2 |
|
|
|
|
|
С кислородом и азотом хлор непосредственно не взаимодействует.
Взаимодействие со сложными веществами
а) Реакция взаимодействия хлора с водой идет в две стадии.
На первой стадии процесса образуются две кислоты — соляная НСl и хлорноватистая НСlO:
–1 +1
Сl20 + Н2O НСl + НСlO
Затем происходит разложение хлорноватистой кислоты:
hv
НСlO = НСl + [О] атомарный кислород
Образованием атомарного кислорода объясняется окисляющее и отбеливающее действие хлора в воде. В хлорной воде погибают микроорганизмы. Органические красители, по-
мещенные в хлорную воду, обесцвечиваются.
б) Обратите внимание, что с кислотами хлор не реагирует.
380
в) Взаимодействие хлора с растворами щелочей происходит по-разному в зависимости от условий протекания
реакции:
–1 +1
на холоду: Сl20 + 2NaOH = NaCl + NaClO + Н2О;
|
Хлорид |
Гипохлорит |
|
|
|
|
|
натрия |
натрия |
|
|
|
|
при нагревании: 3Сl0 |
t° |
–1 +5 |
|
|
|
|
+ 6КОН = 5KCl + КСlO |
3 |
+ 3H |
2 |
О |
||
2 |
|
|
|
|
||
Хлорат
калия
г) Хлор взаимодействует с бромидами и иодидами металлов: Сl3 + 2КBr = 2КСl + Br2
Сl2 + 2KI = 2КСl + I2
С фторидами металлов хлор не реагирует, так как его окисли-
тельная способность ниже окислительной способности фтора: д) Хлор легко взаимодействует со многими органическими
веществами, например с метаном, бензолом и др.:
hv
Сl2 + СН4 СН3Сl + НСl
Хлористый
метил
AlCl3
Сl2 + С6Н6 C6H5Cl + НСl
Хлорбензол
Хлороводород и соляная кислота
Химическая связь в молекуле HCl является ковалентной
полярной связью:
δ+ σ δ–
Н — Сl
Хлороводород НСl — бесцветный газ с резким запахом, в воде хорошо растворяется, при 0 °С в 1 л воды растворяется около 400 л НСl. Раствор хлороводорода в воде имеет кислую реакцию и называется хлороводородной или соляной кислотой. Соляная кислота является сильной кислотой, обладает всеми общими свойствами кислот. Электролитическая диссоциация НСl выражается уравнением
HCI H+ + Сl–
381
Соляная кислота — активный химический реагент, она взаимодействует:
1) с основаниями и амфотерными гидроксидами: НСl + NaOH = NaCl + Н2О
2НСl + Zn(OH)2 = ZnCl2 + 2Н2О
2) с основными и амфотерными оксидами: 2НСl + MgO=MgCl2 + Н2О
6НСl + Al2O3 = 2AlCl3 + 3Н2О
3)с металлами, которые находятся в ряду напряжений до водорода:
Mg0 + 2HCl = MgCl2 + Н20
2Аl0 + 6НСl = 2АlСl3 + 3H20
4) с солями:
2НСl + Na2CO3 = 2NaCl + СО2 + Н2О
HCl + AgNO3 = AgCl + HNO3
Сl– + Ag+ = AgCl
Белый осадок
Последняя реакция является качественной реакцией на хлорид-ион.
Хлороводород можно получать:
а) прямым синтезом из водорода и хлора (см. § 8.2); б) действием концентрированной серной кислоты на
твердые хлориды, например:
NaCl (тв.) + Н2SO4 (конц.) = HCl + NaHSO4
(Отметим, что аналогичным способом можно получать НF, но нельзя получить НBr и HI, так как они являются сильными восстановителями и окисляются серной кислотой до свободных брома и йода.)
Применение хлора и хлороводорода. Физиологическая роль соляной кислоты в организме человека
Хлор используется для отбеливания бумаги и тканей, в производстве пластмасс, для дезинфекции питьевой воды. Хлор является исходным веществом при получении таких
382
важнейших продуктов, как хлорная известь, фосген, хлороформ, определенные виды моющих средств, ядохимикатов, каучуков и т. д. Огромное количество хлора используется для синтеза хлороводорода, растворением которого в воде получают соляную кислоту.
В организме человека соляная кислота вырабатывается клетками слизистой желудка. Она играет важную физиологическую роль, так как способствует перевариванию белков и убивает различные болезнетворные бактерии.
Вопросы для контроля
1.Назовите элементы-галогены и укажите их положение в периодической системе Д. И. Менделеева.
2.Охарактеризуйте физические свойства простых веществ-галогенов.
3.Какие валентности и степени окисления характерны для атомов галогенов в различных соединениях?
4.Как изменяются радиусы атомов, сродство к электрону и электроотрицательность галогенов в подгруппе?
5.Какой из галогенов является самым активным и какой — наименее активным окислителем?
6.Какие свойства — окислительные или восстановительные — проявляют галогенид-ионы?
7.Какой галогенид-ион является самым активным восстановителем?
8.Назовите все галогеноводороды и охарактеризуйте их физические свойства.
9.Какими свойствами обладают водные растворы галогеноводородов? 10. Напишите формулы известных оксидов хлора и назовите их. Напи-
шите формулы кислот, соответствующих этим оксидам. Назовите кислоты.
11. Приведите примеры солей, образованных кислородсодержащими кислотами хлора. Назовите эти соли.
12. Охарактеризуйте физические свойства и физиологическое действие хлора.
13. В виде каких соединений хлор встречается в природе?
14. Как получают хлор в промышленности, в лабораториях?
15. С какими простыми веществами взаимодействует хлор? Какие свойства проявляет хлор в этих реакциях?
16. Как называется раствор хлора в воде?
17. К какому типу окислительно-восстановительных реакций относится взаимодействие хлора с водой?
18. Взаимодействует ли хлор с кислотами?
383
19.Что образуется при взаимодействия хлора со щелочами на холоду
ипри нагревании?
20.Почему хлор взаимодействует с бромидами и йодидами металлов
ине взаимодействует с фторидами металлов?
21.Охарактеризуйте физические свойства хлороводорода.
22.Как называется раствор хлороводорода в воде?
23.Охарактеризуйте химические свойства хлороводородной (соляной) кислоты.
24.Какая реакция является качественной реакцией на хлорид-ион?
25.Какова физиологическая роль соляной кислоты в организме человека?
Задачи и упражнения для самостоятельной работы
1.Во сколько раз фтор, хлор тяжелее воздуха?
2.Какова масса 1 л фтора, 1 л хлора (н. у)?
3.Напишите уравнения реакций между водородом и галогенами: а) фтором, б) хлором, в) бромом.
4.Напишите уравнения реакций между натрием и фтором, кальцием и хлором, барием и бромом, алюминием и йодом. Назовите полученные соли.
5.Закончите уравнения реакций:
F2 |
+ КСl = |
|
Cl2 + KI = |
|||
F2 |
+ NaBr = |
|
Br2 + КI = |
|||
6. Как осуществить следующие превращения: |
||||||
хлороводород |
|
|
|
хлорид железа (III) |
||
гипохлорит кальция |
|
хлор |
|
хлорат натрия |
||
|
|
|||||
хлорид калия |
|
|
|
хлорноватистая кислота |
||
|
|
|
|
|||
7.Как получить хлор, если имеются:
а) оксид свинца (IV) PbО2 и соляная кислота HCl;
б) оксид марганца (IV), хлорид калия и серная кислота? Напишите уравнения реакций.
8.Смешали 1 л хлора и 2 л водорода (н. у). Сколько граммов хлороводорода можно получить из такой смеси? Чему будет равен объем смеси после реакции?
9.Какой объем хлора может быть получен при взаимодействии 2 моль хлороводорода и 3 моль оксида марганца (IV)?
10.Какой объем хлороводорода может быть получен при взаимодействии с водородом 20 л хлора?
11.Применяемая в медицине йодная настойка является 5 %-м раствором кристаллического йода в спирте. Какой объем спирта, плотность которого равна 0,8 г/мл, требуется для приготовления 250 г такого раствора?
384
Тест № 13 по теме: «Общая характеристика неметаллов.
Водород. Галогены»
(Число правильных ответов — 15)
Вариант I
1. Какие из указанных элементов относятся к неметаллам?
.А Zn .Б Cl .В Pb .Г H .Д Mg
2.Какую конфигурацию внешнего электронного слоя имеют атомы элементов главной подгруппы V группы?
. |
. |
ns2np3 |
. |
А ns2np2 |
Б |
В (n–1)d 2ns2 |
|
. |
. |
(n–1)d 3ns2 |
|
Г ns2np5 |
Д |
|
3.Какие из указанных неметаллов образуют двухатомные молекулы?
. |
фосфор |
. |
фтор |
А |
Б |
||
. |
кислород |
. |
криптон |
В |
Г |
||
. |
кремний |
|
|
Д |
|
|
4.В какой из указанных реакций сера играет роль окислителя?
. |
S + Сl |
2 |
= SCl |
2 |
|
|
. |
S + О |
2 |
= SO |
2 |
||||||
А |
|
|
|
|
|
Б |
|
|
|
||||||||
. |
|
|
|
|
2 |
S |
3 |
|
|
. |
|
|
2 |
= SF |
6 |
||
В 2P + 3S = P |
|
|
|
Г S + 3F |
|
|
|||||||||||
Д |
S + 2HNO |
3 |
= H |
SO |
4 |
+ 2NO |
|
|
|
|
|
|
|||||
. |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||
5.Какой из указанных неметаллов образует водородное соединение типа ЭН2?
. |
кремний |
. |
. |
А |
Б |
сера В аргон |
|
. |
хлор |
. |
мышьяк |
Г |
Д |
6. |
Какой из указанных оксидов образует кислоту типа |
||||||||||||||
. |
СО |
2 |
. |
|
2 |
O |
3 |
. |
|
3 |
|
||||
|
А |
|
|
Б |
N |
|
В SO |
|
|
||||||
. |
2 |
О |
5 |
. |
2 |
О |
5 |
|
|
|
|
|
|||
|
Г |
Р |
|
Д |
I |
|
|
|
|
|
|
||||
7. |
С какими из указанных веществ реагирует хлор? |
||||||||||||||
. |
Zn |
|
|
. |
|
|
|
. |
2 |
. |
2 . |
||||
|
А |
|
|
Б BaO |
|
|
|
В Cu(ОН) |
|
Г Н |
Д KI |
||||
385
8.С какими из указанных веществ реагирует соляная кислота (НСl)?
. |
2 |
О |
5 . |
. |
CuO |
|
||
А |
Р |
|
|
Б FeS |
В |
|
||
. |
|
|
3 |
) |
2 |
. |
CuSO |
4 |
Г |
Mg(NO |
|
Д |
|
||||
9.С какими из указанных веществ реагирует молекулярный водород (Н2)?
. |
НСl |
. |
2 |
O |
3 . |
|
А |
Б |
Fe |
В NaCl |
|||
. |
Сl |
2 . |
KOH |
|||
Г |
|
Д |
||||
Вариант II
1. Какие из указанных элементов относятся к неметаллам?
. |
Na |
. |
. |
А |
Б |
Hg В Br |
|
. |
Bi |
. |
P |
Г |
Д |
2.Какую конфигурацию внешнего электронного слоя имеют элементы главной подгруппы VI группы?
. |
. |
ns2np4 |
. |
А ns2np5 |
Б |
В (n–1)d 5ns1 |
|
. |
. |
(n–1)d 4ns2 |
|
Г ns2np6 |
Д |
|
3.Какие из указанных неметаллов образуют двухатомные молекулы?
. |
йод |
. |
. |
фтор |
А |
Б неон |
В |
||
. |
мышьяк |
|
. |
гелий |
Г |
|
Д |
4.В какой из указанных реакций углерод играет роль окислителя?
. |
С + О |
2 |
= СО |
2 |
|
|
. |
2С + О |
2 |
= 2СО |
|||||||
А |
|
|
|
|
Б |
|
|||||||||||
. |
С + 2Н |
2 |
= СН |
4 |
|
. |
|
|
|
|
|
|
|||||
В |
|
|
|
|
Г С + CuО = СО + Cu |
||||||||||||
Д |
С + 2H |
2 |
SO |
4 |
(к.) = 2SO |
2 |
+ СО |
2 |
+ 2Н |
2 |
О |
||||||
. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
5.Какой из указанных неметаллов образует водородное соединение типа ЭН?
. |
N |
. |
. |
А |
Б |
Si В I |
|
. |
O |
. |
Ar |
Г |
Д |
386
6. Какой из указанных оксидов образует кислоты типа
Н3ЭО4?
. |
2 |
O |
3 |
. |
2 |
O |
5 |
. |
SO |
3 |
|||
А |
N |
|
|
Б |
As |
|
В |
|
|||||
. |
2 |
O |
5 |
. |
NO |
2 |
|
|
|
|
|||
Г |
Сl |
|
|
Д |
|
|
|
|
|
||||
7. С какими из указанных веществ реагирует хлор?
. |
Са |
. |
2 |
O |
. |
Fe(OH) |
3 |
А |
Б |
Na |
В |
|
|||
. |
Р |
. |
КBr |
|
|
|
|
Г |
Д |
|
|
|
|||
8.С какими из указанных веществ реагирует соляная кислота (НСl)?
. |
FeSO |
4 . |
FeS |
|
. |
||
А |
|
Б |
|
В LiOH |
|||
. |
NaNO |
3 . |
2 |
4 |
) |
3 |
|
Г |
Д |
Al |
(SO |
|
|||
9.С какими из указанных веществ реагирует молекулярный водород (Н2)?
. |
СH |
4 . |
S |
. |
|
А |
|
Б |
В Ca |
||
. |
NH |
3 . |
КBr |
|
|
Г |
Д |
|
|||
§8.4. Халькогены (элементы главной подгруппы VI группы). Кислород, его получение и свойства
Вглавной подгруппе шестой группы периодической системы элементов Д. И. Менделеева находятся элементы: кислород О, сера S, селен Se, теллур Те и полоний Ро. Эти элементы имеют общее название «халькогены», что означает «образующие руды».
Элементы-халькогены при обычных условиях образуют
следующие простые вещества: кислород О2 — бесцветный газ; сера S — твердое кристаллическое вещество желтого цвета; селен, теллур и полоний — твердые вещества с металлическим блеском.
Аналогично галогенам в подгруппе халькогенов сверху вниз с увеличением заряда ядра атома закономерно изменяются свойства элементов: уменьшается их неметаллический характер и усиливаются металлические свойства. Так, кислород — типичный неметалл, а полоний — металл (радиоактивен).
387
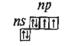
На внешнем электронном слое атомов халькогенов (табл. 42) содержится шесть электронов, конфигурация внешнего слоя ns2np4. Расположение электронов на последнем слое можно изобразить электронно-графической формулой:
Эта формула показывает, что атомы элементов данной подгруппы в невозбужденном состоянии имеют два неспаренных электрона на р-подуровне, и поэтому характерная валентность этих элементов равна двум:
|
|
I II |
I II |
I |
II |
I II |
I II III |
II |
|
|
|
Н2О H2S H2Se H2Te K2S Al2S3 |
|||||||
|
|
|
|
Некоторые характеристики халькогенов |
Таблица 42 |
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
Символ и |
|
|
|
Конфигу- |
|
|
|||
порядковый |
|
Название |
|
|
рация |
Радиус |
ЭО |
||
номер |
|
элемента |
|
внешнего |
атома, нм |
|
|||
элемента |
|
|
|
(валент- |
|
|
|||
|
|
|
|
|
|
ного) слоя |
|
|
|
|
|
|
|
|
|
|
атома |
|
|
|
|
|
|
|
|
|
|
|
|
8 |
O |
|
Кислород |
|
|
2s22p4 |
0,066 |
3,5 |
|
|
|
|
|
|
|
|
|
|
|
16 |
S |
|
Сера |
|
|
3s23p4 |
0,104 |
2,6 |
|
|
|
|
|
|
|
|
|
|
|
34 |
Se |
|
Селен |
|
|
4s24p4 |
0,117 |
2,48 |
|
|
|
|
|
|
|
|
|
|
|
52 |
Те |
|
Теллур |
|
|
5s25p4 |
0,137 |
2,01 |
|
|
|
|
|
|
|
|
|
|
|
84 |
Ро |
|
Полоний |
|
|
6s26p4 |
– |
1,76 |
|
|
|
|
|
|
|
|
|
|
|
Для кислорода валентность II является постоянной. Это объясняется так: кислород — элемент второго периода, на внешнем энергетическом уровне (n = 2) атома кислорода отсутствует d-подуровень, и поэтому невозможно возбуждение атома в пределах второго энергетического уровня, а для перехода спаренных e#-нов второго уровня на третий требуется затрата очень большого количества энергии.
388
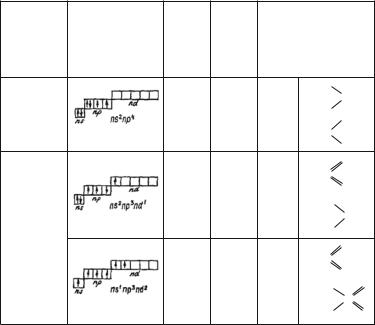
Удругих элементов данной подгруппы (серы, селена
ителлура) спаренные электроны s- и p-орбиталей легко возбуждаются и могут переходить на соответствующие d-ор- битали. При этом увеличивается число неспаренных электронов, а значит, и валентность элементов до четырех (IV) и шести (VI).
|
Валентные состояния атомов халькогенов |
Таблица 43 |
||||
|
|
|
||||
|
|
Число |
Вален- |
|
|
|
Состояния Строение внеш- |
неспа- |
тность |
Примеры |
|
||
атома |
него электрон- |
ренных |
атома |
соединений |
||
халько- |
ного слоя |
элект- |
халько- |
|
|
|
гена |
|
ронов |
гена |
|
|
|
Основное |
|
|
|
H2S |
H |
S |
(невоз- |
|
|
|
|
|
|
|
2 |
II |
|
H |
|
|
бужден- |
|
|
Cl |
|||
|
|
|
|
|
||
ное) |
|
|
|
SCl2 |
S |
|
|
|
|
Cl |
|||
|
|
|
|
|
|
|
|
|
|
|
SO2 |
S |
O |
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
4 |
IV |
|
H–O |
|
|
|
|
|
H2SO3 |
|
S=O |
Возбуж- |
|
|
|
|
H–O |
|
денные |
|
|
|
SO3 |
O=S |
O |
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
6 |
VI |
|
H–O |
O |
|
|
|
|
H2SO4 |
|
S |
|
|
|
|
|
H–O |
O |
В табл. 43 схематически показано строение внешнего электронного слоя атомов халькогенов (серы, селена, теллу-
ра) в основном и возбужденном состояниях.
Халькогены — окислители, но более слабые, чем галогены. Для завершения октета атомы халькогенов присоединяют по два недостающих электрона и в соединениях с металлами и водородом имеют отрицательную степень окисления –2:
Э0 + 2e# = Э–2
атом халькогена (окислитель)
389
