Наиболее важными соединениями марганца являются соли Mn (II), оксид марганца (IV) MnО2 и соли марганцовой кислоты НMnО4 — перманганаты.
Соли Mn (II) получаются при растворении марганца в разбавленных кислотах. Растворы этих солей практически бесцветны. При действии на них растворов щелочей выпадает белый осадок гидроксида марганца (II), который на воздухе быстро темнеет, окисляясь в бурый гидроксид марганца (IV):
2Mn(ОН)2 + О2 + 2Н2О = 2Mn(ОН)4
Наиболее устойчивым соединением марганца является темно-бурый диоксид марганца MnO2 (главный компонент
важнейшего природного соединения марганца — пиролюзита). В кислой среде MnО2 является достаточно сильным окислителем. Это его свойство используется, в частности, при получении хлора:
MnО2 + 4НСl = MnСl2 + Сl2 + 2Н2О
Марганцовая кислота является очень сильной кислотой, которая существует только в водном растворе. Самая
известная и широко применяемая соль этой кислоты — перманганат калия КMnО4. Это кристаллическое вещество
темно-фиолетового цвета, умеренно растворимое в воде. Растворы КMnО4 имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnО4–. Перманганат калия — сильный окислитель, легко окисляет многие органические и неорганические вещества.
Характер продуктов восстановления КMnО4 зависит от того, в какой среде происходит реакция. В кислой среде ио-
ны MnО4–, входящие в состав КMnО4, восстанавливаются до ионов Mn2+, Так, если к подкисленному серной кислотой фиолетовому раствору КMnО4 прибавить сульфит калия, то жидкость становится бесцветной, так как образуется соль Mn (II):
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
2MnO4– + 5SО32– + 6H+ = 2Mn2+ + 5SO42– + 3H2O
При действии K2SO3 на нейтральный раствор КMnО4 выпадает бурый осадок MnО2, т. е. степень окисления марганца изменяется от +7 до +4:
2KMnO4 + 3K2SO3 + Н2О = 2MnО2 + 3K2SO4 + 2KOH
2MnО4– + 3SO32– + Н2О = 2MnO2 + 3SO42– + 2ОН–
При большой концентрации щелочи и малом количестве K2SO3 перманганат восстанавливается до манганата К2MnО4:
2КMnО4 + K2SO3 + 2KOH = 2К2MnО4 + K2SO4 + Н2О
2MnО4– + SO32– + 2ОН– = 2MnО42– + SO42– + Н2О
В результате образования манганат-ионов раствор приобретает зеленый цвет.
Как окислитель перманганат калия широко применяется в химических лабораториях и производствах, он служит также прекрасным дезинфицирующим средством.
Соединения меди
Медь в своих соединениях проявляет степени окисления +1 и +2. Соединения меди (II) более устойчивы, чем соеди-
нения меди (I).
Соединения меди (I). Оксид меди (I) Cu2O — основный оксид, твердое вещество оранжево-красного цвета. Соответствующее этому оксиду основание — гидроксид меди (I) CuОН — является крайне нестойким соединением. При действии соляной кислоты на Cu2О образуется белый осадок хлорида меди (I) CuCl:
Сu2О + 2HCI = 2CuCl + Н2О
Он может быть получен также кипячением раствора хлорида меди (II) с металлической медью в солянокислой среде:
t°
CuСl2 + Cu = 2CuСl
Соединения меди (II). Оксид меди (II) CuО — твердое вещество черного цвета, которое можно получить в результате термического разложения некоторых солей меди (II):
t°
2Cu(NO3)2 = 2CuO + 4 NO2 + O2
t°
(CuOH)2CO3 = 2CuO + CO2 + H2O
Оксид меди (II) является основным оксидом, поэтому растворяется в кислотах с образованием солей меди (II):
CuО + 2НСl = CuСl2 + Н2О CuО + 2HNO3 = Cu(NO3)2 + Н2О
CuО нерастворим в воде и с ней не взаимодействует. Соответствующий ему гидроксид Cu(ОН)2 получают действием щелочей на растворы солей меди (II):
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Гидроксид меди (II) выделяется в виде голубого осадка, который уже при слабом нагревании разлагается, превращаясь в черный оксид меди (II):
t°
Cu(ОН)2 = CuО + Н2О
Cu(ОН)2 является очень слабым основанием, поэтому соли меди (II) в водных растворах гидролизуются по катиону и имеют кислую реакцию среды.
Оксид и гидроксид меди (II) проявляют окислительные свойства и легко восстанавливаются до металлической меди или оксида меди (I) при взаимодействии с неорганическими и органическими восстановителями, например:
t°
CuО + Н2 = Cu + Н2О;
 O t°
O t°
2Cu(ОН)2 + СН3—С—Н Cu2O + СН3СООН + 2Н2О
Растворимые соли меди (II) диссоциируют в водных растворах с образованием гидратированных ионов [Cu(Н2О)4]2+, которые имеют сине-голубой цвет (в отличие от бесцветных негидратированных ионов Cu2+). Поэтому такая окраска свойственна разбавленным растворам всех солей меди (II), если они не содержат окрашенных анионов.
Ионы меди (II) и меди (I) являются типичными комплексообразователями. Для иона Cu+ наиболее характерно координационное число 2, а для ионов Cu2+ — 4.
Образованием растворимых в воде аммиакатов объясняется растворение различных нерастворимых соединений меди в водном растворе аммиака, например:
CuCI + 2NH3 = [Cu (NH3)2]Cl;
Cu2О + 4NH3 + H2O = 2[Cu(NH3)2]OH;
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Гидроксид меди (II) растворяется также в очень концентрированных растворах щелочей, образуя гидроксокомплексы, например:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Последняя реакция свидетельствует о проявлении гидроксидом меди (II) признаков амфотерности.
Для меди известны также ацидокомплексы типа K2[CuCl4], Na2[Cu(CN)4] и т. п.
Биологическая роль соединений марганца а меди
Марганец и медь принадлежат к числу микроэлементов, т. е. элементов, малые количества которых необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу биологически важных веществ. Соединения меди используются также для борьбы с вредителями сельскохозяйственных растений.
Вопросы для контроля
1.Какие степени окисления проявляет марганец в своих соединениях?
2.Как изменяется характер оксидов и гидроксидов марганца при увеличении его степени окисления?
3.Назовите наиболее важные соединения марганца.
4.Почему белый осадок гидроксида марганца быстро темнеет на воздухе?
5.Какие окислительно-восстановительные свойства проявляет диоксид марганца?
6.Охарактеризуйте физические и химические свойства перманганата калия. Каковы продукты восстановления перманганата калия в различных средах?
7.Какие степени окисления проявляет медь в своих соединениях? Соединения с какой степенью окисления меди наиболее устойчивы?
8.Охарактеризуйте физические и химические свойства оксида меди (I).
9.Каковы физические свойства и способы получения оксида и гидроксида меди (II)?
10.Каковы кислотно-основные и окислительно-восстановительные свойства оксида и гидроксида меди (II)?
11.Почему растворы большинства солей меди (II) имеют сине-голубой цвет?
12.Какие координационные числа наиболее характерны для комплексных соединений меди (I) и меди (II)?
13.Почему многие нерастворимые в воде соединения меди растворяются в водном растворе аммиака?
14.Приведите примеры гидроксокомплексов и ацидокомплексов меди.
15.Какова биологическая роль соединений марганца и меди?
Задания для самостоятельной работы
1.Определите степени окисления марганца и меди в следующих соединениях:
Н2MnО3, Ca(MnO4)2, Mn(CH3COO)2, Na2MnO4, Cu2S, [Cu(NH3)4]SO4, K2[Cu(CN)4].
2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Mn MnSO4 Mn(ОН)2 Mn(OH)4 MnO2 Cl2;
б) CuO Cu(NO3)2 Cu(OH)2 CuCl2 CuCl [Cu(NH3)2]Cl.
3.Напишите уравнения трех способов получения: а) хлорида марганца (II); б) сульфата меди (II); в) оксида меди (II).
4.Закончите уравнения следующих реакций:
а) КMnO4 + H2S + H2SO4 S + …;
б) KMnO4 + NaI + КОН I2 + NaOH + …; в) KMnO4 + NaNO2 + H2O NaNO3 + …; r) KMnO4 + HCl …
Раздел 8
НЕМЕТАЛЛЫ И ИХ НЕОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Из 109 известных элементов более 20 относятся к неметаллам. Роль неметаллов и их соединений в природе очень велика. Неметаллы составляют более 84 % от массы почвы, 98,5 % от массы растений и 97,6 % от массы тела человека.
Шесть неметаллов — углерод, водород, кислород, азот, фосфор и сера — являются органогенными элементами, так как
входят в состав молекул белков, жиров, углеводов и нуклеиновых кислот. Воздух, которым мы дышим, представляет собой смесь простых и сложных веществ, образуемых неметаллами (кислород О2, азот N2, углекислый газ СО2, аргон Аr и другие благородные газы).
Функции неметаллов и их соединений в природе зависят от их свойств и строения, которые изучаются в данном разделе.
§ 8.1. Общая характеристика неметаллов
Положение неметаллов в периодической системе Д. И. Менделеева и строение внешнего электронного слоя
атомов неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор — астат» (см. табл. 34). Это элементы главных подгрупп III, IV, V, VI, VII и VIII групп. К неметаллам относятся: бор В, углерод С, кремний Si, азот N, фосфор Р, мышьяк As, кислород О, сера S, селен Se, теллур Те, водород Н, фтор F, хлор Сl, бром Br, йод I, астат At. К неметаллам также относятся благородные газы: Не — гелий, Ne — неон, Аr — аргон, Кг — криптон, Хе — ксенон, Rn — радон.
Среди неметаллов два элемента — водород и гелий — относятся к s-семейству, все остальные принадлежат к р-семей- ству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода — один электрон (1s1), у атома гелия — два электрона (1s2), у атома бора — три электрона (2s22p1). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов — от 4 до 8; их электронные конфигурации изменяются от ns2np2 у атомов элементов главной подгруппы IV группы до ns2np6 у атомов инертных газов (табл. 34).
Таблица 34
Положение неметаллов в периодической системе
Д.И. Менделеева и электронные конфигурации внешнего электронного слоя их атомов
|
|
1 период |
|
|
1s1 |
1s2 |
|
|
|
|
|
|
H |
He |
Группы |
III |
IV |
V |
VI |
VII |
VIII |
|
|
|
|
|
|
|
Общее число |
|
|
|
|
|
|
электронов |
|
|
|
|
|
|
на внешнем |
3 |
4 |
5 |
6 |
7 |
8 |
электронном |
|
|
|
|
|
|
слое |
|
|
|
|
|
|
|
|
|
|
|
|
|
Электронная |
|
|
|
|
|
|
конфигурация |
ns2np1 |
ns2np2 |
ns2np3 |
ns2np4 |
ns2np5 |
ns2np6 |
внешнего слоя |
|
|
|
|
|
|
|
|
|
|
|
|
|
Периоды |
1 |
B |
С |
N |
O |
F |
Ne |
|
3 |
|
Si |
P |
S |
Cl |
Ar |
|
4 |
|
|
As |
Se |
Br |
Кr |
|
5 |
Металлы |
|
Te |
I |
Xe |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
At |
Rn |
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Характеристика неметалличности
В отличие от металлов у атомов неметаллов высокая энергия ионизации и большое сродство к электрону. Поэтому для
атомов неметаллов более характерной является способность присоединять электроны для завершения электронного октета — устойчивой конфигурации ns2np6.
Способность присоединять электроны обусловливает
окислительные свойства неметаллов.
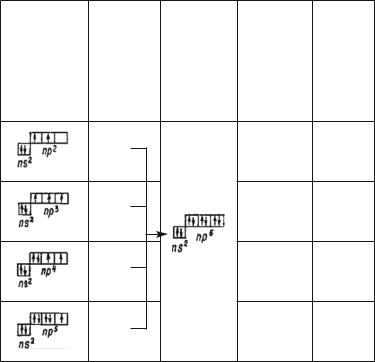
Если у атома неметалла на внешнем электронном слое имеется 4 электрона, то для завершения октета он присоединяет 4e#; при наличии 5 электронов — 3e#, 6 электронов — 2e# и 7 электронов — 1e#. В связи с этим характерные степени окисления атомов неметаллов в соединениях соответственно равны –4, –3, –2, –1 (табл. 35).
|
|
|
|
Таблица 35 |
Схематическое изображение способности атомов неметаллов |
|
присоединять недостающее до октета число электронов |
|
в зависимости от строения их внешних электронных слоев |
|
Электронная |
Число |
|
|
|
|
конфигурация электронов, |
Строение |
Степень |
|
|
внешнего |
присоеди- |
завершенно- |
окисления |
Примеры |
слоя атома |
няемых |
го внешнего |
атомов в со- |
соеди- |
неметалла |
к атому для |
слоя |
единении |
нений |
|
завершения |
|
|
|
|
|
октета |
|
|
|
|
|
4 |
|
–4 |
Al+3C–4 |
|
|
|
|
4 |
3 |
|
3 |
|
–3 |
Al+3N–3 |
|
2 |
октет |
–2 |
Al+3S–2 |
|
|
|
|
2 |
3 |
|
1 |
|
–1 |
Al+3Cl–1 |
|
|
|
|
|
3 |
|
|
357 |
|
|
|

Окислительные свойства неметаллов определяются их положением в периодической системе. В периодах окислительные свойства увеличиваются слева направо, в подгруппах — уменьшаются сверху вниз. Это обусловлено тем, что в периодах слева направо увеличиваются электроотрицательность и сродство к электрону, а в главных подгруппах сверху вниз эти характеристики элементов уменьшаются.
В табл. 36 показано, что по сравнению со всеми остальными неметаллами 2-го периода у атома фтора заряд ядра максимальный, радиус атома — минимальный. Поэтому атом фтора способен наиболее легко присоединять недостающий до октета электрон. Фтор характеризуется наибольшей электроотрицательностью и, следовательно, проявляет самые сильные окислительные свойства.
Рассматривая изменение свойств элементов-неметаллов в главных подгруппах, следует отметить, что сверху вниз (табл. 37) с увеличением радиуса атома электроотрицательность, сродство к e#-ну и соответственно окислительные свойства уменьшаются, т. е. уменьшается неметалличность элементов.
Таблица 36
Характеристика атомов-неметаллов 2-го периода
Порядковый номер |
|
5В |
6С |
7N |
8O |
|
9F |
и символ элемента |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Радиус атома, нм |
0,091 |
0,077 |
0,071 |
0,066 |
0,064 |
|
|
|
|
|
|
|
|
Общее число электронов |
|
|
|
|
|
|
|
на внешнем электронном |
|
3e# |
4e# |
5e# |
6e# |
|
7e# |
слое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электронная конфигура- |
|
2s22p1 |
2s22p2 |
2s22p3 |
2s22p4 |
2s22p5 |
ция внешнего слоя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Относительная электро- |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
отрицательность (ЭО) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Увеличение неметалличности и окислительных свойств
Таблица 37
Характеристика атомов-неметаллов главной подгруппы VII группы
Символ |
|
Конфи- |
|
|
|
|
и поряд- |
Назва- |
гурация |
Радиус |
|
|
|
ковый |
ние |
внешнего |
атома, |
ЭО |
|
|
номер |
эле- |
электрон- |
нм |
|
|
|
элемен- |
мента |
ного |
|
|
|
|
та |
|
слоя |
|
|
|
|
|
|
|
|
|
|
|
|
9 |
F |
Фтор |
2s22p5 |
0,064 |
4,0 |
|
|
|
|
17 |
9 |
Сl |
Хлор |
3s23p5 |
0,099 |
3,0 |
|
Уменьшение не- |
35 |
Br |
Бром |
4s24p5 |
0,114 |
2,8 |
|
металличности |
53 |
I |
Йод |
5s25p5 |
0,133 |
2,2 |
|
и окислитель- |
85 |
At |
Астат |
6s26p5 |
– |
1,9 |
|
ных свойств |
|
|
|
|
|
|
|
|
|
|
Физические свойства
Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных
состояниях:
газы |
жидкость |
твердые вещества |
Благородные газы: |
Бром Br2 |
Йод I2, углерод С, кремний |
Не, Ne, Аr, Кг, Хе, Rn; |
|
Si, сера S, фосфор Р и др. |
водород Н2, кислород О2, азот N2, фтор F2, хлор Сl2
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2.
Кристаллические решетки металлов и твердых веществ-не- металлов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существует особый вид связи — металлическая связь. Атомы неметаллов образуют менее плотно упакованную структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые веществанеметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.



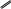 O
O