
Підручники з Хімії / Хімія 9 клас / Ярошенко Хімія 9 клас. 2017
.pdf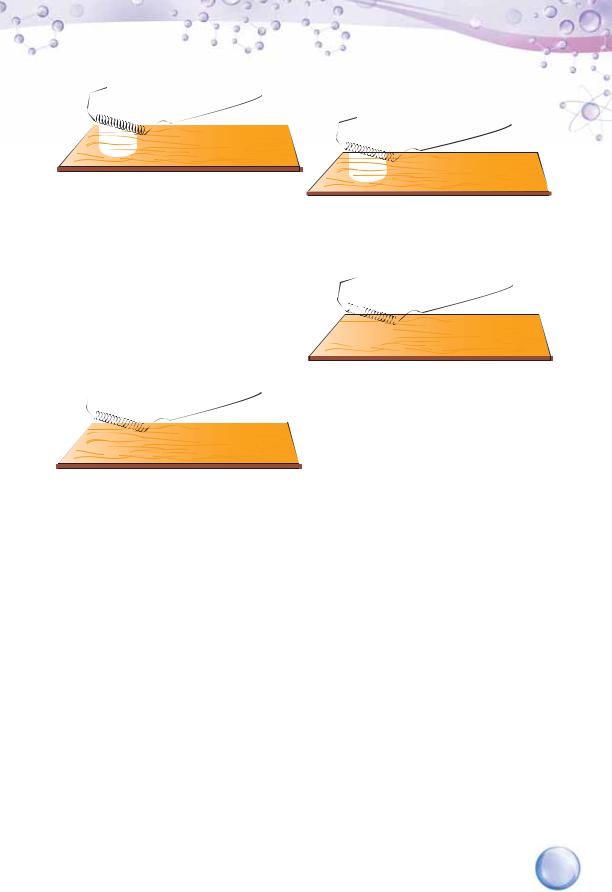
а — кухонна сіль
б — дистильована вода
в — розчин кухонної солі
г — цукор
д — розчин цукру
е — розчин гідроген хлориду
Дослідження електропровідності різних речовин і розчинів
Під’єднаємо прилад для визначення електропровідності речовин і розчинів до джерела постійного струму й електродами доторкнемося до кристалічного натрій хлориду, яким на ¼ наповнений скляний стакан. Лампа не світиться (мал. 17, а).
Зануримо електроди приладу в скляний стакан, наполовину заповнений дистильованою водою. Лампа також не світиться (мал. 17, б).
Половину дистильованої води обережно віллємо у ста- |
кан з натрій хлоридом, перемішаємо речовини скляною |
паличкою, після чого в розчин зануримо електроди. |
Лампа одразу засвітилася й не гасне доти, поки електро- |
51
ди містяться в розчині (мал. 17, в). Це свідчить про те, що електричне коло приладу замкнулося. Отже, у розчині натрій хлориду присутні заряджені частинки, які стали носіями струму.
Промитими та насухо витертими електродами приладу |
доторкнемося до кристалів цукру, яким на ¼ наповне- |
ний скляний стакан. Лампа не світиться (мал. 17, г). |
Другу половину дистильованої води віллємо обереж- |
но у стакан із цукром, перемішаємо речовини скляною |
паличкою, після чого у виготовлений розчин зануримо |
електроди приладу для визначення електропровідності |
розчинів. На відміну від досліду з розчином натрій хлориду, лампа не |
світиться (мал. 17, д). А це є доказом того, що в розчині не з’явилися |
заряджені частинки, які б стали носіями струму. |
|
Електроди приладу зануримо у скляний стакан, що на |
||||
|
¼ наповнений хлоридною кислотою. Як ви вже знаєте, |
||||
|
хлоридна кислота — це розчин гідроген хлориду у воді. |
||||
Лампа засвітилася (мал. 17, е). Це свідчить про те, що в цьому розчині |
|||||
наявні заряджені частинки й електричне коло замкнулося. |
|||||
Демонстраційні досліди 3 та 6 показали, що розчин натрій хлориду і |
|||||
розчин гідроген хлориду проводять електричний струм, а тверді речови- |
|||||
ни натрій хлорид і цукор, дистильована вода та розчин цукру (досліди 1, |
|||||
2, 4 та 5) електричного струму не проводять. Що саме забезпечило прохо- |
|||||
дження електричного струму в дослідах 3 та 6, адже під час вивчення роз- |
|||||
чинення речовин у воді не йшлося про утворення вільних електронів? |
|||||
Відповідь на це запитання знайшов шведський учений Сванте Арре- |
|||||
ніус, провівши багато дослідів з порівняння електропровідності кислот, |
|||||
основ, солей, сумішей речовин залежно від розчинника, температури |
|||||
й концентрації розчинів. У 1884 р. він описав свої досліди й на підста- |
|||||
ві одержаних результатів зробив висновок про те, що носіями струму в |
|||||
розчині є заряджені частинки — йони, на які розпадається розчинена ре- |
|||||
човина під впливом полярного розчинника (води), а не в результаті про- |
|||||
ходження електричного струму через розчин. Спершу вчені виступили |
|||||
проти такої теорії. Однак досить скоро зрозуміли геніальність Сванте Ар- |
|||||
Дізнайтесь |
більше |
про |
внесок |
реніуса. З того часу минуло понад сто- |
|
ліття, теорія справджується й успішно |
|||||
С. Арреніуса в науку з «Інформацій- |
|||||
розвивається, а її творець удостоєний |
|||||
ної сторінки». |
|
|
|||
|
|
Нобелівської премії. |
|||
|
|
|
|
||
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ РЕЧОВИН. Так називається явище, завдяки якому розчин натрій хлориду і хлоридна кислота стали електропровідними.
52
Електролітична дисоціація — це розпад речовин на вільно рухливі йони під впливом полярних молекул розчинника або в розплаві.
Як ви вже знаєте, під час розчинення речовин у воді полярні молекули води притягують до себе йони або молекули, що перебувають у вузлах кристалічної ґратки розчиненої речовини, і якщо це притягання перевищує силу притягання між структурними частинками у кристалі, речовина розчиняється. Так, розчиняючись у воді, натрій хлорид дисоціює на катіони Натрію та аніони Хлору. Вони хаотично переміщуються в товщі розчинника — води. Під впливом електричного поля хаотичний рух йонів стає впорядкованим: позитивно заряджені йони Na+ рухаються до негативно зарядженого електрода, що має назву катод, а негативно заряджені йони Сl– — до позитивно
зарядженого електрода анода. Це й забезпечило електропровідність розчину натрій хлориду в досліді 3.
За назвою електродів, до яких рухаються йони в електричному колі, їх назвали катіони й аніони.
колі, їх назвали катіони й аніони.
Цукор — речовина молекулярної будови. Під час розчинення в розчин переходять і вільно переміщуються в ньому молекули цукру. Оскільки молекули — електронейтральні (незаряджені) частинки, то між електродами приладу не виникав електричний струм і лампа не світилася.
Залишається з’ясувати, звідки в демонстраційному досліді 6 з’явилися заряджені частинки в розчині гідроген хлориду (хлоридній кислоті). Відомо, що гідроген хлорид НСІ — речовина молекулярної будови, у ній немає ні катіонів Гідрогену Н+, ні аніонів Хлору Сl–. Тому рідкий гідроген хлорид не взаємодіє з металами, лугами й основними оксидами. Але ж ви неодноразово проводили всі ці реакції з хлоридною кислотою й переконувались у протилежному! З приводу цього Сванте Арреніус висунув припущення про вплив води.
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ РЕЧОВИН З КОВАЛЕНТНИМ ПОЛЯРНИМ ЗВ’ЯЗКОМ. Молекули гідроген хлориду з ковалентним сильним полярним зв’язком під впливом диполів води йонізуються — розпадаються на йони й переходять у розчин у вигляді гідратованих йонів (схема 16).
Як видно зі схеми, спільна електронна пара, що в молекулі гідроген хлориду забезпечувала наявність ковалентного полярного зв’язку між атомами Гідрогену й Хлору, під впливом диполів води повністю зміщується до атома Хлору. Унаслідок цього атом Гідрогену перетворюється на катіон Гідрогену Н+, а відповідно атом Хлору — на аніон Хлору Сl–. Завдяки цьому в досліді 6 замкнулося електричне коло — і лампа засвітилась.
53
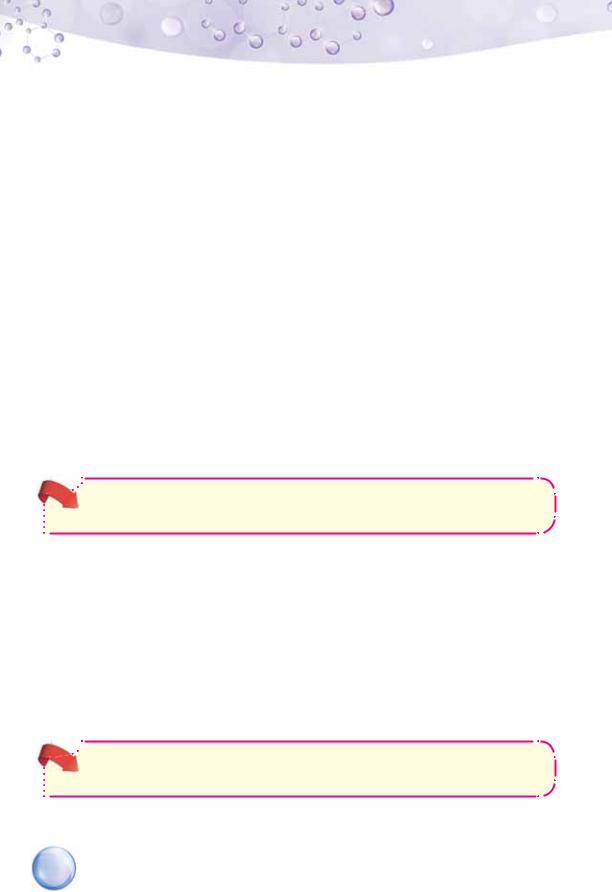
Електролітична дисоціація полярної молекули гідроген хлориду у воді
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ РЕЧОВИНИ В РОЗПЛАВІ. Електролітична дисоціація речовин з йонним хімічним зв’язком у розплавах пояснюється тим, що під впливом високої температури зв’язки у кристалічній ґратці руйнуються, і йони починають вільно рухатись. Як і в розчинах, цей рух хаотичний, але під дією електричного поля він стає спрямованим.
ПОДІЛ РЕЧОВИН НА ЕЛЕКТРОЛІТИ ТА НЕЕЛЕКТРОЛІТИ. За здатністю проводити електричний струм у розчиненому стані чи розплаві речовини поділяють на електроліти та неелектроліти.
Електроліти — це речовини, водні розчини чи розплави яких проводять електричний струм.
До електролітів належать речовини з йонними та ковалентними сильно полярними зв’язками. Це солі, луги, кислоти. Ті з них, що в таблиці розчинності кислот, основ, амфотерних гідроксидів і солей позначено літерою «р» (див. форзац 2), достатньо розчинити у воді. Після цього їхні кристали руйнуються, і йони переходять у розчин.
Незважаючи на те, що внаслідок електролітичної дисоціації утворюються різнойменно зарядженні йони, розчин або розплав залишається електронейтральним. Це тому, що сума позитивних зарядів катіонів дорівнює сумі негативних зарядів аніонів. Вільні йони в розчинах і розплавах рухаються хаотично, але під впливом електричного поля цей рух стає впорядкованим (виникає електричний струм).
 Неелектроліти — це речовини, що в розчині чи розплаві не проводять електричного струму.
Неелектроліти — це речовини, що в розчині чи розплаві не проводять електричного струму.
Прикладами неелектролітів є неорганічні речовини з ковалентним неполярним зв’язком. Не будуть проводити електричний струм: рідкий ки-
54

сень, водень і гідроген хлорид, а також тверді речовини фосфор і сірка тощо. Багато органічних речовин також є неелектролітами, наприклад, цукор, сахароза, глюкоза, крохмаль.
Пригадайте результат демонстраційного досліду 5 з перевірки електропровідності розчину цукру.
Інформаційна сторінка
Сванте Арреніус (1859–1927) — шведський учений, фізик за освітою, котрий став знаменитим завдяки хімічним дослідженням. За розробку теорії електролітичної дисоціації Арреніусу присуджено Нобелівську премію 1903 року. Один із засновників нової науки — фізичної хімії.
Основні наукові праці присвячені вченню про розчини й залежності швидкості хімічних реакцій від температури. У 1884 р. сформулював висновок про самочинний розпад солей у розчині на заряджені частинки — йони, тобто висунув ідею про електролітичну дисоціацію. Сванте Арреніус — учений із широким колом наукових інтересів; крім хімії, його цікавили походження світу, життя у Всесвіті.
Член академій наук і наукових товариств багатьох країн, був директором Нобелівського фізико-хімічного інституту в Стокгольмі.
Стисло про основне
Електролітична дисоціація — це розпад речовин під час розчинення у воді або плавлення на вільні йони — позитивно заряджені катіони й негативно заряджені аніони.
У водних розчинах руйнування кристалічної ґратки йонних сполук чи йонізація полярного ковалентного зв’язку відбувається під впливом полярних молекул води.
У розчинах і розплавах електролітів позитивні заряди катіонів зрівноважені негативними зарядами аніонів, тому розчин і розплав у цілому електронейтральні.
За здатністю речовин проводити електричний струм у розчині чи розплаві їх класифікують на електроліти та неелектроліти.
Електроліти піддаються електролітичній дисоціації й тому їх розчини чи розплави проводять електричний струм.
Неелектроліти не піддаються електролітичній дисоціації й їх розчини чи розплави не проводять електричного струму.
55
Знаємо, розуміємо
Дайте визначення електролітичної дисоціації. Речовинам з якими типами хімічних зв’язків вона властива?
 Які речовини називають електролітами, а які — неелектролітами? Наведіть приклади.
Які речовини називають електролітами, а які — неелектролітами? Наведіть приклади.
Чому кристалічний барій хлорид, маючи у своєму складі катіони Барію та хлориданіони, не проводить електричного струму, а його розчин є електропровідним?
Чим ви поясните те, що колодязна або артезіанська вода, на відміну від дистильованої, проводить електричний струм?
Застосовуємо
У переліку речовин: натрій гідроксид, кальцій хлорид, нітратна кислота, рідкий азот, глюкоза… А переважають неелектроліти
Б переважають електроліти В електролітів і неелектролітів порівну Г електроліти відсутні
У якому з випробувань електропровідності лампочка приладу засвітиться?
А твердий магній сульфат |
В рідкий гідроген бромід |
|
Б розчин магній сульфату |
Г |
дистильована вода |
Зазначте формулу неелектроліту. |
|
|
А AlBr3 |
В H2SO4 |
|
Б Br2 |
Г |
LiOH |
Складіть план розпізнавання за допомогою приладу для визначення електропровідності розчинів двох твердих речовин білого кольору — глюкози та натрій карбонату.
§ 10.
У водних розчинах і розплавах йони внаслідок дифузії переміщуються хаотично. Однак між протилежно зарядженими йонами існує взаємне притягання, тому відбувається ще й асоціація — процес, протилежний дисоціації. Тому дисоціацію речовин на йони прийнято виражати оборотним рівнянням електролітичної дисоціації.
дисоціація
HCl  H+ + Cl–
H+ + Cl–
асоціація
Опанувавши матеріал параграфа, ви зможете:
зрозуміти й пояснювати суть процесу електролітичної дисоціації кислот, основ, солей;
складати рівняння електролітичної дисоціації лугів, кислот, солей;
актуалізувати знання про дію кислот і лугів на індикатори в розчинах;
з’ясувати, чим зумовлена однакова дія кислот на індикатори та однакова дія лугів на індикатори в розчинах.
56
У лівій частині рівняння електролітичної дисоціації речовини
 записують її хімічну формулу, а в правій — йони, на які речовина дисоціює. Між правою й лівою частинами рівняння ставлять дві горизонтальні, напрямлені в різні боки стрілки.
записують її хімічну формулу, а в правій — йони, на які речовина дисоціює. Між правою й лівою частинами рівняння ставлять дві горизонтальні, напрямлені в різні боки стрілки.
Розглянемо електролітичну дисоціацію кислот, основ, солей у водному розчині та потренуємося в складанні рівнянь дисоціації різних електролітів. Аби робота була ефективнішою, попрацюйте групами й повторіть матеріал щодо дії кислот і лугів на різні індикатори в розчинах. За потреби використайте матеріал таблиці 6.
|
|
|
Таблиця 6 |
|
Забарвлення індикаторів у різних середовищах |
||||
|
|
|
|
|
ІНДИКАТОР |
|
СЕРЕДОВИЩЕ |
|
|
|
|
|
||
Кисле |
Нейтральне |
Лужне |
||
|
||||
|
|
|
|
|
Фенолфталеїн |
Безбарвний |
Безбарвний |
Малиновий |
|
|
|
|
|
|
Лакмус |
Червоний |
Фіолетовий |
Синій |
|
|
|
|
|
|
Метиловий оранжевий |
Червоний |
Оранжевий |
Жовтий |
|
(Метилоранж) |
||||
|
|
|
||
|
|
|
|
|
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ КИСЛОТ. Розчинні у воді кисло-
ти дисоціюють на катіони Гідрогену й аніони кислотного залишку. |
|
|
HCl |
H+ + Cl– |
(1) |
HNO3 |
H+ + NO–3 |
(2) |
На відміну від одноосновних, багатоосновні кислоти дисоціюють із послідовним відщіпленням йонів Гідрогену, тобто ступінчасто. Так, дисоціація двоосновної сульфатної кислоти відбувається у два ступені.
Щоб пересвідчитись у цьому, випробуйте розчини розглянутих та інших кислот, виконавши завдання 1 і 2 лабораторного досліду 1 з рубрики «Хімія — це життя: сторінка природодослідника».
1 ступінь: Н2SO4  Н+ + HSO–4 (гідрогенсульфат-аніон) 2 ступінь: HSO4–
Н+ + HSO–4 (гідрогенсульфат-аніон) 2 ступінь: HSO4–  Н+ + SO42– (сульфат-аніон)
Н+ + SO42– (сульфат-аніон)
Сумарне рівняння електролітичної дисоціації сульфатної кислоти буде таким:
Н |
SO |
4 |
2Н+ + SO2– |
(3) |
2 |
|
4 |
|
Зверніть увагу на те, що в рівняннях електролітичної дисоціації застосовують коефіцієнти. Вони потрібні для того, щоб перетворити схему в рівняння.
57
Слід зазначити, що під час ступінчастої електролітичної дисоціації кислот за першим ступенем кислота дисоціює більше, ніж за другим чи третім (якщо кислота трьохосновна).
Скільки б рівнянь електролітичної дисоціації кислот ми не складали, у кожному з них будуть записані катіони Гідрогену Н+.
Кислоти — це електроліти, що дисоціюють з утворенням катіонів Гідрогену Н+ та аніонів кислотного залишку.
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ ОСНОВ. У розчині можлива дисоціація лише розчинних основ, тобто лугів. Вони дисоціюють на катіони металічного елемента та гідроксид-аніони ОН–.
КОН = К+ + ОН– NaОН = Na+ + ОН– Са(ОН)2 = Са2+ + 2ОН–
Виняток становить амоній гідроксид NН4OH (вивчається у старшій школі).
Як бачимо, спільними йонами, що утворюються під час дисоціації лугів, є гідроксид-аніони ОН–.
 Основи (луги) — це електроліти, що дисоціюють з утворенням аніонів одного виду — гідроксид-аніонів ОН–.
Основи (луги) — це електроліти, що дисоціюють з утворенням аніонів одного виду — гідроксид-аніонів ОН–.
Випробуйте розчини лугів різними Загальні властивості лугів, які ви індикаторами, виконавши завдан- вивчали у 8 класі, також обумовлені
ня 3 та 4 лабораторного досліду 1 з наявністю цих аніонів.
рубрики «Хімія — це життя: сторінка природодослідника».
Попрацюйте групами
1.Складіть рівняння ступінчастої дисоціації сульфітної й ортофосфатної кислот.
2.Набуті теоретичні знання та практичні вміння застосуйте для розпізнавання у трьох пробірках без етикеток води, розчину кислоти й розчину лугу.
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ СОЛЕЙ. Солі дисоціюють на йони, з яких вони складаються.
NaІ = Na+ + І–
MgСІ2 = Mg2+ + 2СІ–
Fe2(SO4)3 = 2Fe3+ + 3SO42–
58

Солі — це електроліти, що дисоціюють на катіони металічних елементів та аніони кислотних залишків (виняток — солі амонію).
Користуючись таблицею розчинності речовин у воді (див. форзац 2), легко визначити, з яких йонів утворено конкретні кислоти, основи чи солі, адже в таблиці подано катіони й аніони, а не окремі атоми чи групи атомів.
Попрацюйте групами
1.Користуючись таблицею розчинності, складіть формули трьох розчинних солей Алюмінію, катіони яких мають заряди 1+, 2+, 3+. Напишіть рівняння електролітичної дисоціації цих солей. Зазначте, унаслідок дисоціації якої із солей кількістю речовини 1 моль утворюватиметься найбільша кількість іонів.
2.Укажіть кількість речовини катіонів і аніонів, що утворюються у водному розчині внаслідок електролітичної дисоціації: а) натрій гідроксиду; б) ферум(ІІ) хлориду; в) ферум(ІІІ) сульфату — кількістю речовини 1 моль кожна.
Стисло про основне
Кислоти — це електроліти, що дисоціюють з утворенням катіонів одного виду — катіонів Гідрогену.
Основи — це електроліти, під час дисоціації яких утворюються аніони лише одного виду — гідроксид-аніони.
Солі — це електроліти, що дисоціюють з утворенням катіонів металічного елемента й аніонів кислотного залишку.
Спільні властивості речовин, які належать до одного класу, зумовлені наявністю в їхньому складі однакових йонів.
У лівій частині рівняння електролітичної дисоціації записують формулу речовини, а в правій — йони, на які вона дисоціює.
У рівнянні електролітичної дисоціації речовин сума позитивних зарядів катіонів дорівнює сумі негативних зарядів аніонів.
Лабораторний дослід 1
Виявлення йонів Гідрогену та гідроксид-іонів у розчинах
Перелік обладнання та речовин укладіть самостійно.
 У порожню чисту пробірку налийте близько 2 мл хлоридної кислоти та випробуйте її індикатором (метиловим оранжевим, лакмусом або універсальним індикаторним папірцем). Як змінився колір індикатора?
У порожню чисту пробірку налийте близько 2 мл хлоридної кислоти та випробуйте її індикатором (метиловим оранжевим, лакмусом або універсальним індикаторним папірцем). Як змінився колір індикатора?
 В іншу порожню чисту пробірку налийте близько 2 мл іншої кислоти та випробуйте її тим самим індикатором. Як у цьому випадку змінився колір індикатора?
В іншу порожню чисту пробірку налийте близько 2 мл іншої кислоти та випробуйте її тим самим індикатором. Як у цьому випадку змінився колір індикатора?
59
Зробіть висновок про можливість: а) виявляти цим індикатором наявність кислоти в розчині; б) розпізнати цим індикатором дві різні кислоти.
 Налийте в порожню чисту пробірку близько 2 мл розчину натрій гідроксиду та випробуйте його одним з індикаторів (метиловим оранжевим, лакмусом, фенолфталеїном або універсальним індикаторним папірцем). Зафіксуйте зміну кольору.
Налийте в порожню чисту пробірку близько 2 мл розчину натрій гідроксиду та випробуйте його одним з індикаторів (метиловим оранжевим, лакмусом, фенолфталеїном або універсальним індикаторним папірцем). Зафіксуйте зміну кольору.
 Налийте в порожню чисту пробірку близько 2 мл розчину іншого лугу та випробуйте його тим самим індикатором. Чи відрізняється результат цього досліду від попереднього?
Налийте в порожню чисту пробірку близько 2 мл розчину іншого лугу та випробуйте його тим самим індикатором. Чи відрізняється результат цього досліду від попереднього?
Зробіть висновок: а) чи можна за допомогою індикатора розпізнати два різні луги; б) якими індикаторами можна виявити луги в розчині; в) які йони зумовлюють однакову дію кислот на індикатори; г) які йони зумовлюють однакову дію лугів на індикатори.
Сторінка ерудита
Катіон гідроксонію. У рівняннях електролітичної дисоціації кислот катіон Гідрогену спрощено записують H+, хоча в розчині йони Гідрогену гідратовані (зв’язані з однією молекулою H2О) й точніше було б писати H3О+. Цей йон називають катіоном гідроксонію.
Дисоціація кислих солей. Кислі солі (продукт неповного заміщення в молекулі кислоти атомів Гідрогену на катіони металічного елемента), на відміну від середніх солей, дисоціюють ступінчасто.
1 ступінь: КНSO3– = К+ + НSO3– 2 ступінь: НSO3– Н+ + SO32–
Н+ + SO32–
Пригадаймо номенклатуру кислих солей. Вона відрізняється від номенклатури середніх солей тим, що в назві вказується наявність Гідрогену в кислотному залишку. Наприклад, КНSO3 — калій гідроген сульфіт, КН2РО4 — калій дигідроген ортофосфат.
Основні солі (продукт неповного заміщення гідроксильних груп основи кислотним залишком) дисоціюють у розчині теж ступінчасто.
1 ступінь: Mg(OH)Cl– = Mg(OH)+ + Cl– 2 ступінь: Mg(OH)+ Mg2+ + ОН–
Mg2+ + ОН–
В обох випадках за першим ступенем кисла чи основна сіль дисоціюють повністю. Дисоціація за другим ступенем відбувається незначною мірою.
Знаємо, розуміємо
Назвіть йони, на які дисоціюють кислоти, основи, солі. Наведіть приклади.
 Які йони зумовлюють спільні властивості кислот, а які — лугів?
Які йони зумовлюють спільні властивості кислот, а які — лугів?
 Як змінюється колір індикаторів у розчинах кислот, а як — у розчинах лугів?
Як змінюється колір індикаторів у розчинах кислот, а як — у розчинах лугів?  Дайте визначення кислот, основ, солей з погляду електролітичної дисоціації.
Дайте визначення кислот, основ, солей з погляду електролітичної дисоціації.
60
