
Підручники з Хімії / Хімія 9 клас / Березан Хімія 9 клас. 2017
.pdf2.Обчисліть об’єм кисню, необхідний для спалювання 500 м3 етину (об’єми газів вимірювали за нормальних умов).
3.Обчисліть об’єм кисню, необхідний для спалювання 600 мл суміші пропану й азоту, якщо об’ємна частка пропану в ній становить 40 % (об’єми газів вимірювали за однакових умов).
4.Який об’єм етану може повністю згоріти в 1400 мл кисню (н. у.).
5.Обчисліть об’єм карбон(ІV) оксиду, який утворився внаслідок спалювання 4м3 сумішіетануйметану,уякійоб’ємигазіввідносятьсяяк1:3(об’ємиречовин вимірювали за нормальних умов).
6.Обчислітьоб’ємкисню,необхідний дляспалювання1200млсумішіетину
йетану,якщооб’ємначасткаетинувнійстановить20%(об’ємигазіввимірювали за однакових умов).
7.Унаслідок спалювання суміші, що містить однакові об’єми метану й етину, одержали 300 л карбон(ІV) оксиду. Який об’єм суміші використали? (об’єми газів вимірювали за однакових умов).
8*. Унаслідок спалювання суміші, що містить однакові об’єми азоту, етену і бутану, одержали 1200 м3 карбон(ІV) оксиду. Який об’єм суміші використали? (об’єми газів вимірювали за однакових умов).
9.Визначте об’єм хлору, що прореагував з воднем, якщо утворилось 8 м3 гідроген хлориду (усі вимірювання виконано за нормальних умов).
10.Чи вистачить 300 мл водню для реакції з 0,4 л хлору?
11.Чи вистачить 0,5 м3 кисню на повне згоряння 300 л метану?
12.Чи вистачить 6 л кисню на повне згоряння 6 л пропену? Цю реакцію описують рівнянням:
2С3Н6 + 9О2 → 6СО2 + 6Н2О
141

§ 29. Поняття про полімери на прикладі поліетилену
Ознайомившись із матеріалом параграфа, ви:
•дізнаєтесь, що таке полімери;
•з’ясуєте зміст реакції полімеризації, понять «мономер», «ступінь полімеризації», «мономерна ланка»;
•довідаєтесь про властивості поліетилену та його застосування.
Полімеризація етилену
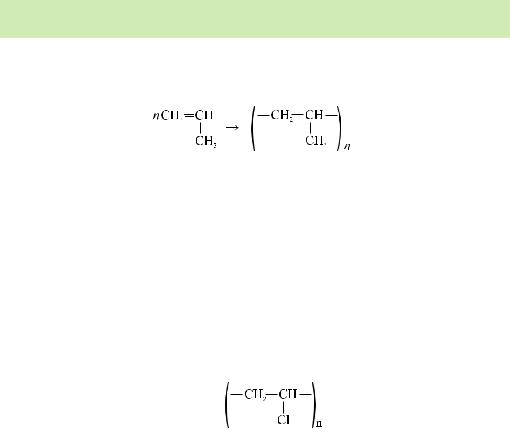
Молекули етилену С2Н4, як і молекули інших ненасичених вуглеводнів, що містять подвійний зв’язок, мають здатність сполучатися одна з одною. За певних умов одна ковалентна пара, що є між атомами Карбону в молекулі етену, може розриватися. За рахунок неспарених електронів утворені частинки сполучаються одна з одною (відбувається реакція полімеризації):
СН2=СН2 + ... + СН2=СН2 →
–СН2–СН2– + ...– + –СН2–СН2– →
СН2=СН–СН2– ... –СН2–СН=СН2
Речовину, яку використовують для проведення реакції полімеризації, називають мономером.
Так сполучаються сотні й тисячі молекул етилену. Утворену речовину (продукт реакції) називають полімером. Його відносна молекулярна маса може становити від 80 000 до 500 000. Скорочений запис реакції полімеризації етилену можна зобразити схемою:
nСН2=СН2 → (–СН2–СН2–)n
етилен поліетилен
Полімер — сполука, макромолекула якої складається з великої кількості однакових груп атомів (мономерних ланок).
Мономерналанка— це група атомів, яка повторюється n разів у молекулі полімеру.
Ступінь полімеризації (n) — це кількість мономерних ланок у молекулі полімеру.
142

Реакцію добування полімерів з ненасичених вуглеводнів, що супроводжується розривом кратних зв’язків, називають реакцією полімеризації.
Не всі макромолекули полімеру мають однакову довжину (і відповідно відносну молекулярну масу). Це залежить від значення n (ступеня полімеризації). Інтервал значень n залежить від умов здійснення реакції — температури, тиску, каталізатора:
|
кат., t°, Р |
|
nСН2=СН2 |
→ |
(–СН2–СН2–)n |
мономер |
|
полімер |
Отже, відносна молекулярна маса полімеру має значення:
Мr[(–СН2–СН2–)n] = n · Мr(СН2=СН2)
Зазвичай користуються значенням середньої відносної молекулярної маси.
Рис. 29.1. Поліетиленова плівка, гранули поліетилену
Властивості поліетилену
Поліетилен — безбарвна прозора або напівпрозора тверда речовина. Він легший за воду, жирний на дотик і зовні нагадує парафін. Під час нагрівання він розм’якшується і за температури 115–135 °С плавиться, утворюючи в’язку безбарвну рідину.
На поліетилен не діють вода, розчини кислот (за винятком концентрованої нітратної), а також розчини лугів, тобто поліетилен хімічно інертна речовина. Поліетилен за звичайних умов не розчиняється в органічних розчинниках. На повітрі горить кіптявим полум’ям. Поліетилен — нетоксична речовина.
143

Застосування поліетилену
Поліетилен через його властивості використовують дуже широко:
Рис. 29.2. Застосування поліетилену
Поліетилен також використовують як термоізолятор (пінополіетилен), конструкційнийматеріал(різноманітнідеталідлямеханізмівіприладів,корпусичовнів тощо). Порошковий поліетилен застосовують як термоклей.
Поліетиленова плівка дуже добре пропускає світло, а тому нею вкривають теплиці для вирощування овочів, квітів. Вироби з поліетилену є морозостійкими, однак не витримують температури понад 60 ºС.
Якщо вироби треба зробити кольоровими, додають барвники.
Демонстрація. Ознайомлення зі зразками виробів з поліетилену. Розгляньмо колекцію виробів з поліетилену.
Звернімо увагу, чи є на деяких виробах марковання («поліетилен низького тиску», «поліетилен високого тиску»).
144




 Для тих, хто хоче знати хімію глибше
Для тих, хто хоче знати хімію глибше
 Підсумки
Підсумки Контрольні запитання
Контрольні запитання Вправи та задачі
Вправи та задачі