
Підручники з Хімії / Хімія 9 клас / Березан Хімія 9 клас. 2017
.pdf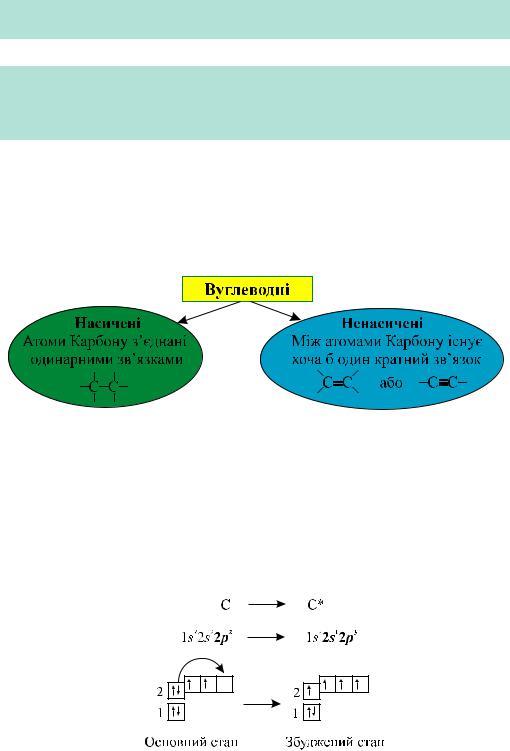
§ 24. Вуглеводні. Метан
Ознайомившись із матеріалом параграфа, ви:
•дізнаєтесь про хімічний склад вуглеводнів та їх класифікацію;
•з’ясуєте молекулярну, електронну та структурну формули метану;
•довідаєтесь про фізичні властивості метану й поширеність його в природі.
Вуглеводні
Термін «вуглеводні» походить від старих назв елементів: Карбон — «вуглець», а Гідроген — «водень». Отже, це сполуки Карбону з Гідрогеном.
Метан—найпростішийвуглеводень,молекулаякогоскладаєтьсязодногоато- ма Карбону і чотирьох атомів Гідрогену.
Вуглеводні поділяють на насичені та ненасичені.
Метан. Молекулярна і структурна формули метану
Метан СН4 — найпростіший насичений вуглеводень. Напишемо електронну формулу Карбону та її графічний варіант. Зауважмо, що в органічній хімії замість вислову «графічна формула» вживають термін «структурна формула».
В основному стані на зовнішньому енергетичному рівні атома Карбону розміщуються 4 електрони: два на s-орбіталі та два на р-орбіталі. Однак одна р-орбіталь залишається вакантною. Унаслідок збудження атома один електрон з s-орбіталі переходить на вакантну р-орбіталь:
121

Під час утворення молекули метану СН4 атом Карбону, перебуваючи у збудженому стані, використовує чотири неспарених електрони на утворення спільних ковалентних пар з чотирма атомами Гідрогену.
Рис. 24.1. Електронна та структурна формули метану
Пригадаймо, що в кулестержневій моделі кожен стержень — це одинарний зв’язок між атомами. Масштабна модель показує відношення розмірів атомів у молекулі. Якщо центри атомів у молекулі метану сполучити відрізками, то утвориться правильний чотиригранник — тетраедр. Тому кажуть, що молекула метану має форму тетраедра. У його центрі розміщується атом Карбону, а на чотирьох вершинах — атоми Гідрогену.
Поширеність у природі та фізичні властивості метану
У природі Землі метан доволі поширений. Він утворюється в процесі анаеробного розкладання органічних речовин, зокрема целюлози. Горючі природні гази зазвичай містять до 95 % метану. На дні боліт і ставків метан утворюється внаслідок розкладу решток рослин без доступу повітря. Тому його ще називають болотним газом. Також метан нагромаджується у вугільних, соляних шахтах унаслідок виділення із пластів вугілля і супутніх порід, де він міститься у вільному та зв’язаному стані. У цьому разі його називають рудниковим газом.
Метан — безбарвний газ без запаху й смаку, майже удвічі легший за повітря. У воді малорозчинний. На повітрі або в атмосфері кисню він горить неяскравим полум’ям. Його суміш з повітрям вибухонебезпечна. Метан за температури –162 ºС стає рідким, а за температури –182 ºС твердне.
Хімічні властивості метану
Заміщуючи в молекулах вуглеводнів один або кілька атомів Гідрогену на атомиіншихелементівчинацілігрупиатомів(реакціїзаміщення),отримуютьпохідні вуглеводнів.
Реакція метану з хлором (реакція хлорування) відбувається при освітленні:
122
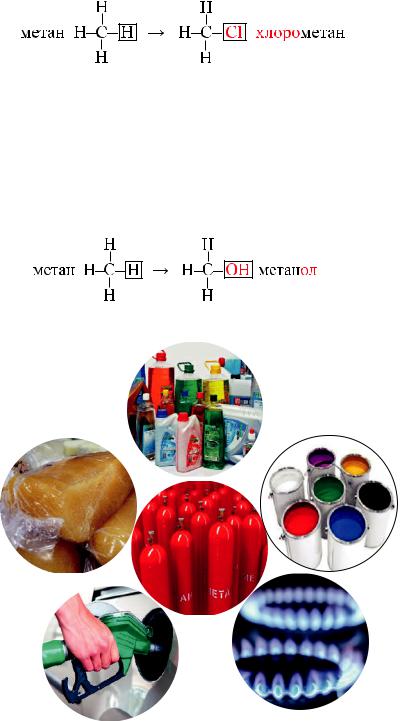
Взаємодіяметанузхлоромвідбуваєтьсявкількаетапів.Заумовдостатньоїкількості хлору відбувається послідовне заміщення атомів Гідрогену на атоми Хлору:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Якщо атом Гідрогену замістити на групу атомів –ОН, отримаємо метанол
(метиловий спирт):
Застосування метану |
|
Виробництво |
|
розчинників |
Виробництво |
|
|
Виробництво |
друкарських |
синтетичного каучуку |
фарб і сажі |
СН4
Виробництво
синтетичного
бензину
Паливо в побуті
Рис. 24.3. Застосування метану в господарській діяльності людини
123
Для тих, хто хоче знати хімію глибше
У2013 році вперше у світі успішно завершився експеримент — отримання природного газу (метану) з підводних покладів його гідратів. Видобуток проводили з дна Японського моря на горизонті 1300 м нижче рівня океану.
Усвіті виявлено понад 220 зон покладів гідратів метану на шельфах океанів таморів.Найчастішевонизалягаютьнаглибинах,детемператураневищаза+4°С
ітиск не менший за 2 мПа, що забезпечує термостатичну рівновагу цих покладів. Метангідратні пласти — це переважно осадові породи, що містять 70–80 % піску
іглини та 20–30 % льодоподібної маси гідратів. Найбільші з них — біля узбережжів Атлантичного й Тихого океанів. У морях гідратовмісна товща може сягати
кількасот метрів. Газові гідрати, наприклад СН4 · 6Н2О, за структурою нагадують пористий лід.
Чорне море також багате на поклади гідратів метану. Пошуково-розвіду- вальні експедиції ще в 1988–1989 роках виявили там на глибинах 300–1000 м метангідратні товщі під шаром донних відкладень. Загалом у його басейні залягає 45–75 трлн м3 прогнозованих ресурсів природного газу у вигляді газогідратів. До речі, вперше у світі 1972 року їх було добуто із дна саме Чорного моря. За попередніми оцінками, в українській економічній зоні Чорного моря запаси метану дорівнюють мінімум 1000-річнуму обсягу видобутку газу в сучасній Україні.
Підсумки
1.Вуглеводні — це сполуки Карбону з Гідрогеном.
2.Вуглеводні бувають насичені й ненасичені. Критерієм поділу слугує типу хімічного зв’язку між атомами Карбону.
3.Метан — найпростіший насичений вуглеводень.
 Контрольні запитання
Контрольні запитання
1.Скільки ковалентних зв’язків є в молекулі метану?
2.Яка просторова будова молекули метану?
3.Де метан трапляється в природі?
4.Опишіть фізичні властивості метану.
5.Чому органічну хімію можна назвати «хімією вуглеводнів та їх похідних»?
6.Напишіть молекулярну, електронну та структурну формули метану.
124

7.Чим відрізняються насичені та ненасичені вуглеводні? До якої їх групи належить метан?
8.У молекулі метану замініть атом Гідрогену на атом Брому. Запишіть молекулярну та структурну формули утвореної речовини.
 Вправи та задачі
Вправи та задачі
1.Обчисліть відносну густину метану за воднем.
2.Обчисліть масу 0,75 моль метану.
3.Обчисліть об’єм 30 г метану (н. у.).
4.Обчисліть об’єм кисню (н. у.), необхідний для спалювання 0,32 кг метану (продуктами згоряння якого є карбон(ІV) оксид і вода).
5.Обчисліть молярну масу дихлоропохідної метану.
6.Обчисліть масову частку Хлору в молекули тетрахлорометану ССl4.
7.Обчисліть масу суміші, яка містить 33,6 л метану і 44,8 л азоту.
8.Обчисліть об’єм (н. у.) 0,8 моль метану.
9.Обчисліть масу суміші, що містить 0,2 моль метану і 0,4 моль карбон(ІV) оксиду.
10.Обчисліть масову частку Гідрогену в метані.
11.Обчисліть об’єм (н. у) метану (л) масою 0,8 кг.
12.Обчисліть об’єм хлору (н. у.), що прореагує з 320 г метану згідно з реакцією, хімічне рівняння якої:
CH4 + Cl2 → CH3Cl + HCl
13. Обчисліть масу органічного продукту реакції, що утвориться під час взаємодії 1,5 моль метану з хлором згідно реакції, хімічне рівняння якої:
СН4 + 2Cl2 → СН2Cl2 + 2НCl
125

§ 25. Гомологи метану (алкани)
Ознайомившись із матеріалом параграфа, ви:
•засвоїте поняття «гомологічний ряд», «гомологи», «гомологічна різниця»;
•дізнаєтесь, як складати формули гомологів метану, як називати алкани;
•з’ясуєте закономірності зміни фізичних властивостей алканів залежно від їх складу.
Гомологи метану
Є речовини, подібні до метану за хімічним складом, внутрішньою будовою та властивостями. Наприклад, етан С2Н6, пропан С3Н8, бутан С4Н10 і т. д. Якщо уважно розглянути їх формули, неважко помітити закономірність: молекула кожної наступної речовини містить на один атом Карбону та на два атоми Гідрогену більше,ніжмолекулапопередньої.Інакшекажучи,вонирізнятьсянагрупуатомів СН2. Про такі речовини кажуть, що вони утворюють гомологічний ряд.
Гомологічний ряд — це ряд однотипних сполук, молекули яких мають подібну будову і різняться за складом на одну або кілька груп атомів СН2.
Гомологи — це окремі члени гомологічного ряду. Вони подібні за хімічним складом, структурою та властивостями.
Групу СН2 називають гомологічною різницею.
Метан і його гомологи утворюють гомологічний ряд алканів, або насичених вуглеводнів із загальною формулою СnH2n + 2.
Слово насичені означає, що усі зв’язки між атомами Карбону в їх молекулах одинарні прості1, а решта максимально «насичені» атомами Гідрогену. Іноді гомологічний ряд речовин називають за його першим членом, наприклад: гомо-
логічний ряд метану.
Щоб написати структурну формулу етану, з’єднаємо два атоми Карбону простим ковалентним зв’язком (позначимо його рискою):
С— С
Укожного атома Карбону залишилось по три вільних зв’язки, також позначємо їх рисками:
1Зрозуміло, що це не стосується першого члену гомологічного ряду — метану, молекула якого містить лише один атом Карбону.
126
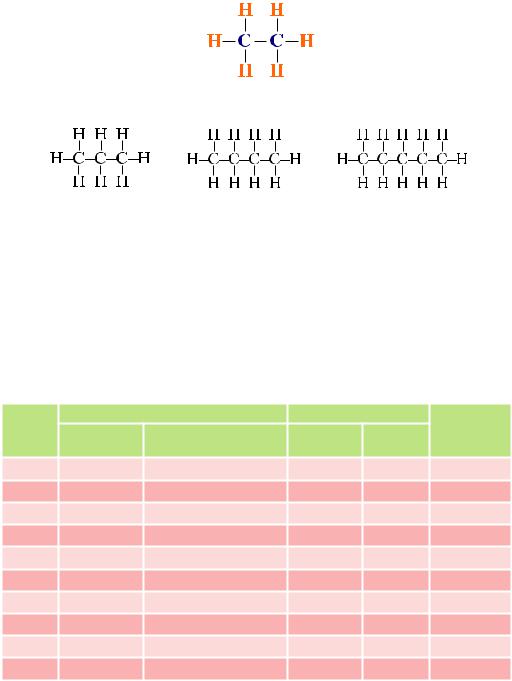
Щобдописатиформулу,докожноїрискидоставляємосимволатомаГідрогену:
Аналогічно складемо структурні формули наступних гомологів метану:
Пропан Бутан Пентан
Доволі часто користуються скороченими структурними формулами: СН3– СН2– СН2– СН2– СН3 (пентан)
Гомологів метану є дуже багато. Назви перших десяти слід запам’ятати, щоб швидко орієнтуватись у номенклатурі органічних речовин. Перші чотири мають тривіальні назви, для утворення назв решти алканів використовують грецькі числівники. Наприклад, 11-й гомолог має назвуундекан, 12-й—додекан, 20-й—ейко- зан, 30-й — триаконтан. Алкан з найдовшим нерозгалуженим Карбоновим ланцюгом містить 390 атомів Карбону і носить назву нонаконтатриктан C390H782.
Табл. 25.1. Перші десять гомологів метану
Назва |
|
Формула |
Температура |
Агрегатний |
||
|
|
|
|
|
||
молекулярна |
скорочена структурна |
плавлення |
кипіння |
стан (н. у.) |
||
метан |
СН4 |
СН4 |
|
–182 ºC |
–162 ºC |
газ |
етан |
С2Н6 |
СН3 – СН3 |
–183 ºC |
–89 ºC |
газ |
|
пропан |
С3Н8 |
СН3 – СН2 – СН3 |
–187 ºC |
–42 ºC |
газ |
|
бутан |
С4Н10 |
СН3 – (СН2)2 – СН3 |
–138 ºC |
–0,5 ºC |
газ |
|
пентан |
С5Н12 |
СН3 – (СН2)3 – СН3 |
–130 ºC |
+36 ºC |
рідина |
|
гексан |
С6Н14 |
СН3 – (СН2)4 – СН3 |
–95 ºC |
+69 ºC |
рідина |
|
гептан |
С7Н16 |
СН3 – (СН2)5 – СН3 |
–91 ºC |
+98 ºC |
рідина |
|
октан |
С8Н18 |
СН3 |
– (СН2)6 – СН3 |
–57 ºC |
+126 ºC |
рідина |
нонан |
С9Н20 |
СН3 |
– (СН2)7 – СН3 |
–54 ºC |
+151 ºC |
рідина |
декан |
С10Н22 |
СН3 |
– (СН2)8 – СН3 |
–30 ºC |
+174 ºC |
рідина |
Перші чотири гомологи метану є газами, наступні 9 — рідинами. Алкани, що мають у ланцюгу 14 і більше атомів Карбону, — це тверді речовини (за н. у.).
127
Гомологи метану інакше називають насиченими вуглеводнями. Термін «насичені» тутозначає,щоречовинимістятьмаксимальноможливечислоатомівГідрогену, тобто усі вільні звязки атомів Карбону «насичені» атомами цього елементу.
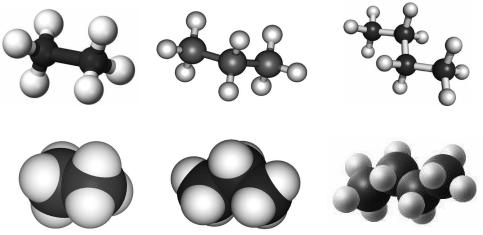
Розгляньмо кулестержневі та масштабні моделі трьох гомологів метану. Зверніть увагу на зигзагоподібну форму карбонового ланцюга в молекулах
пропану й бутану. Зигзагоподібний ланцюг карбонових атомів може набувати різних просторових форм. Це зумовлено тим, що атоми в молекулах гомологів метану можуть вільно обертатися навколо осей хімічних зв’язків С–Н і С–С.
етан |
пропан |
бутан |
а
б
Рис. 25.1. Кулестержневі (а) та масштабні (б) моделі гомологів метану
Користуючись загальною формулою алканів СnH2n+2, можна визначити кількість атомів Карбону й Гідрогену в молекулі будь-якого насиченого вуглеводня за умови, що відома відносна молекулярна чи молярна маса сполуки.
Задача. Молярна маса алкану дорівнює 72 г/моль. Визначте його формулу.
Дано: |
|
Розв’язання |
|
||
М(СnH2n+2) = 72 г/моль |
|
М(С) = 12 г/моль, М(Н) = 1 г/моль. |
|
|
Підставимо ці числа в загальну формулу алкану: |
СnH2n+2 — ? |
|
|
|
12 · n + 1(2n + 2) = 72 |
n = 5
Отже, формула буде С5Н12.
Відповідь: формула вуглеводню — С5Н12.
128

 Підсумки
Підсумки
1.Вуглеводні, які відповідають загальній формулі СnH2n+2 і карбонові ланцюги яких є незамкнені, називають алканами, або насиченими вуглеводнями.
2.Гомологічним рядом називають ряд сполук, молекули яких подібні за будовою і різняться за складом на одну або кілька груп СH2.
3.Групу атомів СH2 називають гомологічною різницею.
4.Гомологи — це окремі члени гомологічного ряду.
 Контрольні запитання
Контрольні запитання
1.Назвіть перші десять гомологів метану.
2.Чому всі гомологи метану є насиченими вуглеводнями?
3.Що таке гомологічний ряд? Що таке гомологічна різниця?
4.Чим відрізняються скорочені й повні структурні формули алканів?
5.Складіть молекулярні та структурні формули пентану, гептану і нонану.
6.Поясніть на прикладах, як і чому змінюються фізичні властивості гомологів метану зі зростанням кількості атомів Карбону в їх молекулах.
7.Розгляньте таблицю «Перші десять гомологів метану». Чи закономірно змінюються температури плавлення і кипіння в гомологічному ряду метану?
 Вправи та задачі
Вправи та задачі
1.Першим твердим гомологом метану (за н. у.) є алкан, молекула якого містить 17 атомів Карбону. Обчисліть масу 0,1 моль цього алкану.
2.Обчисліть масу карбон(ІV) оксиду, яка виділиться під час згоряння 75 г етану, що описують рівнянням:
2С2Н6(г) + 7О2(г) → 4СО2(г) + 6Н2О(г)
3.Обчисліть відносну густину бутану за повітрям.
4.Установіть формулу алкану, молярна маса якого становить 100г/моль.
5.Перетворіть схеми реакцій на рівняння. Укажіть тип реакції:
|
t° |
t° |
в) СН4 |
+ Cl2 → СН3Cl + НCl |
6. |
а) СН4 → |
С + Н2↑ б)СН4 → С2Н2 + Н2 |
||
Обчисліть відносну густину пропану за киснем. |
|
|||
7. |
Суміш алканів містить 0,3 моль метану, 0,4 моль етану і 0,3 моль пропану. |
|||
Обчисліть її масу й об’єм (н. у.).
8. Обчисліть об’єм суміші (л), яку приготували із 15 г етану, 1120 мл метану і 0,01 моль пропану (н. у.).
9*. Масова частка Хлору в дихлоропохідній алкану, формула якої СnH2nCl2, становить 62,83 %. Визначте формулу цього алкану.
129
§ 26. Етен і етин
Ознайомившись із матеріалом параграфа, ви:
•з’ясуєте склад і будову молекул етену й етину;
•дізнаєтесь про фізичні властивості етену й етину;
•довідаєтесь про сфери застосування етену й етину.
Етен і етин є найпростішими представниками ненасичених вуглеводнів. У їх молекулах два атоми Карбону сполучені між собою не одинарним, а кратним (подвійним і потрійним) зв’язком.
Етен
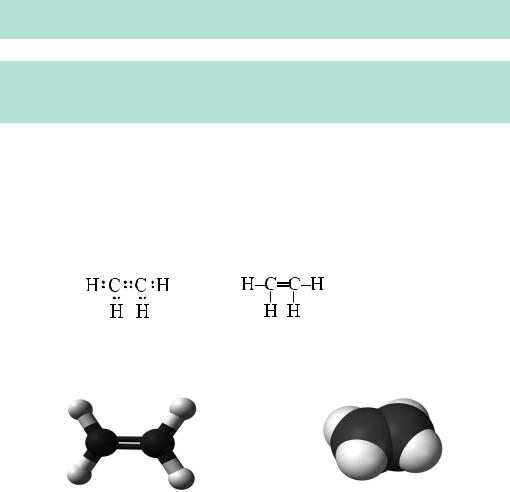
Етен — найпростіший вуглеводень з подвійним зв’язком. Інша (тривіальна) назва етену —етилен. Його хімічна формула — С2Н4. Його назва відрізняється від назви насиченого вуглеводню етану (С2Н6) суфіксом -ен. Розгляньмо електронну, повну структурну й скорочену структурну формули етену:
СН2=СН2
Зверніть увагу на валентність Карбону — вона дорівнює ІV. Просторове розміщення атомів у молекулі етену можна відобразити за допомогою кулестержневої (а) або масштабної (б) моделі цієї сполуки:
а |
б |
Рис. 26.1. Кулестержнева (а) та масштабна (б) моделі етену
Учені дослідили, що всі атоми в молекулі етену розміщуються в одній площині, а кути між лініями, що з’єднують центри сусідніх атомів Гідрогену і Карбону, становлять 120º.
Властивості етену
Етен за фізичними властивостями подібний до метану: безбарвний газ (за н. у.), молярна маса якого дорівнює 28 г/моль; погано розчиняється у воді, але добре в органічних розчинниках, наприклад, спиртах; має слабку наркотичну дію. Підчасохолодженнядо–104ºС(занормальноготиску)перетворюєтьсянарідину.
У першій половині минулого століття було відкрито, що рослини виділяють нелишекисеньівуглекислийгаз,айетен(рослинний гормон).Особливовперіод дозрівання плодів. Наприклад, 1 кг ще зелених яблук виробляють приблизно 150 см3 етену на добу, а 1 кг стиглих — лише 10 см3 цього газу.
130
