
Підручники з Хімії / Хімія 9 клас / Гранкіна Хімія 9 клас. 2017
.pdf

Початкові поняття про органічні сполуки 223
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Під час виконання дослідів дотримуйтеся правил безпеки! Просимо допомоги батьків!
Розпізнаємо розчини кухонної солі, питної соди й оцту
Перед виконанням досліду попросіть батьків або друзів приготувати в підписаних одноразових стаканчиках № 1, 2, 3 розчини кухонної солі, питної соди й оцту.
Запропонуйте хід експерименту й розпізнайте ці розчини. Правильність розпізнавання нехай оцінять ваші помічники.
Підсумок:
Карбоксильна |
ЕТАНОВА КИСЛОТА |
характерні |
||
СН3СООН |
||||
група |
|
|||
|
для |
|||
|
|
|
||
O |
|
|
органічних |
|
|
|
кислот |
||
– С |
|
Хімічні властивості |
||
O – Н |
|
|
||
|
|
Спільні з неорганічними кислотами |
||
з металами |
з оксидами |
зміна забарвлен- |
||
металічних з основами із солями |
||||
ня індикатора |
||||
|
елементів |
|||
|
|
|||
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
372.Які речовини називають карбоновими кислотами?
373.Опишіть фізичні властивості етанової кислоти.
374.Як змінює забарвлення індикаторів водний розчин етанової кислоти? Чому?
375.Розкажіть, які властивості етанової кислоти є спільними з неорганічними кислотами.
376.Де застосовують оцтову кислоту?
377.Який розчин має назву «оцтова есенція»?
378.Яка кислота має наву «крижана» і чому?

224 Тема 4
ВИКОНАЙТЕ ЗАВДАННЯ
379.Напишіть рівняння реакції горіння етанової кислоти в надлишку кисню з урахуванням того, що в результаті реакції утворюються вуглекислий газ і вода. Складіть рівняння реакцій оцтової кислоти з такими речовинами:
а) калієм; б) кальцієм;
в) купрум(ІІ) оксидом; г) кальцій карбонатом; д) калій гідроксидом.
380.Чому оцтова кислота реагує з кальцій карбонатом, а з кальцій сульфатом — ні?
381.Визначте масову частку Оксигену в етановій кислоті.
382.Унаслідок взаємодії етанової кислоти з магнієм виділилося 11,2 л газу (н. у.). Визначте масу кислоти, що прореагувала.
383.Визначте масу етанової кислоти, що міститься у 500 г столового оцту з масовою часткою кислоти 9 %.
384.Потрібно видалити накип у чайнику. Маса накипу — 50 г. Визначте масу столового оцту з масовою часткою кислоти 9 %, необхідної для цього. Вважайте, що в накипі міститься тільки кальцій карбонат.
385.У пробірках без підписів містяться речовини: гліцерол, етанол і етанова кислота. Як з допомогою хімічних реактивів визначити їх?
386.Яка маса крейди з масовою часткою СаСО3 96 % необхідна для нейтралізації оцтової кислоти масою 60 г?
Для допитливих
387.У чому особливості будови насичених одноосновних карбонових кислот?
388.Як утворюються назви карбонових кислот?
389.На нейтралізацію 1,2 г одноосновної карбонової кислоти витратили розчин натрій гідроксиду масою 20 г з масовою часткою NaОН 4 %. Визначте молярну масу кислоти.
390.Визначте молекулярну формулу речовини, яка складається з 54,4 % Карбону, 36,4 % Оксигену й 9,1 % Гідрогену. Густина за воднем цієї речовини дорівнює 44.
391.Скільки молекул оцтової кислоти міститься у 200 г столового оцту з масовою часткою етанової кислоти 9 %?

Початкові поняття про органічні сполуки 225
392.Потрібно з оцтової есенції отримати столовий оцет. Масова частка етанової кислоти в есенції дорівнює 80 %. Розрахуйте масу води, яку при цьому слід додати до 100 г есенції.
393.До оцтової есенції масою 250 г з масовою часткою етанової кислоти 80 % додали 300 г води. Обчисліть масову частку кислоти
вотриманому розчині.
394.«Кислота і молодість»
Деяка одноосновна карбонова кислота використовується людством ще з античних часів. Здавна її добували зі скислого вина. Якщо дослівно перекласти назву цієї кислоти з грецької, отримаємо слово «кислий».
Пізніше цю кислоту навчилися синтезувати за допомогою сухої перегонки деревини. Цариця Єгипту Клеопатра розчиняла
вцій кислоті перлини. Цариця вірила, що цей напій зберігає
молодість і красу.
Під час взаємодії 30 мл розчину цієї кислоти (ω = 38,8 %, ρ = 1,03 г/мл) з надлишком калій гідрогенкарбонату виділило-
ся 4,48 л газу. Визначте будову кислоти. Який «коктейль» пила Клеопатра?
Напишіть рівняння реакції взаємодії основної складової перлів з цією кислотою.
 § 28. ПОНЯТТЯ ПРО ВИЩІ КАРБОНОВІ КИСЛОТИ. ЖИРИ
§ 28. ПОНЯТТЯ ПРО ВИЩІ КАРБОНОВІ КИСЛОТИ. ЖИРИ
— Органічна хімія вивчає речовини, з яких складаються живі організми. Правильно?
— Так.
— Але ж ми не складаємося з алканів, алкенів і етанової кислоти. Ми складаємося з білків, жирів, вуглеводів і багато іншого.
— От зараз ми будемо вивчати жири. Це необхідний компонент усіх живих організмів.

226 Тема 4
СКЛАД І БУДОВА ЖИРІВ
Жири — це складні органічні речовини, до складу яких входять залишки вищих одноосновних карбонових кислот і гліцеролу.
Зі спиртом гліцеролом ми вже ознайомилися, що таке карбонові кислоти теж знаємо. Що ж таке вищі карбонові кислоти?
Вищими кислотами називають карбонові кислоти, до складу яких входить більше 10 атомів Карбону.
Основні вищі кислоти, що входять до складу жирів
1)Насичені:
пальмітинова кислота C15H31COOH;
стеаринова кислота C17H35COOH.
2)Ненасичені з одним подвійним зв’язком:
олеїнова кислота C17H33COOH.
3)Ненасичені з двома подвійними зв’язками:
лінолева кислота C17H31COOH.
Називають жири виходячи з назв карбонових кислот, які їх утворюють: тристеарат (входять три залишки молекули стеаринової кислоти), триолеат (входять три залишки молекули олеїнової кислоти). До складу жиру часто входять залишки молекул різних кислот. Загальна назва — тригліцериди.
Формули жирів великі й складні, ви будете вивчати у старших класах, як їх складати. Зараз просто наведемо формулу жиру тристеарату:
 O
O
CH2 – O – С
C17 H35
O
CH – O – С
C17 H35
O
CH2 – O – С
C17 H35
Тристеарат

228 Тема 4
Дослід «Розчинність жирів у різних розчинниках»
Невеликі кількості жиру помістіть у пробірки з водою, етиловим спиртом і бензином (або іншим органічним розчинником). Збовтайте. Зробіть висновок про розчинність жирів.
ХІМІЧНІ ВЛАСТИВОСТІ
1.Жири горять з утворенням вуглекислого газу й води (у достатній кількості кисню). Це екзотермічна реакція.
2.Рідкі жири можна перетворити на тверді. Як? Так само, як і ненасичені вуглеводні можна перетворити на насичені — приєднати водень. Оскільки до складу рідких жирів входять залишки ненасичених карбонових кислот, вони здатні приєднувати молекули водню. Таким чином рідкі жири перетворюють на тверді. Цей процес застосовують для одержання комбінованих жирів і маргаринів.
3.Під час кип’ятіння жирів з лугами утворюються солі карбонових кислот і гліцерол.
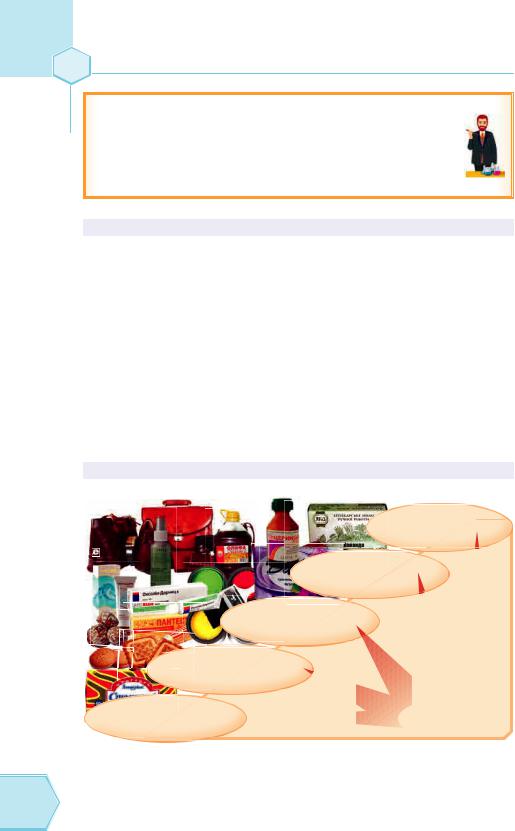
ЗАСТОСУВАННЯ ЖИРІВ
Виробництво мила й гліцеролу
Шкіряне
виробництво
Виробництво фарб, лаків, оліфи
Косметологія,
медицина
Харчова |
ЖИРИ |
|
промисловість |
||
|
||
Рис. 79. Сфери застосування жирів |
|
|
|
|
|
|
|
Початкові поняття про органічні сполуки 229
БІОЛОГІЧНА РОЛЬ ЖИРІВ
Жири дуже поширені в природі. Поряд із вуглеводами й білками вони входять до складу всіх рослинних і тваринних організмів
істановлять одну з основних частин нашої їжі.
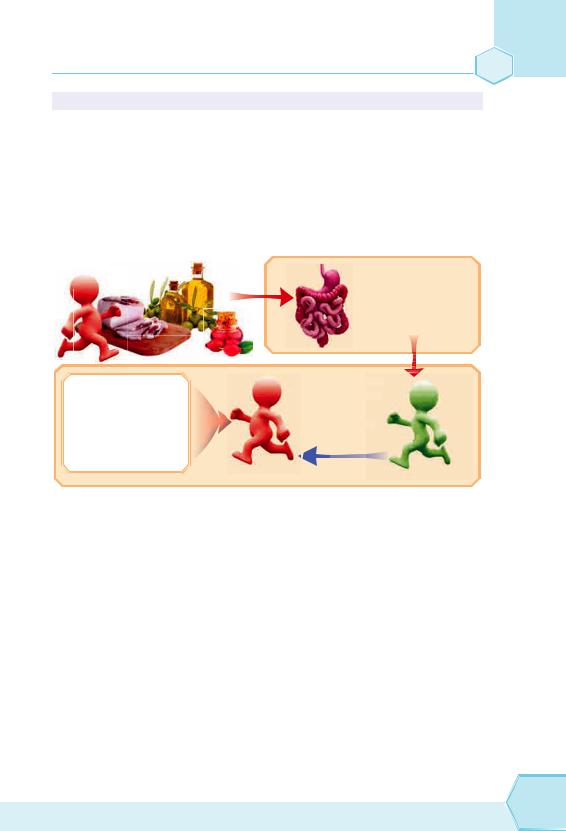
Ворганізмі жири, які входять до складу їжі, під впливом ферментів підшлункового і кишкового соку перетворюються на гліцерол і карбонові кислоти — всмоктуються в кишечнику й знову утворюють жир, необхідний для організму.
під впливом ферментів підшлункового і кишкового соку розкладаються
|
всмоктуються |
Жири є джерелом |
в кишечнику |
енергії для живих |
й знову |
організмів, тому |
утворюють |
вони відкладаються |
жир |
про запас |
|
Будучи гарним теплоізолятором, жири у складі підшкірної жирової клітковини підтримують нормальну температуру тіла шляхом зменшення втрати тепла організмом і є амортизатором у разі механічних впливів. У разі виснаження людське тіло дуже швидко втрачає тепло. Це особливо небезпечно для дітей.
Жири оточують внутрішні органи: серце, печінку, нирки і т. д. і є ніби «подушками» для їх м’якої фіксації. У разі виснаження деякі органи змінюють своє положення, що призводить до різних патологічних ситуацій.
Жири входять до складу мембран клітин. Вони беруть участь у підтримці форми клітини й регулюють проникнення в клітину й виведення з неї різних речовин.
Жири необхідні для вироблення багатьох гормонів та інших біологічно активних сполук, які регулюють усі процеси життєдіяльності.


 →
→  O
O