
Підручники з Хімії / Хімія 9 клас / Гранкіна Хімія 9 клас. 2017
.pdf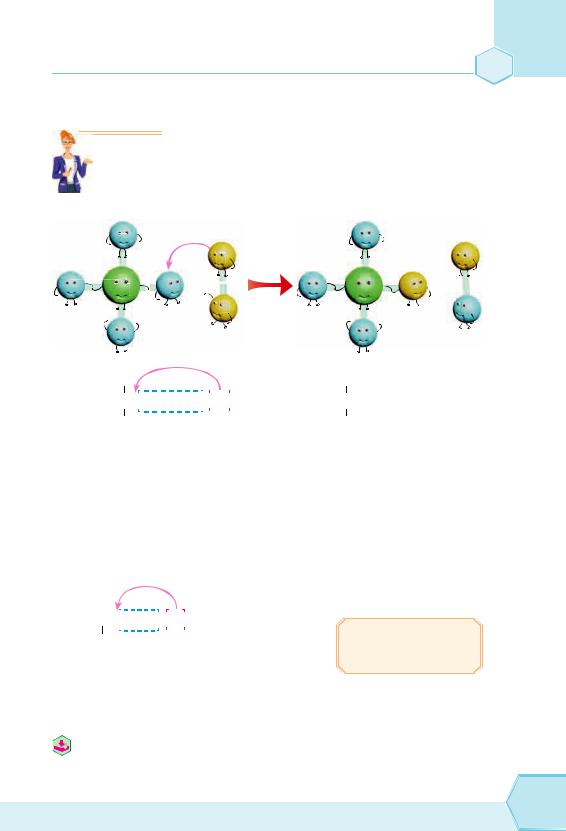
Початкові поняття про органічні сполуки 171
2.Метан вступає в реакції з галогенами
Це реакція заміщення.
Для алканів характерні реакції заміщення (рис. 57). Якщо суміш метану й хлору виставити на розсіяне світло (обережно, на яскравому світлі вибухне!), то можна помітити, що під час реакції жовто-зелене забарвлення хлору поступово зникає.
H
H C
 Cl
Cl
H 
Cl
H
H C
 Cl
Cl
Cl
 Н
Н
H H
H |
|
|
|
|
|
|
|
|
H |
||
H − C − |
|
|
+ Cl |
|
− |
|
|
|
|
|
→ H − C − Cl + HCl |
|
H |
|
|
Cl |
|
||||||
|
|
|
|
||||||||
H |
|
|
|
|
|
|
|
|
H |
||
|
|
|
Рис. 57. Реакція заміщення |
||||||||
Рівняння цієї реакції можна записати так: CH4 + Cl2 → CH3Cl + HCl
Сполука CH3Cl має назву хлорометан. Частина слова «метан» буде в назві завжди, якщо до складу органічної речовини входить 1 атом Карбону.
Як правило, реакція відбувається далі:
|
Н |
|
|
|
|
|
|
|
|
|
|
Cl |
|
Cl − C − |
|
H + Cl |
|
− |
|
|
|
|
|
→ H − C − Cl + HCl |
|
||
|
|
|
Cl |
|
Префікс ди- означає |
||||||||
|
|
|
|
||||||||||
|
H |
|
|
|
|
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
дихлорометан |
«два». |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Можна записати так:
CH3Cl + Cl2 → CH2Cl2 + HCl
Органічні речовини, в яких один або декілька атомів Гідрогену заміщені на Хлор, називають хлоропохідними.

172 Тема 4 |
|
|
|
|
|
|
|
|
|||
|
Можна хлорувати далі. |
|
|
|
|
|
|
|
|
||
|
Третя стадія: |
|
|
|
|
|
|
|
|
||
|
Cl |
|
|
|
|
|
|
|
Cl |
||
|
Cl − C − |
|
H + Cl |
|
− |
|
|
|
|
|
→ H − C − Cl + HCl |
|
|
|
|
Cl |
|
||||||
|
|
|
|
|
|||||||
|
Н |
|
|
|
|
|
|
|
Cl |
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
трихлорометан |
CH2Cl2 + Cl2 → CHCl3 + HCl
Четверта стадія:
|
Cl |
|
|
|
|
|
|
|
|
|
Cl |
Cl − C − |
|
H + Cl |
|
− |
|
|
|
|
|
→ Cl − C − Cl + HCl |
|
|
|
|
Cl |
|
|||||||
|
|
|
|
||||||||
|
Cl |
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
тетрахлорометан |
CHCl3 + Cl2 → CCl4 + HCl
Усі ці реакції відбуваються послідовно, але вони не завжди йдуть до кінця, тому під час хлорування метану може утворюватися суміш хлоропохідних.
— В органічній хімії взаємодію між речовинами часто записують у вигляді схем, де вказують тільки реагенти і продукти реакції, пропускаючи проміжні речовини.
У схемах записують стрілку, а не знак «дорівнює». Для проведення розрахунків їх теж необхідно зрівнювати.
У реакціях заміщення в органічній хімії атом одного елемента в молекулі заміщається на атом іншого елемента. При цьому, на відміну від таких реакцій у неорганічній хімії, реагенти й продукти — складні речовини.
Дізнайтеся більше
Під час нагрівання без доступу повітря метан розкладається: CH4 → C + 2H2↑
Цю реакцію використовують для одержання порошку сажі (C) і водню. Ці продукти широко використовуються в органічних

Початкові поняття про органічні сполуки 173
синтезах. Метан — основна частина природного газу. Тому його в промисловості не одержують, а в разі необхідності виділяють у чистому вигляді з природного газу. Можна його одержувати прямим синтезом із вуглецю й водню за високих температур і без доступу повітря.
ЗАСТОСУВАННЯ МЕТАНУ ТА ЙОГО ПОХІДНИХ
Для гасіння пожеж та для наркозу
Розчинники
Як холодоагент
ухолодильних
установках
Виробництво амоніаку та гідрування жирів
Виробництво фарб і гуми МЕТАН ТА
ЙОГО ПОХІДНІ
Рис. 58. Сфери застосування метану та його похідних
Сажу, одержувану під час термічного розкладу метану, використовують в основному у виробництві фарб і гуми як чорний пігмент та наповнювач для пластмас; водень — у виробництві амоніаку, для гідрування жирів, в органічних синтезах.
Хлорметан — газ, який легко переходить у рідину, тому його використовують як холодоагент у холодильних установках, дихлорметан, трихлорметан і тетрахлорметан — розчинники. CHCl3 називається ще хлороформ. Його використовують як наркоз. CCl4 також застосовують для гасіння вогню, особливо тоді, коли не можна використовувати воду. Важкі негорючі випари цієї речовини не дають кисню повітря контактувати з палаючою речовиною. Хлоропохідні метану — одні з нечисленних органічних сполук, які не горять.
174 Тема 4
Дізнайтеся більше
За результатами космічних досліджень, газ метан міститься
ватмосфері Сатурна і Юпітера. Також припускають, що у твердому стані він може бути виявлений на Урані та Нептуні.
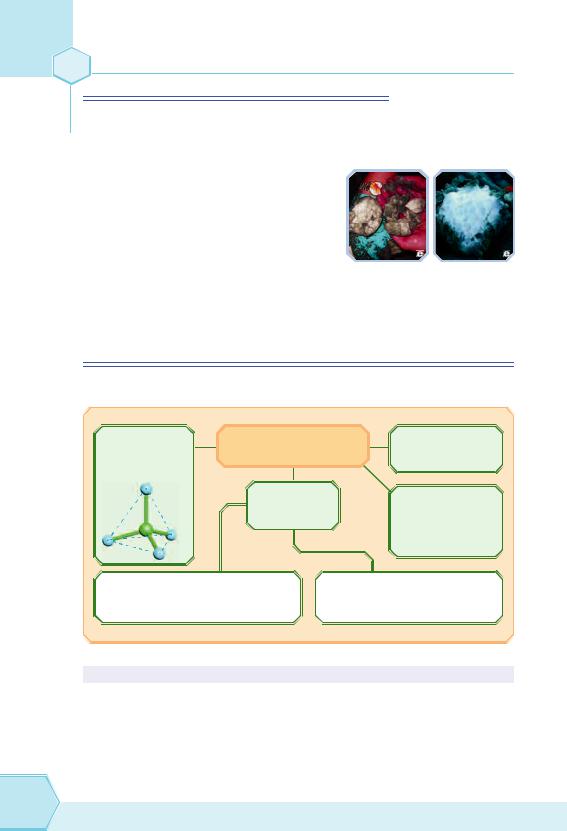
На дні Світового океану є великі запаси метану у вигляді пластівців,
що нагадують сніг. Ці пластівці — газові гідрати CH4 6H2O, які мають кристалічну ґратку льоду, де
впорожнинах розташовані молеку-
ли метану (рис. 59). Під час горіння |
Рис. 59. Газові гідрати |
такої сполуки здається, що горить |
|
сніг, а після згоряння залишається калюжка води. Запаси газових гідратів у десятки разів більше, ніж запаси вугілля, нафти, торфу, і становлять приблизно 2 1016 м3.
Підсумуємо вивчене в параграфі:
Тетраедрична |
|
МЕТАН |
Ковалентні |
|||
форма |
|
|
СН4 |
зв’язки |
||
молекули |
|
|
|
|
||
|
|
|
|
|
Хімічні |
Основна |
|
|
|
|
|
властивості |
|
|
|
|
|
|
складова |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
природного газу |
|
реакції горіння: |
реакції заміщення: |
||||
CH |
4 |
+ 2O |
2 |
→ CO |
+ 2H O; |
CH4 + Cl2 → CH3Cl + HCl |
|
|
2 |
2 |
|
||
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
277.Атоми яких елементів входять до складу сполук, що належать до вуглеводнів?
278.До якого класу органічних сполук належить метан?
279.Чому алкани називають іще насиченими вуглеводнями?

Початкові поняття про органічні сполуки 175
280.Скільки неспарених електронів у атомі Карбону в основному стані? у промотованому стані?
281.Форму якої геометричної фігури має молекула метану?
282.Назвіть фізичні властивості метану.
283.Чому метан називають «рудничним газом»? «болотним газом»?
284.Розкажіть про правила безпеки під час роботи з побутовими газовими приладами.
285.Який тип хімічної реакції характерний для метану?
ВИКОНАЙТЕ ЗАВДАННЯ
286.На зовнішньому боці дна чайника, який гріли на газовій плиті, утворився чорний наліт. Чому? Напишіть відповідне рівняння реакції. Що б ви порадили господарям для безпечного користування газовою плитою?
287.Визначте об’єм кисню, необхідний для спалювання 5 м3 метану (н. у.).
288.Визначте масові частки елементів у молекулі метану.
289.Запишіть рівняння реакції взаємодії 1 моль метану з 2 моль хлору; з 3 моль хлору. Як називаються продукти реакції? Де їх використовують?
290.Скільки молекул міститься у 2 л метану (н. у.)?
Для допитливих
291.Як дослідним шляхом можна відрізнити метан від водню? кисню?
292.Напишіть рівняння реакції взаємодії метану з бромом, знаючи, що реакції відбуваються подібно до реакцій із хлором.
293.Як ви вважаєте, чому тетрахлорометан не горить?
294.Як холодоагент у холодильних установках широко використовували дихлородифторометан, або фреон. Його особливістю є те, що він легко переходить у рідкий стан, а потім, випаровуючись, поглинає тепло, а в холодильнику при цьому стає холодно. Напишіть молекулярну й структурну формули цієї речовини.
295.Чи знаєте ви, що...
Метан у природі міститься в кишкових газах та крові жуйних тварин і людини... Він виділяється в результаті так званого «метанового бродіння» під час розкладання тваринних і рослинних решток на дні водойм без доступу повітря... Суміш

176 Тема 4
метану з повітрям називають іще рудничним газом. Він нако-
пичується у вугільних шахтах і може стати причиною вибуху...
У всьому світі люди навчилися у спеціальних установках без
доступу повітря з біомаси добувати біогаз (альтернатива при-
родному газу), що містить в основному цей газ...
Запитання
Умовно запишемо утворення метану під час розкладання органічних решток за допомогою реакції: C + 2H2 → CH4. Розрахуйте об’єм метану (за н.у.), який утвориться з 1 кг ву-
глецю.
У верхніх чи нижчих шарах повітря у шахтах більше накопичується метану? Поясніть свою відповідь.
 § 22. ГОМОЛОГИ МЕТАНУ, ЇХНІ ВЛАСТИВОСТІ. ОБ’ЄМНІ ВІДНОШЕННЯ ГАЗІВ
§ 22. ГОМОЛОГИ МЕТАНУ, ЇХНІ ВЛАСТИВОСТІ. ОБ’ЄМНІ ВІДНОШЕННЯ ГАЗІВ
Вуглеводні, схожі за будовою й властивостями на метан, об’єднують у гомологічний ряд «Алкани» або насичені вуглеводні. Чому тільки схожі? Всі алкани відрізняються один від одного кількістю атомів Карбону у вуглецевому лан-
цюжку, тому є певні відмінності. Змінюються фізичні властивості, наприклад температури кипіння й плавлення.
ЯК СКЛАСТИ ФОРМУЛИ АЛКАНІВ?
Для того щоби навчитися складати формули алканів, треба пам’ятати таке:
Карбон в органічних сполуках чотиривалентний;
до складу молекули вуглеводнів входять атоми Карбону й Гідрогену;
до складу кожного наступного в ряді алкану додається 1 атом Карбону та два атоми Гідрогену.
Пробуємо. Першим у ряді, звичайно, є метан. Його формулу ми вже знаємо. Наступний представник буде мати в складі на 1 атом Карбону більше, ніж у метану, тобто 2.
Початкові поняття про органічні сполуки 177
Запишемо:
С – С |
Якщо між атомами Карбону |
|
Зв’язки між атомами С ординар- |
один зв’язок, то говорять, |
|
що це молекули з простими, |
||
ні, як і в усіх алканів. |
||
ординарними зв’язками (від |
||
Укажемо неспарені електрони |
||
французького ordіnaіre — |
||
в кожного Карбону таким чином, |
«звичайний»). Часто слово |
|
щоби він був чотиривалентний: |
«ординарні» замінюють сло- |
|
|
вом «одинарні». |
– С – С – |
|
|
Оскільки в складі речовини є ато- |
Н |
Н |
ми Гідрогену, допишемо їх, пам’ятаючи |
Н |
|
про те, що Гідроген одновалентний: |
|
|
|
С |
|
|
|
|
H H |
|
С |
Н – С – С – Н |
|
Н |
|
|
|
H H |
Н |
Н |
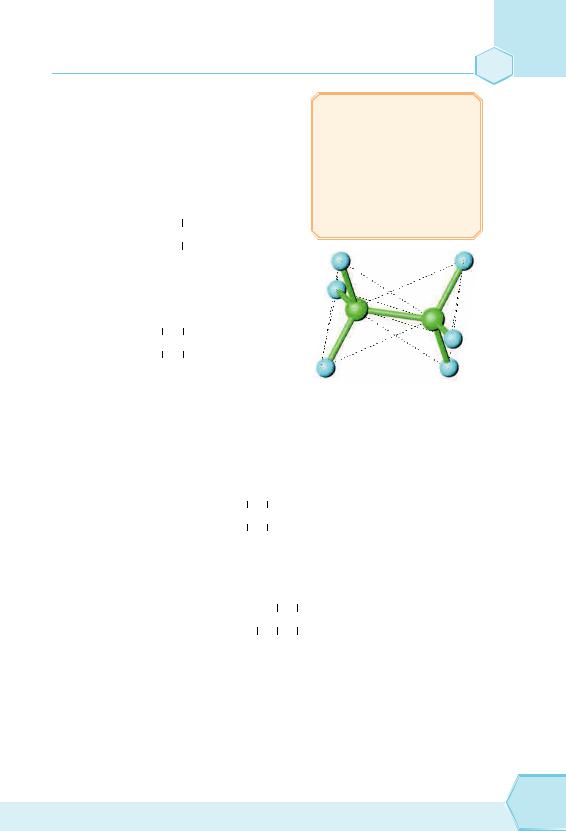
Структурна формула готова. |
|
Рис. 60. Етан |
Молекулярна формула: C2H6, назва — етан (рис. 60). Між атомами Гідрогену й Карбону ковалентні зв’язки.
Тепер у такому самому порядку складемо формулу наступного представника алканів. У нього вже 3 атоми Карбону. Дописуємо атоми Гідрогену й отримаємо формулу:
H H H
Н – С – С – С – Н H H H
Молекулярна формула: C3H8, назва — пропан.
Молекула наступного алкану має в складі 4 атоми Карбону: H H H H
Н–С–С–С–С–Н H H H H
Молекулярна формула: C4H10, назва — бутан. Спробуємо зробити деякі висновки:
1.Суфікс у назві всіх алканів збігається із суфіксом у назві гомологічного ряду -ан-.
2.Кількість атомів Гідрогену в кожного представника алканів удвічі більше, ніж атомів Карбону, й іще плюс 2 атоми Гідрогену.
178 Тема 4
H H H H
Н–С–С–С–С–Н H H H H
CnH2n + 2
Тому можна написати загальну формулу алканів: CnH2n+2
За нею, знаючи кількість атомів Карбону, можна легко розрахувати кількість атомів Гідрогену в молекулі речовини.
3.Кожний алкан відрізняється від попереднього й наступного на групу −CH2 −, яку називають гомологічною різницею.
H H |
H |
H H |
H |
H |
||
Н – С – С – С – Н |
Н–С–С–С–С–Н |
|||||
H H H |
H H H H |
|||||
|
|
|
|
|
|
|
Пропан |
Бутан |
|||||
Тепер можна дати визначення гомологам — речовинам, які входять в один гомологічний ряд:
Гомологи — це органічні речовини, які мають подібну будову й властивості, що становлять гомологічний ряд, структури яких відрізняються одна від одної на гомологічну різницю — групу −CH2 − .
Запишемо формулу наступного гомолога — пентану. Починаючи з нього назви алканів утворені від грецьких числівників: пента — п’ять, гекса — шість, гепта — сім і т. д. (див. с. 51).
Отже, у молекулі метану 5 атомів Карбону й 12 атомів Гідрогену — C5H12. Структурна формула:
H H H H H
Н – С – С – С – С – С – Н
H H H H H
Можна спростити запис і атоми Гідрогену писати поряд із атомами Карбону: СН3 – СН2 – СН2 – СН2 – СН3.

Початкові поняття про органічні сполуки 179
Можна навіть однакові групи атомів зібрати разом: СН3 – (СН2)3 – СН3
Завдання. Спробуйте далі написати формули алканів до десятого гомолога самі, а потім звірте з підручником.
Гексан C6H14
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Гептан C7H16
СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 Октан C8H18
СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 Нонан C9H20
СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 Декан C10H22
СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 Ми написали перші 10 представників гомологічного ряду ал-
канів. Назви представників інших гомологічних рядів і класів будують з урахуванням назв відповідних алканів. Тому, якщо ви вивчите назви сполук цього ряду, то потім легко зможете називати інші органічні сполуки.
Просторова будова алканів
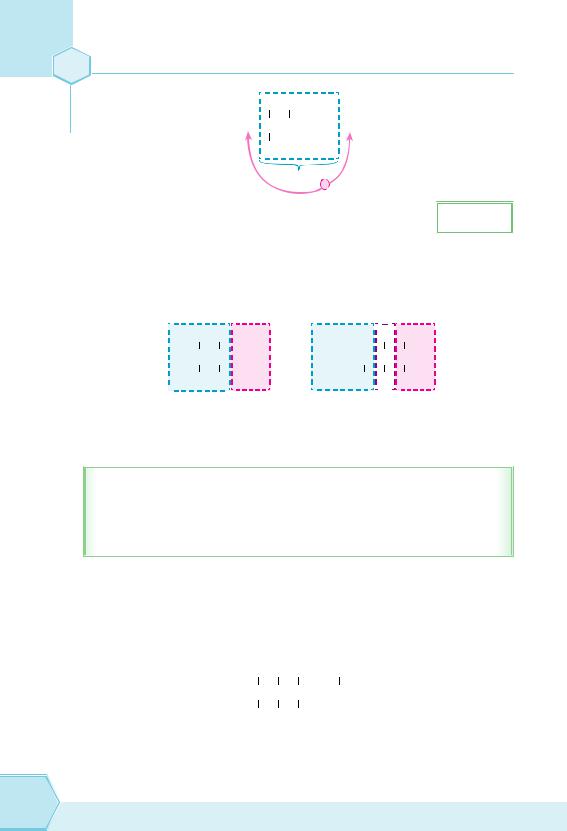
Ви пам’ятаєте, що молекула метану має тетраедричну форму. Тепер уявіть, що ми з’єднуємо тетраедри, утворюючи ланцюжки алканів. Подивимося на просторову модель молекули етану (рис. 60). Якщо в молекулі більш ніж 2 атоми Карбону, то що виходить? Правильно, вигнутий ланцюжок (рис. 61). При цьому можливе обертання фрагментів молекул навколо зв’язків С–С, що робить молекули вищих алканів з довгими ланцюжками гнучкими (рис. 62, 64).
Рис. 61. Пропан |
Рис. 62. Бутан |
|
|
|
|
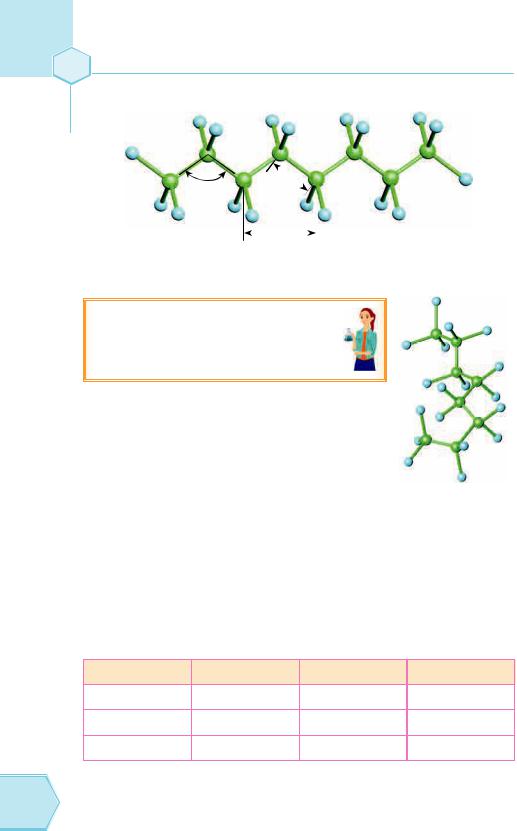
180 Тема 4
Тому структурні формули правильно було б писати так (рис. 63):
С 109°28′ С
С |
|
0,15 |
нм |
|
СС
СС
0,25 нм Рис. 63. Структура молекули вищих алканів
Але всі звикли писати ланцюжок рівно, тому так і пишуть.
Лабораторний дослід «Виготовлення моделей молекул алканів»
моделей молекул алканів»
Складіть куле-стрижневі моделі
молекул етану, пропану й бутану. |
|
Фізичні властивості алканів |
|
У звичайних умовах CH4 − C4H10 — гази. |
|
C5H12 − C15H32 — рідини. |
|
Починаючи із C16H34 — тверді речовини. |
|
Температури плавлення й кипіння ал- |
|
канів, їхні густини збільшуються в гомоло- |
Рис. 64. Ланки |
гічному ряді зі збільшенням молекулярної |
ланцюжка можуть |
маси. Всі алкани легше води, у ній не роз- |
крутитися в різних |
чинні (тому що їхні молекули малополярні |
напрямках |
|
й не взаємодіють із полярними молекулами води), однак розчинні в неполярних розчинниках (наприклад, у бензині) і самі є гарними розчинниками. Температури кипіння й плавлення деяких алканів представлено в таблиці 10.
|
|
|
Таблиця 10 |
Температури кипіння й плавлення деяких алканів |
|||
Назва |
Формула |
tпл., °С |
tкип., °С |
Метан |
СН4 |
–182,5 |
–161,5 |
Етан |
С2Н6 |
–182,8 |
–88,6 |
Пропан |
С3Н8 |
–187,7 |
–42 |
|
|
|
|
|
|
|
|
