
Підручники з Хімії / Хімія 8 клас / Григорович Хімія 8 клас. 2021
.pdf
§ 33. Хімічні властивості кислот
Висновки
1.Для виявлення кислот використовують ті самі індикатори, що й для
виявлення лугів. Лакмус, метиловий оранжевий та універсальний індикатор за наявності кислот змінюють своє забарвлення на червоне,
а фенолфталеїн залишається безбарвним.
2.Кислоти реагують із речовинами оснóвної природи: основами та оснóвними оксидами. У результаті такої взаємодії утворюються сіль та вода. Амфотерні оксиди та амфотерні гідроксиди реагують із кислотами так само.
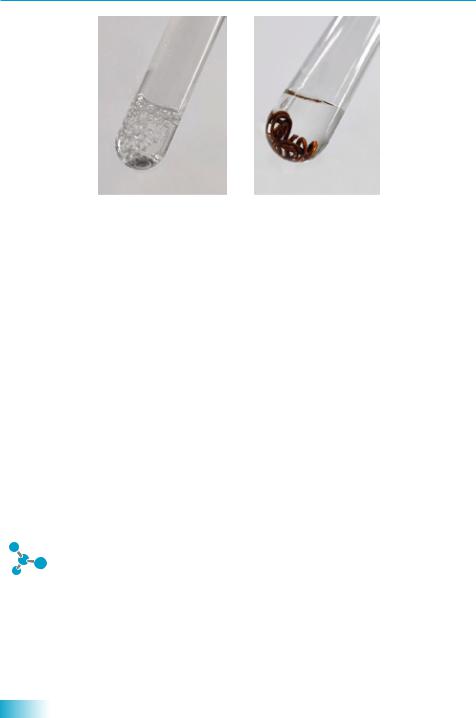
3.Кислоти здатні вступати із солями в реакції обміну. При цьому утворюються інші кислота та сіль. Реакція відбуватиметься у випадку утворення леткої чи нестійкої кислоти або в разі утворення нерозчинної солі чи кислоти.
4.Кислоти — їдкі речовини, з якими слід поводитися дуже обережно. Розбавляючи кислоти, необхідно вливати кислоту у воду, а не навпаки. У разі потрапляння кислоти на шкіру або одяг її слід негайно змити великою кількістю води та нейтралізувати залишки розчином соди.
Контрольні запитання
1.Речовини якого класу сполук утворюються в разі взаємодії кислоти
з основою чи оснóвним оксидом?
2.Які речовини утворюються в реакції обміну між кислотою та сіллю?
Завдання для засвоєння матеріалу
1.Складіть рівняння реакцій нітратної кислоти з магній оксидом та магній гідроксидом.
2. Складіть рівняння реакції взаємодії сульфатної кислоти з такими сполуками: купрум(II) гідроксид, кальцій гідроксид, алюміній оксид, цинк гідроксид, калій сульфіт, натрій сульфід, калій карбонат, купрум(II) сульфід.
У всіх випадках визначте, завдяки чому відбувається реакція обміну.
3.Які оксиди під час взаємодії з хлоридною кислотою утворюють такі солі: CaCl2, HgCl2, FeCl3? Складіть рівняння цих реакцій.
4.Які з наведених речовин можна використати для поглинання вуглекислого газу з повітря: розчин натрій гідроксиду, розчин сульфатної кислоти, фосфор(V) оксид, кальцій гідроксид, кальцій оксид? Відповідь підтвердьте рівняннями реакцій.
5.Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) Mg → MgO → MgSO4; б) Cu → CuO → Cu(NO3)2.
6. Порівняйте маси зразків: ортофосфатна кислота кількістю 3 моль та нітратна кислота кількістю 4 моль.
181

ТЕМА 4. Основні класи неорганічних сполук
7.Доповніть схеми реакцій, укажіть назви продуктів реакцій та доберіть коефіцієнти:
а) NaOH + … → Na2SO4 + …; б) … + HCl → AlCl3 + …;
в) CaO + … → Ca(NO3)2 + …; г) MgO + … → MgCO3;
д) … + SO2 → Na2SO3 + …; е) Al2O3 + … → Al2(SO4)3;
є) … + … → Fe(NO3)3 + H2O; ж) KOH + … → K3PO4 + …
8.Обчисліть кількість речовини атомів Оксигену, що міститься: а) у 0,25 моль сульфітної кислоти; б) 15,6 г силікатної кислоти.
9.Газ, що під час розчинення у воді утворює кислоту, має відносну густину за повітрям 1,17. Складіть формулу цієї кислоти. Як називають її солі? Складіть рівняння добування цього газу з простих речовин.
10.Кальцій карбонат масою 20 г повністю прореагував із хлоридною кислотою. Обчисліть об’єм газу (н. у.), що виділився під час реакції.
11.Розчин натрій силікату масою 61 г із масовою часткою солі 2 % змішали з надлишком хлоридної кислоти. Обчисліть масу утвореного осаду.
12*. Як ви вважаєте, чому сульфатну кислоту називають «матір’ю всіх кислот»? Розкрийте її значення в промисловості.
13*. До яких наслідків, на вашу думку, призводить потрапляння кислот до ґрунтів або водоймищ? У додаткових джерелах інформації знайдіть приклади таких випадків.
§ 34. Ряд активності металів. Реакції заміщення
Пригадайте:
•прості речовини складаються з атомів одного хімічного елемента, їх поділяють на метали та неметали;
•для металів характерний металічний блиск, електропровідність, пластичність тощо.
Поняття про ряд активності металів
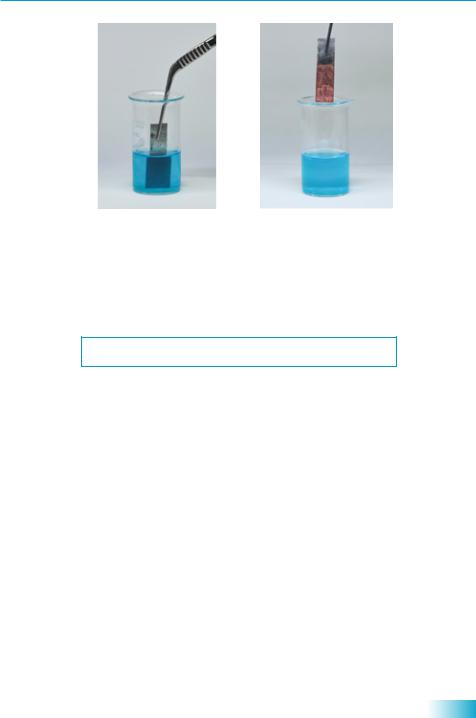
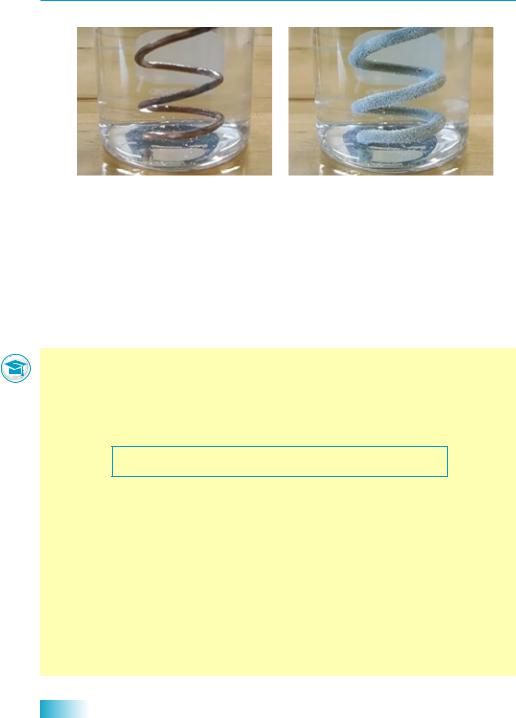
У багатьох хімічних реакціях беруть участь прості речовини, зокрема метали. Метали можуть взаємодіяти майже з усіма класами неорганічних сполук, що вивчають у шкільному курсі хімії. Однак різні метали виявляють різну активність у хімічних взаємодіях, і від цього залежить, відбуватиметься реакція чи ні.
За активністю всі метали можна розташувати в ряд, який називають рядом активності металів (витискувальним рядом металів, рядом напруг металів, електрохімічним рядом напруг металів). Цей
182







 Висновки
Висновки