
Лабораторная 1
.docxМИНОБРНАУКИ РОССИИ
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«ЛЭТИ» ИМ. В.И. УЛЬЯНОВА (ЛЕНИНА)
Кафедра физической химии
ОТЧЕТ
по лабораторной работе №1 по дисциплине «Химия»
ТЕМА: ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА.
Студент гр. 8091 |
|
Гришин И.Д. |
Преподаватель |
|
Бугров А.Н. |
Санкт-Петербург 2019
Цель работы.
Определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл.
Основные теоретические положения.
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты:
 1
− штатив для эвдиометра 2 – эвдиометр
1
− штатив для эвдиометра 2 – эвдиометр
– кристаллизатор
− газоотводная трубка 5 − штатив для пробирки 6 – пробирка
Эквивалент – реальная частица (атом, молекула, ион) или условная частица (доля атома, молекулы, иона), равноценная одному иону водорода
𝐻+ в кислотно-основных реакциях или одному электрону 𝑒− в окислительно- восстановительных реакциях. Обозначается “Э” (вещество).
Молярная масса эквивалента вещества – масса 1 моль (6 ∗ 1022) эквивалентов данного вещества. Обозначается 𝑀эк (вещество). Выражается в граммах на моль [г / моль].
Для окислительно-восстановительной реакции, идущей в работе, закон эквивалентов можно записать как:
𝑚1− масса вещества
𝑀эк1 – молярная масса вещества
𝑚1

𝑀эк1
= 𝑉2
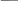 𝑉эк2
𝑉эк2
𝑉2 – объём эквивалента газообразного вещества 2
𝑉эк2 – молярный объём эквивалента газообразного вещества 2
Молярная масса эквивалента металла-восстановителя имеет вид:
𝑀эк
𝑀ат − молярная масса атомов металла
= 𝑀ат
 𝑧
𝑧
𝑧 – число электронов, отданных атомом металла в ходе реакции
Ход работы.
Заполните кристаллизатор водой (~ на 3/4 объема).
Подготовьте эвдиометр к работе
Заполните его (с помощью стакана) водой полностью
Зажмите открытый конец эвдиометра пальцем
Переверните эвдиометр и погрузите его в кристаллизатор с водой
Закрепите эвдиометр в лапке штатива.
Проверьте прибор на герметичность:
Закройте пробирку пробкой с газоотводной трубкой
Опустите конец трубки в воду в кристаллизаторе
Согрейте пробирку руками. Выделение пузырьков воздуха в воде укажет на герметичность прибора.
В вытяжном шкафу отмерьте 5 мл HCl с помощью мерного цилиндра. Перелейте соляную кислоту в пробирку с помощью воронки.
Получите навеску опилок металла у преподавателя.
Держа пробирку с кислотой в наклонном положении, поместите навеску металла в папиросной бумаге на сухую стенку пробирки так, чтобы она не касалась кислоты.
Закройте пробирку плотной пробкой.
Конец газоотводной трубки под водой осторожно введите в эвдиометр.
Поверните пробирку в вертикальное положение так, чтобы навеска металла упала в кислоту.
Осторожно встряхните пробирку.
Поставьте пробирку в штатив.
После окончания хим. реакции дайте системе охладиться до комнатной температуры (8-10 мин).
При помощи эвдиометра определите объем выделившегося водорода в миллилитрах.
Запишите показания комнатного термометра:
t, ℃ (точность 0.5 ℃)
барометра: 𝑝атм , мм рт. ст., Па (точность 0.5 мм рт. ст.)
(1 мм рт. ст. = 133.3 Па).
 Результаты опыта и условия внесите в таблицу:
Результаты опыта и условия внесите в таблицу:
Обработка результатов эксперимента.
Проведя эксперимент, описанный в ходе работы, получаем результаты, которые необходимо записать в таблицу:
Навеска металла m, г |
Температура опыта
T1, К |
Атмосферное давление
Pатм, Па |
Парциальное давление водяного пара
PH2O, Па |
Объём выделившегося водорода
|
Парциальное давление водорода
P1, Па |
0,0205 |
298 |
99325,2 |
3167,2 |
26 |
96158 |
Вычислим объём выделившегося водорода при нормальных условиях (𝑉0)
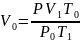
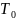 – Нормальная
температура (273 К)
– Нормальная
температура (273 К)
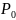 – Нормальное
давление (101325 Па)
– Нормальное
давление (101325 Па)
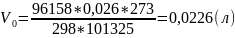
Вычислим молярную массу эквивалента (Mэк)
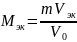
 – Объём
эквивалента
– Объём
эквивалента
 – Объём
выделившегося водорода
– Объём
выделившегося водорода
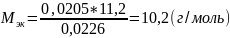
Определим молярную массу атомов металла
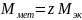
Если
z=1,
то
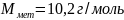
Если
z=2,
то
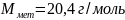
Если
z=3,
то
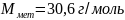 ,
что соответствует Al
(алюминий)
,
что соответствует Al
(алюминий)
(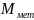 не точно соотвествует данным элементам
из-за приборной погрешности)
не точно соотвествует данным элементам
из-за приборной погрешности)
Ответ: Al (алюминий)
Вычислим абсолютную и относительную погрешности определения
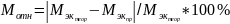
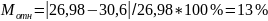
Приведём уравнение окислительно-восстановительной реакции
-
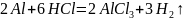
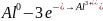
2
окисление
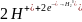
3
восстановление
Вывод.
Проведя эксперимент и получив
верный ответ, убедился в том, что способ
определения неизвестного металла путём
определения молярной массы его
эквивалента действительно работает.
Используя его, в ходе обработки полученных
результатов, определили, что выданный
металл является алюминием,
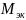 которого равна 10,2 г/моль.
которого равна 10,2 г/моль.

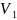 ,
мл
,
мл