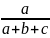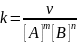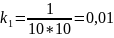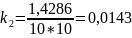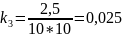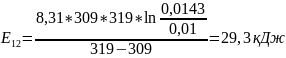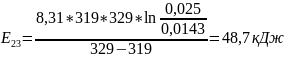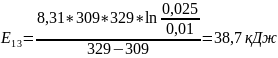Лабораторная 3
.docxМИНОБРНАУКИ РОССИИ
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«ЛЭТИ» ИМ. В.И. УЛЬЯНОВА (ЛЕНИНА)
Кафедра физической химии
ОТЧЕТ
по лабораторной работе №3 по дисциплине «Химия»
ТЕМА: СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Студент гр. 8091 |
|
Гришин И.Д. |
Преподаватель |
|
Бугров А.Н. |
Санкт-Петербург 2019
Цель работы.
Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
Основные теоретические положения.
Согласно закону действия масс, при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции. Например, скорость реакции
𝑚𝐴 + 𝑛𝐵 → ⋯
записывается следующим образом:
𝜈 = 𝑘[𝐴]𝑚[𝐵]𝑛
-
𝑘
Константа скорости реакции, зависящая от природы реагирующих веществ и температуры
[𝐴], [𝐵]
Концентрации реагирующих веществ,

𝑚, 𝑛
Стехиометрические коэффициенты
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на 10 °С увеличивается в 2-4 раза:
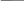 𝜈𝑡
2
=
𝜈𝑡1𝛾
𝜈𝑡
2
=
𝜈𝑡1𝛾
𝑡2−𝑡1 10
-
𝜈𝑡1, 𝜈𝑡 2
Скорости при температурах 𝑡1 и 𝑡2
𝛾
Температурный коэффициент скорости реакции, принимающий
значения 2-4 для большинства реакций.
Условием протекания реакции является столкновение молекул, однако результативными оказываются те столкновения, в которых принимают участие так называемые активные молекулы.
При повышении температуры энергия вещества возрастает и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул.
Избыточная энергия носит название энергии активации.

Активные молекулы – молекулы, которые в момент столкновения обладают некоторым избытком энергии над средней энергией частиц.
Энергия активации реакции – минимальная энергия, которой должны обладать реагирующие частицы (в расчете на 1 моль), чтобы столкновение между ними привело к реакции.

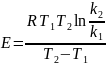
-
𝐸
Энергия активации,
𝑅

Газовая постоянная,
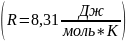
𝑇2, 𝑇1
Абсолютная температура, К

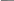 Для
приближенных расчетов: 𝑘2
=
𝜈𝑡2
Для
приближенных расчетов: 𝑘2
=
𝜈𝑡2
𝑘1 𝜈𝑡1
Ход работы.
Опыт 7.1. Зависимость скорости реакции от концентрации 𝑁𝑎2𝑆2𝑂3.
В шесть больших пробирок согласно заданию, приведенному в табл. 7.1, налить 2% раствор 𝑁𝑎2𝑆2𝑂3 и воду. Затем в шесть маленьких пробирок налить по 5 мл 2 % раствора 𝐻2𝑆𝑂4
В первую большую пробирку с раствором 𝑁𝑎2𝑆2𝑂3 долить 5 мл раствора
𝐻2𝑆𝑂4 (из маленькой пробирки) и замерить секундомером время протекания реакции: через несколько секунд 𝜏1 после сливания растворов наблюдается появление серы (помутнение раствора).
𝑁𝑎2𝑆2𝑂3 + 𝐻2𝑆𝑂4 + 𝐻2𝑂 → 𝑁𝑎2𝑆𝑂4 + 𝐻2𝑆2𝑂3
𝐻2𝑆2𝑂3 → 𝑆𝑂2 + 𝑆 + 2𝐻2𝑂
С последующими пробирками проделать аналогичные опыты, замерить время протекания реакции.
Результаты шести измерений (𝜏1– 𝜏6) записать в табл. 7.1.
Опыт 7.2. Зависимость скорости реакции от температуры.
Налить в одну пробирку 10 мл раствора 𝑁𝑎2𝑆2𝑂3 в другую 10 мл раствора
𝐻2𝑆𝑂4. Обе пробирки закрепить зажимами с деревянными рукоятками и опустить в водяной термостат.
После выдержки пробирок в термостате при температуре 𝑡1 в течение 5-7 мин слить вместе содержимое обеих пробирок, отметив время 𝜏1 от момента сливания до помутнения раствора.
Проделать аналогичные опыты при температурах 𝑡2 и 𝑡3. Температура задается преподавателем.
Результаты наблюдений 𝜏1, 𝜏2, 𝜏3 при температурах 𝑡1, 𝑡2, 𝑡3 записать в табл. 7.2.
Обработка результатов.
Табл. 7.1
№ |
Объём, мл |
Концентрация 𝑁𝑎2𝑆2𝑂3
|
τ, с |
Относ. скорость реакции (ν) |
||||
𝑁𝑎2𝑆2𝑂3 + 𝐻2𝑂 (a) (b) |
𝐻2𝑆𝑂4 (c) |
|||||||
1 |
5+15 |
5 |
0,20 |
109 |
1,0000 |
|||
2 |
8+12 |
5 |
0,32 |
80 |
1,3625 |
|||
3 |
10+10 |
5 |
0,40 |
60 |
1,8167 |
|||
4 |
13+7 |
5 |
0,52 |
52 |
2,0962 |
|||
5 |
16+4 |
5 |
0,64 |
33 |
3,3030 |
|||
6 |
20+0 |
5 |
0,80 |
26 |
4,1920 |
|||
Табл. 7.2
№ |
Объём, мл |
t, ºC |
τ, с |
Относ. скорость реакции (ν) |
|
𝑁𝑎2𝑆2𝑂3 |
𝐻2𝑆𝑂4 |
||||
1 |
10 |
10 |
36 |
20 |
1,0000 |
2 |
10 |
10 |
46 |
14 |
1,4286 |
3 |
10 |
10 |
56 |
8 |
2,5000 |
Чтобы убедиться в верности экспериментов необходимо сопоставить
с теоретическими
расчётами:
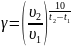
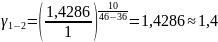
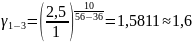
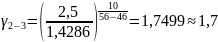
Во всех случаях
температуры коэффициент примерно равен
(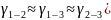 следовательно опыты из таблицы 7.2
верны.
следовательно опыты из таблицы 7.2
верны.
График 7.1
По следующему графику можно сказать, что зависимость скорости реакции от концентрации исходного вещества растёт по экспоненте (синяя линия).

По следующему графику можно сказать, что зависимость скорости реакции от концентрации исходного вещества растёт по экспоненте (черная линия).
График 7.2

График зависимости скорости реакции от температуры схож с графиком логарифма (синяя линия).
 3.
3.
|
|
|
|
|
|
|
|
|
|
Вывод.
Проведя рад опытов убедился в том, что скорость химической реакции зависит как от концентрации исходного вещества, так и от температуры среды реакции.
Убедился в верности расчётов 7.2 путём сравнения экспериментальных значений с теоретическими.