
ФОРМАЛЬНАЯ КИНЕТИКА_2
.pdf
СЕМИНАР 9 КИНЕТИКА СЛОЖНЫХ РЕАКЦИЙ
1. Исходный спирт может давать три продукта по схеме:
Определите константы скорости всех реакций схемы, если в момент времени 4,3 секунды концентрации (моль/л) веществ в реакции составили: – 27,4; – 7,5; – 8,1; – 1,7.
Ответ: 0,0494 с–1; 0,0534 с–1; 0,0112 с–1
2. В реактор постоянного объема протекает реакция разложения вещества
в газовой |
фазе на продукты и со стадиями первого порядка с |
|||||
константами |
скорости = 2,5 ∙ 10−2 |
мин−1, |
|
2 |
= 6,1 ∙ 10−3 |
мин−1. |
|
1 |
|
|
|
|
|
Вычислите степень превращения вещества по каждому направлению через 1 час после начала реакции и соответствующее соотношение концентраций продуктов. В момент начала опыта концентрации продуктов равны нулю.
Ответ: 68 %; 17 %; 4,1
3. Реакция нитрования толуола относится к сложным параллельным реакциям, протекающей с образованием орта-, мета- и пара-нитротолуола. Определите константы скорости каждой реакции, если в начальный момент в системе присутствовало только исходное вещество в количестве 3 моль/л. По данным газожидкостной хроматографии определено, что через 30 минут образовалось о-нитротолуола – 0,346 моль/л, п- нитротолуола – 0,551 моль/л, мета-нитротолуола – следы. Приведите схематическое изображение кинетических кривых.
Ответ: 0,004567 мин–1; 0,007273 мин–1
4. Реакция разложения вещества может протекать параллельно по трем направлениям:
Концентрации (моль/л) продуктов в смеси через 10 мин после начала реакции равны: – 1,6; – 3,6; – 7,8. Определите константы скорости 1 − 3, если период полураспада вещества равен 8 мин. Приведите
схематическое изображение кинетических кривых.
Ответ: 0,00107 мин–1; 0,024 мин–1; 0,052 мин–1
5. Для последовательной реакции известны константы скорости двух реакций:
|
1 |
2 |
|
= 0,033 ч−1; |
|
= 0,051 |
ч−1 |
|
|
→ → , |
2 |
||||||
|
|
|
1 |
|
|
|
|
|
Рассчитайте |
время |
достижения |
максимальной |
концентрации |
||||
промежуточного продукта , а так же текущие концентрации , и при
|
|
, если начальная концентрация составляет 10 моль/л. Приведите |
||||
|
|
|
|
|
|
|
схематическое изображение кинетических кривых. |
||||||
Ответ: |
=24,18 ч; |
=2,91 моль/л; |
=4,5 моль/л; =2,59 моль/л |
|||
|
|
|
, |
|
|
|
6. |
|
|
|
1 |
2 |
константа скорости первой |
В последовательной реакции → → |
||||||
стадии равна 100 мин–1, а второй – 10 мин–1. Рассчитайте время достижения максимальной концентрации промежуточного продукта , а так же текущие концентрации , и при , если начальная концентрация составляет 15 моль/л. Приведите схематическое изображение кинетических кривых.
Ответ: =0,02558 мин; ,=11,614 моль/л; =1,162 моль/л;=2,224 моль/л
7. Реакция термического крекинга нефти относится к консекутивной реакции, причем бензин является промежуточным продуктом, распадающимся на газообразные вещества. Определите максимальную концентрацию бензина и время ее достижения при крекинге 1 т нефти,

если при 673 К константа образования бензина равна 0,273 ч–1, а константа распада бензина – 0,102 ч–1.
|
|
|
|
|
|
|
Ответ: 0,56 т; 5,76 ч |
|||
8. В обратимой реакции первого порядка |
|
измеряли число |
||||||||
молей вещества : |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
, ч |
0 |
|
71,8 |
|
264,3 |
|
333,3 |
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
, моль |
0,366 |
|
0,277 |
|
0,152 |
|
0,130 |
|
0,078 |
|
|
|
|
|
|
|
|
|
|
|
|
При равновесии система |
содержит |
0,288 |
моль и 0,078 |
моль . |
||||||
Определите константы скорости прямой и обратной реакций. Приведите схематическое изображение кинетических кривых.
Ответ: 0,004048 ч–1; 0,001097 ч–1
9. Цис-транс-изомеризация стильбена (1,2-дифенилэтилена) – обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
, с |
0 |
1830 |
3816 |
7260 |
12006 |
∞ |
|
|
|
|
|
|
|
|
|
Доля |
100 |
88,1 |
79,3 |
65,1 |
48,5 |
17,0 |
|
цис-изомера, % |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Приведите схематическое изображение кинетических кривых.
Ответ: 6,56·10–5 с–1; 1,34·10–5 с–1
10. Определите константы скорости прямой и обратной реакций:
транс- = 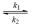 цис- =
цис- =
при 573 К на основании данных о концентрации транс- = к моменту времени :
, с |
0 |
600 |
1080 |
∞ |
|
|
|
|
|
, % |
95 |
82,88 |
75,24 |
41,89 |
|
|
|
|
|
Приведите схематическое изображение кинетических кривых.
Ответ: 2,5·10–4 с–1; 1,8·10–5 с–1
11. Превращение роданида аммония 4 в тиомочевину (2)2 – обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
, мин |
0 |
|
19 |
38 |
48 |
60 |
∞ |
|
|
|
|
|
|
|
|
Доля прореагировавшего |
2,00 |
|
6,90 |
10,67 |
12,29 |
13,96 |
23,20 |
роданида аммония, % |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приведите схематическое изображение кинетических кривых. |
|
||||||
|
|
Ответ: 0,003211 мин–1; 0,01063 мин–1 |
|||||
12. Реакция превращения -оксимаасляной кислоты в лактон представлеяет собой обратимую реакцию первого порядка как в прямом, так и в обратном направлении (концентрация воды постоянна):
Начальная концентрация -оксимаасляной кислоты была равна 0,1823 моль/л. В таблице приведены данные изменения концентрации лактона во времени:
, мин |
0 |
21 |
50 |
80 |
∞ |
|
|
|
|
|
|
∙ , М |
0 |
2,41 |
4,99 |
7,08 |
13,28 |
Найдите константу равновесия данной реакции и значения констант прямой и обратной реакций.
Ответ: 2,68; 7,03·10–3 мин–1 ;2,63·10–3 мин–1
Задания по сборнику Белевского:
Глава XIII
1.3, 1.6, 2.6, 4.3*, 4.4*, 5.3, 6.5, 8.4, 9.6* 1.4, 2.1, 2.4, 3.3, 8.1, 9.3, 9.4, 10.2, 10.4

СЕМИНАР 10 ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ
ОТ ТЕМПЕРАТУРЫ
1. При увеличении температуры от 323 К до 353 К время полураспада некоторой реакции уменьшается в 15 раз. Определите температурный коэффициент Вант-Гоффа.
Ответ: 2,47
2. Константа скорости омыления этилацетата едким натром при 9,4°C равна 2,37 л/(моль мин), а при 14,4°C – 3,204 л/(моль мин). Определите энергию активации, предэкспоненциальный множитель в уравнении Аррениуса, температурный коэффициент Вант-Гоффа и значение константы скорости при 11°C.
Ответ: 40,7 кДж/моль; 7,23·107 л/(моль мин) (или 8·107 л/(моль мин)); 1,83; 2,607 л/(моль мин).
3. Константа скорости реакции при 22°C равна 2,40 мин–1, а при 27°C – 3,30 мин–1. При какой температуре константа скорости будет равна
3,00 мин–1?
Ответ: 25,5°C
4. Для реакции термического разложения 2 5 энергия активации равна 103,5 кДж/моль, а предэкспоненциальный множитель в уравнении Аррениуса равен 4,6 1013 с–1. Рассчитайте период полураспада реагента при –10°C и время, необходимое для завершения реакции на 90 % при
50°C.
Ответ: 62,9 суток; 45,7 мин
5. Зависимость константы скорости разложения фосфина от температуры выражается уравнением:
lg = − |
1896 |
+ 2 + 12,130. |
|
Рассчитайте опытную энергию активации при 800 К.
Ответ: 49,6 кДж/моль
6. Температурная зависимость константы скорости реакции разложенияв газовой фазе 2 (г) = 2(г) + 2(г) передается выражением:
ln = 33,12 − 32640 + 3,318 ∙ 1062
( , мольл ∙с ; , ). Рассчитайте энергию активации при 700 К.
Ответ: 192,6 кДж/моль
7. Рассчитайте энергию активации и температурный коэффициент ВантГоффа, если при повышении температуры от 300 до 330 К скорость реакции возрастает на порядок.
Ответ: 63174,2 Дж/моль; 2,15
8. Скорость реакции димеризации 1,1-дифенилэтилена в сернокислом
растворе |
(реакция |
первого порядка) |
при 50°C в начальный момент |
( 0 = 0,03 |
моль/л) |
составляет 0,141 |
моль⁄л с. Рассчитайте константу |
скорости при 30°C и температурный коэффициент Вант-Гоффа рассматриваемой реакции в интервале температур 30 ÷ 50°C, если
энергия активация равна 50 кДж⁄моль.
Ответ: 1,375 с–1; 1,85
9. Односторонняя реакция первого порядка при 260 К протекает на 30 % за 35 мин. Определите энергию активации, если при 300 К для той же самой глубины протекания требуется 1,5 мин.
Ответ: 51,1 кДж/моль
10. Период полупревращения некоторого вещества при 293 К в 33 раз превышает период полупревращения этого же вещества при 320 К. Определите энергию активации реакции.
Ответ: 100948 Дж/моль

11. Для обратимой реакции известны зависимости равн и 1 от температуры:
|
[ −1] = 8,9 ∙ 1012 −14200/ |
|
= 5,4 ∙ 105 −10600/ |
|||
1 |
|
|
|
|
равн |
|
Определите |
2 |
и |
при 1000 К. |
|
|
|
|
|
2 |
|
|
|
|
Ответ: 4,5·105 с–1; 30 кДж/моль
12. При протекании параллельной реакции были сняты зависимости константы скорости от температуры:
1 = 4,3 ∙ 1011 −15142/2 = 1,5 ∙ 1013 −18076/
При 500 К выход и примерно одинаковы. Как изменится относительный выход при увеличении температуры?
Ответ: относительный выход уменьшится
13. Изопропанол в присутствии оксидного катализатора разлагается (по первому порядку) в двух направлениях по уравнению
В одном из опытов получены следующие данные:
Температура, |
Время, |
Выход ацетона, |
Выход пропилена, |
К |
с |
% |
% |
|
|
|
|
578 |
13,1 |
11,2 |
3,15 |
|
|
|
|
618 |
8,9 |
33,8 |
9,80 |
|
|
|
|
Определите энергию активации дегидрирования и дегидратации.
Ответ: 125 кДж/моль; 128 кДж/моль
Задания по сборнику Белевского:
Глава XIII
1.2, 1.5, 2.2, 2.5, 3.6, 4.5, 5.4, 5.6, 6.6, 7.6, 8.2, 8.6, 9.1, 9.5, 10.1, 10.3, 10.6
