
семинары / Семинар 1
.docМетодички:
1)Химические процессы и реакторы 5224, 2) Материальный баланс ХТС 4260
ОХТ, семинар №1
Пример 1. Определить расходные коэффициенты в производстве 1 т технического CaO из известняка. Технический CaO содержит, мас.%: CaО 92%; CO2 2,4% ; примеси ост. М.массы: CaO – 56; CaСO3 – 100; СО2 – 44.
CaСO3 = CaO + CO2
Решение. В соответствии со стехиометрией реакции количество превращенного CaСO3 для получения 920 кг CaO составит:
![]() кг.
кг.
CO2 содержится в составе технического CaO в виде необожженного карбоната кальция в количестве:
![]() или 55 кг.
или 55 кг.
На долю примесей приходится: 100-92-5,5 = 2,5 мас.% или 25 кг.
Необходимое количество известняка составит: 1643+ 55+25 = 1723 кг.
Расходный коэффициент по сырью: Кс=1,723 т/т
Пример 2. Определить расходные коэффициенты в производстве 1 т технического карбида кальция, содержащего, мас.%: CaC2 78%; CaO 15% ; C 3% ; прочие примеси 4%. Известь содержит 96,5 мас.% СаO, ост. примеси. В коксе содержатся, мас.%: золы 4; летучих 4, влаги 3. Мол. массы: CaC2 64, CaO 56.
Решение. Карбид кальция получается согласно уравнению:
CaO + 3C = CaС2 + CO
Расход извести: В 1 т продукта содержится 780 кг СаС2; на образование этого количества СаС2 по стехиометрическому соотношению требуется СаО:
![]() кг
кг
Кроме того, в техническом продукте содержится не прореагировавший СаО в количестве:
1000·0,15 = 150 кг
Расход СаО:
675 +150 = 825 кг
Расходный коэффициент по технической извести К1:
К1
=
![]() 0,85
т/т
0,85
т/т
Расход кокса.
Содержание углерода в коксе: 100 (4+ 4+ 3) = 89 мас.%
На образование 780 кг СаС2 расходуется углерода:
![]()
В готовом продукте содержится не превращенный углерод:
1000 0.03 = 30 кг
Расход углерода 440 + 30 = 470 кг
Расходный коэффициент по коксу К2:
К2
=
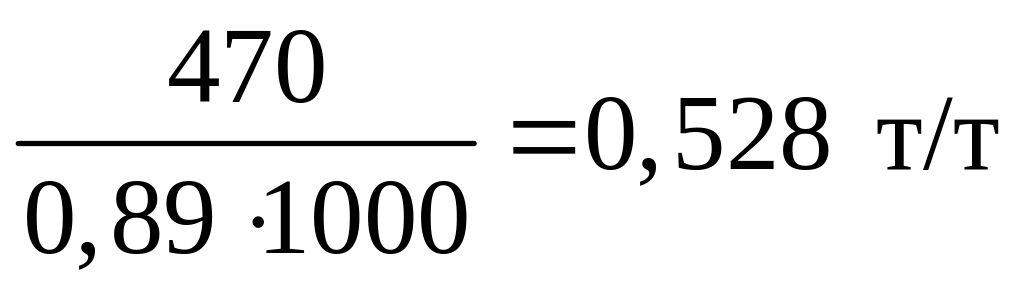
Пример 3. Составить материальный баланс (ДЗ) и определить расходные коэффициенты по сырью при разложении 1000 кг апатитового концентрата (содержание Р2О5 = 33 мас.%) с помощью 60 мас.% серной кислоты, подаваемой с 10% избытком от теоретического значения. Мол. массы:
Са5F(РО4)3 – 504; Ca(H2PO4)2 – 234; Р2О5 – 142; H2SO4 . – 98; HF – 20.
Процесс описывается уравнением:
2Са5F(РО4)3 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF
Решение. С учётом того, на 2Са5F(РО4)3 приходятся 3 молекулы Р2О5 в 1000 кг апатитового концентрата содержится:
![]() кг
Са5F(РО4)3,
остальное 1000-781 = 219 кг- примеси
кг
Са5F(РО4)3,
остальное 1000-781 = 219 кг- примеси
По уравнению реакции при разложении 781 кг Са5F(РО4)3образуется:
![]() кг Ca(H2PO4)2
кг Ca(H2PO4)2
Расходный коэффициент по апатитовому концентрату составит:
![]() т/т
продукта
т/т
продукта
Таблица 1. Материальный баланс
Приход |
кг/ч |
Расход |
кг/ч |
Апатитовый концентрат: Са5F(РО4)3 примеси |
1000 |
Ca(H2PO4)2
примеси |
363
219 |
781 |
|||
219 |
|||
Серная кислота, р/р: |
? |
CaSO4 |
? |
H2SO4 ,100% |
? |
HF |
? |
Вода |
? |
Вода |
? |
Итого
Пример 4.
Составить материальный баланс и найти расходные коэффициенты по метану, водяному пару и энергии (тепла) в процессе получения водорода путем конверсии метана водяным паром, описываемой реакцией:
СН4 + Н2О = СО + 3Н2 – Qр (206,4 кДж)
Паров воды (в кмоль)
поступает в 6 раз больше, чем метана,
степень превращения метана хСН4
= 0,98. (хСН4
= ∆V![]() /
V
/
V![]() ).
).
Расчёт вести на 1000 м3/ч водорода.
Решение.
Количество метана, превращенное в Н2:
∆V
.=
![]() = 1000/3 = 333,3 м3/ч
или
= 1000/3 = 333,3 м3/ч
или
![]() 238,1 кг/ч.
238,1 кг/ч.
Исходное количество метана:
V
![]() м3/ч
или
м3/ч
или
![]() кг/ч.
кг/ч.
Исходное количество водяного пара:
V![]() 0
= 6 V
=
2040,6 м3/ч
или 1639 кг/ч.
0
= 6 V
=
2040,6 м3/ч
или 1639 кг/ч.
Оставшееся
количество водяного пара V![]() = V
0
V
.хСН4
=
= V
0
V
.хСН4
=
2040,6 –340,1 0,98 = 1707,3 м3/ч или 1371,9 кг/ч.
Кол-во оставшегося метана: 340,10,02 = 6,8 м3/ч или 340,1 – 333,3 =6,8 м3/ч.
Данные расчёта материального баланса сведем в табл.2.
Таблица 2. Материальный баланс паровой конверсии метана
Приход |
|
Расход |
||||
Вещество |
кг/ч |
м3/ч |
|
Вещество |
кг/ч |
м3/ч |
|
||||||
СН4 |
242,9 |
340,1 |
|
Н2 |
89,3 |
1000 |
Н2О |
1639 |
2026,8 |
|
СО |
416,6 |
333,3 |
|
|
|
|
|
||
|
СН4 |
4,8 |
6,8 |
|||
|
Н2О |
1371,9 |
1707,3 |
|||
Итого |
1882 |
2366,9 |
|
Итого |
1882 |
3047,4 |
Количество подведенного тепла в процессе :
q = Qр·VСО·103/22,4 = 206,4333,3·103/22,4 = 3071 кДж/ч
Расходный коэффициент по тепловой энергии (без учета потерь тепла в окружающую среду и предварительного нагрева реакционной смеси):
![]() кДж/кгН2
кДж/кгН2
Задачи (ДЗ)
1. Составить материальный баланс и определить расходный коэффициент по руде, содержащей сульфид цинка, для получения 1000 м3/ч SO2 при обжиге руды в потоке воздуха. Руда содержит 24 мас.% серы. Химическая реакция:
2ZnS
+ 3O2
![]() 2ZnO
+ 2SO2
2ZnO
+ 2SO2
Степень выгорания серы из руды равна 94%.
2. Найти производительность реактора окисления диоксида серы по триоксиду серы (в м3/с), в который поступает реакционная смесь с расходом 10 м3/с и содержащая 9 об.% SO2 и 11 об.% О2, остальное азот. Концентрация триоксида серы в газе на выходе из реактора равна 8,0 об.%.
SO2 + 0,5 O2 = SO3.
3. Составить материальный баланс и определить расходные коэффициенты при получении анилина путем каталитического гидрирования нитробензола в соответствии с реакцией:
С6Н5NO2 + H2 = С6Н5NН2 + Н2O
Производительность установки по анилину равна 15 т/сутки, состав технического нитробензола, подаваемого в реактор, мас.%: нитробензол – 98,5 и бензол -1,5. Мольное отношение нитробензол : водород = 1 : 3, выход анилина (степень превращения нитробензола в анилин) равен 98%.
