
семинары / Семинар 4
.pdf
ОХТ, семинар 4
Кинетика химических превращений
Скорость превращения вещества (Wi) − количество i-го вещества, которое превращается в единице реакционного пространства в единицу времени. Для закрытой системы, концентрации веществ изменяются во времени, можно написать:
W = |
dN |
|
, |
|
W = |
dс |
|
i |
если V= const, тогда |
i |
|||
|
|
|
|
|||
i |
V dt |
|
i |
dt |
||
|
|
|
|
|
||
Если вещество расходуется, то Wi 0, если образуется Wi 0.
Так как количества веществ, участвующих в реакции
AA + BB + ... → RR + SS + ...
связаны между собой стехиометрическими соотношениями,
превращения находятся в зависимости:
,
то скорости их
WA/ A = WB/ B = WR/ R = WS/ S = const = r,
где r определим как скорость химической реакции.
Скорость превращения i-го вещества в простой реакции Wi = i r
в сложной реакции Wi = ij rj , где rj − скорость j-й частной реакции.
Кинетическое уравнение − функциональная зависимость скорости реакции или скорости превращения вещества от условий ее протекания (концентрации реагентов, температуры, давления)
r = r (T, с) = k (T) f (с)
где k − константа скорости реакции, зависящая только от температуры.
Зависимость k = f(T) определяется уравнением Аррениуса:
− Е k = k0 e RT

Вид зависимости r(T,с) зависит от типа и механизма реакции. Размерность k определяется видом функциональной зависимости f(c) и размерностью r.
Скорость обратимой реакции
АА + ВВ |
RR + SS |
записывается в виде разности скоростей прямой r1 и обратной реакций r−1:
где
r= r1 - r−1 = k1(T) f1(c) – k−1(T) f2
(c)= сRr сss
са с b
АВ
(c) = k1(T) f1 (c) [1 − (c)/ Kр],
|
k |
|
, Kр = |
1 |
|
k |
||
|
||
|
−1 |
Показатели степеней a, b, r и s при концентрациях исходных веществ и продуктов называются порядками реакции по отношению к данному реагенту.
Обычно порядок реакции определяют экспериментально, поэтому он может не совпадать со стехиометрическим коэффициентом.
В частном случае, для обратимой реакции первого порядка А R
скорость реакции r = k1сА − k−1сR и скорость превращения, например, для вещества А:
|
|
dс |
|
|
dx |
|
|
|
|
|
W |
= |
A |
= −r |
или = −c |
A |
= −(k с |
− k |
с |
) |
|
|
|
|||||||||
A |
|
dt |
|
A,0 |
dt |
1 |
А |
|
−1 R |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
где сА= сА0(1-х) и сR= сА0х. |
|
|
|
||||
dx |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
= k (1 |
− x) − k |
|
|
х |
= |
k |
−(k |
+ k |
|
)х; |
||||
|
−1 |
−1 |
|||||||||||||
dt |
1 |
|
|
|
|
|
|
1 |
1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при t = 0 х = 0. После интегрирования получим: |
|
|
|
|
|||||||||||
|
xА |
= |
|
k1 |
|
|
1 − |
e |
− (k 1 + k−1 ) t |
) |
|
|
|||
|
k |
+ k |
|
|
|
|
|
|
|
||||||
|
|
|
|
( |
|
|
|
|
|
|
|
||||
|
|
1 |
|
−1 |
|
|
|
|
|
|
|
|
|||
Параллельные реакции: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k1 |
|
|
|
|
k2 |
|
|
|
|
|
|
|
|
|
А → R; A → S; |
|
|
|
|
||||||||
Скорости превращения веществ (пусть обе реакции 1-го порядка):
WA = dсA/dt = −(k1+ k2 )сA, WR = dсR/dt = k1сA, WS= dсS/dt = k2сA

при. t = 0: сA = с0 и сR = сS = 0. После интегрирования уравнений получим:
|
|
|
|
|
|
|
|
−(k |
+ k |
|
) t |
с |
= с |
|
e |
1 |
|
2 |
|
||||
A |
|
|
|
0 |
|
|
|
|
|
|
|
с = |
|
|
|
k 1 |
|
|
|
с0 (1− |
e− ( k 1 + k 2 ) t ) |
||
|
|
|
|
|
|
|
|||||
|
k 1 |
+ |
k 2 |
||||||||
R |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
с = |
|
|
|
k 2 |
|
|
с0 (1− e− ( k 1 + k 2 ) t ) |
||||
|
|
k 1 |
+ |
|
|
||||||
S |
|
|
k 2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Последовательные реакции 1-го порядка: |
|
|
|
||||||||
|
|
|
|
|
|
k1 |
k2 |
|
|
||
|
|
|
|
|
|
А → R; R → S; |
|||||
Скорости превращения: WA= dсA/dt= −k1сA ,
WR= dсR/dt=k1сA − k2сR, WS = dсS/dt = k2сR; при t = 0: сA = со и сR = сS = 0.
После интегрирования уравнений найдем:
|
|
|
|
|
|
−k |
t |
|
|
||
с |
= |
с |
e |
|
|
1 |
|
|
|
||
A |
|
|
0 |
|
|
|
|
|
|
|
|
с |
|
k |
|
с |
|
−k |
t |
−k |
t |
) |
|
= |
1 |
|
|
||||||||
|
|
(e 1 |
|
− e |
2 |
|
|||||
R |
k |
+ k |
0 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
сS = с0 − сA − сR
Для определения максимальной концентрации целевого продукта R
необходимо взять производную dсR/dt и приравнять её 0.
Получим координаты точки максимума:
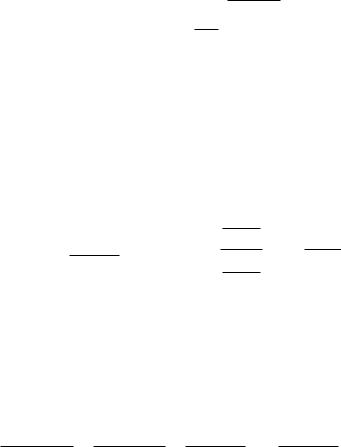
|
|
|
|
ln |
|
k 1 |
|
|
|
|
|
|
|
t max |
= |
|
|
k 2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||||
k 1 |
− k 2 |
|
k |
|
|
||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с |
|
= с |
( |
k |
2 ) |
k |
1 |
−k |
2 |
||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
R |
|
|
0 |
k |
|
|
|
|
|
|
|||
|
max |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
Дифференциальная селективность по продукту (SR ) − отношение скорости превращения исходного вещества в заданный продукт (WA→R) к общей скорости превращения исходного вещества по всем направлениям (WA):
|
|
|
|
dc |
|
|
|
|
|
|
|
R |
|
|
|
|
W |
|
|
dt |
|
dc |
|
|
|
− |
= − |
R |
. |
||
SR' = |
A→R |
или SR' = |
dc |
dc |
|||
W |
|
|
|
||||
|
|
|
A |
|
A |
|
|
|
А |
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
откуда
cA
с |
= − |
|
S |
R |
' dc . |
R |
|
|
A |
||
|
|
c |
|
|
|
|
|
A 0 |
|
|
|
Связь между интегральной и дифференциальной селективностями:
|
|
|
|
NA→ R |
|
|
|
N |
|
|
|
c |
|
1 |
|
c |
|
|
|
|||
S |
|
= |
|
|
= |
|
|
|
= |
= − |
|
A |
S |
|
'dc |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
R |
|
|
R |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
R |
|
N |
A0 |
− N |
A |
|
N |
A0 |
− N |
A |
|
c |
−c |
c |
−c |
|
R |
A |
|||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
A0 |
A |
A0 |
|
A c |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A 0 |
|
|
|
Для простой реакции SR = SR = 1.
Пример 1. Протекает химическая реакция вида 2А + 3В → S + 4R + 2F.
Известно, что скорость по компоненту А составляет 5 моль/(л∙с). Определить скорости по остальным компонентам.
Wi= i r
WA = -2r = -5; r = 2,5 моль/(л∙с); WB = -3r = -3 2,5 = -7,5 моль/(л∙с);
WR = 4r = 4∙2,5 = 10 моль/(л∙с); WS = r = 2,5 моль/(л∙с);

WF = 2r = 2∙2,5 =5 моль/(л∙с).
Пример 2. Константа скорости реакции А → R равна 0,025 с-1. Исходная концентрация реагента составляет 1 кмоль/м3. Определить значения скорости реакции, протекающей в замкнутом объеме через 10, 30, 50 c.
Решение. Размерность константы скорости «обратное время» указывает на то,
что реакция 1-го порядка: WA =
и далее сА= сА,0 е-kt.
dcA dt
= А r = –kсА или
dc |
= −kdt |
|
A |
||
|
||
с |
|
|
А |
|
t, с |
10 |
30 |
50 |
|
|
|
|
сА, кмоль/м3 |
0,78 |
0,47 |
0,29 |
|
|
|
|
102 r, кмоль/(м3 с) |
1,95 |
1,18 |
0,73 |
|
|
|
|
Пример 3. В реакторе протекает сложная реакция в жидкой фазе: А = R,
R + 2B = S. сАо =1,8; сВо =1,5; сRо= сSо = 0; Текущие концентрации сА = 0,40;
сs = 0,3 кмоль/м3. Константы скоростей отдельных реакций равны k1 =3,8·10−2 с-1, k2 = 2,2·10−2 л/(моль.с). Определить скорости превращения по всем компонентам для текущих концентраций
Решение. WA = –k1сА ; WB = –2k2сR сВ; WR = k1сА – k2сR сВ; WS= k2сR сB.
сВ и сR? При переходе к более удобной для расчета системе двух уравнений:
А = R и А + 2В = S легко видно, что сАо– сА = сR + сS тогда сR= 1,8– 04 – 0,3 = 1,1
кмоль/м3. cВо– сВ= 2сS и сВ= 1,2 кмоль/м3. WA = ?WB =? WR =? WS=?
Пример 4. При постоянной температуре протекают две параллельные реакции: k1 k2
А→ R; A → S;
сконстантами скоростей k1 = 10– 2 c–1 и k2 = 10−1 c–1. Перед началом реакции
сА,0 = 3 кмоль/м3, сR,0= сS,0 = 0. Определить скорость и степень превращения реагента А, а также селективность по продукту R в момент времени, равный
30 с.

Решение. Скорость превращения А:
WA = –dсA/dt = (k1+ k2 )сA = (k1+ k2 )сA,0 e – (k1+ k2) t = 0,32 кмоль/(м3.с);
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
dx |
|
= |
(k |
|
+ k |
|
|
) c |
(1− x |
) |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
A,0 |
dt |
|
|
1 |
|
|
2 |
|
|
A,0 |
A |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 1 − e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
−(k |
|
+k |
)t |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|
= 0,28. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
NA→ R |
|
|
|
|
|
N |
R |
|
|
|
|
|
c |
|
|
|
|
|
c |
|
|
0, 26 |
|
|
|
|
|
||||
|
|
|
SR |
= |
|
|
|
|
|
= |
|
|
|
|
|
|
= |
|
|
R |
|
= |
R |
|
= |
|
|
|
= 0,31. |
|
|
||||||||
|
|
|
NA,0 |
|
|
|
NA,0 − NA |
cA,0 −cA |
cA,0 хА |
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
− NA |
|
|
|
|
3 |
0, 28 |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
k |
1 |
|
|
|
|
|
|
− ( k |
|
+ |
k |
|
) t |
|
|
|
|
|
|
−2 |
|
|
|
|
|
−2 |
−1 |
) 30 |
|
|
3 |
|||||
с |
= |
|
|
|
|
с |
|
( |
1− e |
1 |
2 |
)= |
|
|
10 |
|
|
3 (1− е |
−(10 |
|
+10 |
|
) = 0, 26 |
кмоль/м |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−2 |
|
|
−1 |
|
|
|
|
|
|
|
||||||||||||||
R |
k |
|
+ |
k |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
+10 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Пример 5. При какой температуре должны протекать реакции А = 2R(1) и
A = 3S(2), чтобы на образование 2 молей продукта R получить 1 моль S, если
к1 = 106 ехр (–45000/RT) c-1, к2 = 105 ехр (–20000/RT) c-1.

ДЗ
1) Для двух параллельных реакций
k1 k2
А → 2R и A → S

с константами скоростей к1 =0,01 с−1 и к2 = 0,03 с−1 определить время, при котором в продуктах будет содержаться 0,7 кмоль/м3 вещества S. Перед началом реакции концентрация вещества А была 2,2 кмоль/м3, а вещества R и S
отсутствовали. Найти также селективность по веществу R.
2) Для двух параллельных реакций А→R(1) и А→2D(2), константы скоростей к1
= 6.
1013 exp (–
37000 RT
) с-1 и к2 = 3,7.
1013 exp (–
43000 RT
) с-1. Какова должна быть
температура, при которой на образование двух молей R образуется 0,5 моля продукта D. Перед началом реакции вещества R и D отсутствовали.
