лекции / Лекция-3.-19.02.22
.pdfРЕКОМЕНДАЦИИ ДЛЯ ИНТЕНСИФИКАЦИИ ПРОЦЕССА С
ПРОСТОЙ НЕОБРАТИМОЙ РЕАКЦИЕЙ
Порядок реакции n изменяет темп роста скорости с концентрацией: он выше для реакции более высокого порядка.
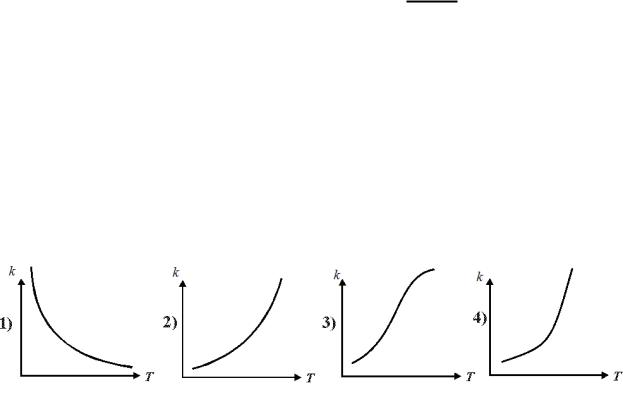
Константа скорости k зависит от температуры в соответствии с уравнением Аррениуса.
Характер изменения r(T) такой же, как и k(T).
•увеличение скорости превращения достигается увеличением концентрации, снижением степени превращения и повышением температуры – температура должна быть максимальной.
•Температурный предел ограничен:
появлением нежелательных реакций,
возможностью самовоспламенения,
устойчивостью материала аппаратуры и т.д.
k k |
e |
0 |
|
Е RT
•Какая зависимость константы скорости реакции от температуры будет корректной в широком диапазоне температур?
ПРОСТАЯ ОБРАТИМАЯ РЕАКЦИЯ
R
Если обе реакции 1-го порядка, скорость представлена кинетическим уравнением как разность скоростей прямой и обратной реакций, которое имеет вид:
r = k1сA k-1сR = k1сA,,0(1 – x) k-1 с А,0 x = k1сA,,0(1 x |
1 |
x ), (1) |
|
К р |
|||
|
|
где k1, k-1– константы скорости прямой и обратной реакций, Кр- константа равновесия реакции, равная отношению k1/k-1 или отношению равновесных концентраций сR/сА = xр/(1- xр).
Получите уравнение r = (k1 + k 1) с А,0 (x p x) из уравнения (1)

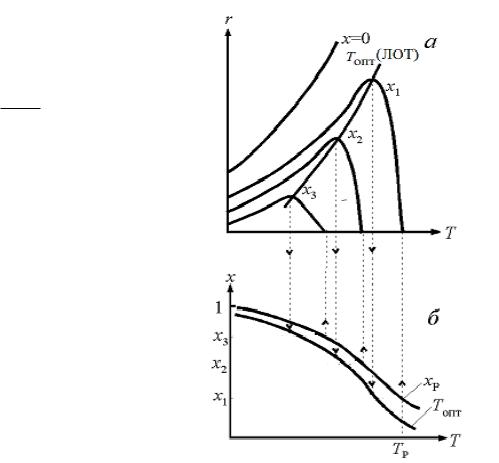
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ОБРАТИМОЙ РЕАКЦИИ
1.Экзотермическая реакция:
r = k1сA k-1сR = k1сA,0(1– x |
1 |
|
К |
||
|
||
r = (k1 + k 1) с А,0 (x p x) |
р |
|
|
x ) или
(а) - зависимость скорости r обратимой экзотермической реакции от температуры Т ;
(б) -зависимость степени превращения x от температуры Т

2. Эндотермическая реакция:
r = k1сA k-1сR = k1сA,0(1 x –
1 К р
х) или r = (k1 + k 1) с А,0 (xp x)
(а) - зависимость скорости r обратимой эндотермической реакции от температуры Т; (б) – зависимость степени
превращения xр от температуры Т
общая химическая технология
СПОСОБЫ ИНТЕНСИФИКАЦИИ ПРОЦЕСССА С ОБРАТИМОЙ РЕАКЦИЕЙ
•Скорость обратимой реакции растет с увеличением концентрации исходного вещества и уменьшением степени превращения.
•Для обеспечения максимальной скорости процесса с обратимой экзотермической реакции её нужно проводить в режиме
близком к оптимальному Топт путем снижения температуры по мере роста степени превращения.
•Максимальная скорость процесса с обратимой эндотермической реакции достигается при максимально допустимом значении температуры.
ГОМОГЕННЫЙ ХИМИЧЕСКИЙ ПРОЦЕСС СО СЛОЖНОЙ РЕАКЦИЕЙ
•Сложная реакция состоит из частных реакций, вид кинетических уравнений которых такой же, как для простой реакции.
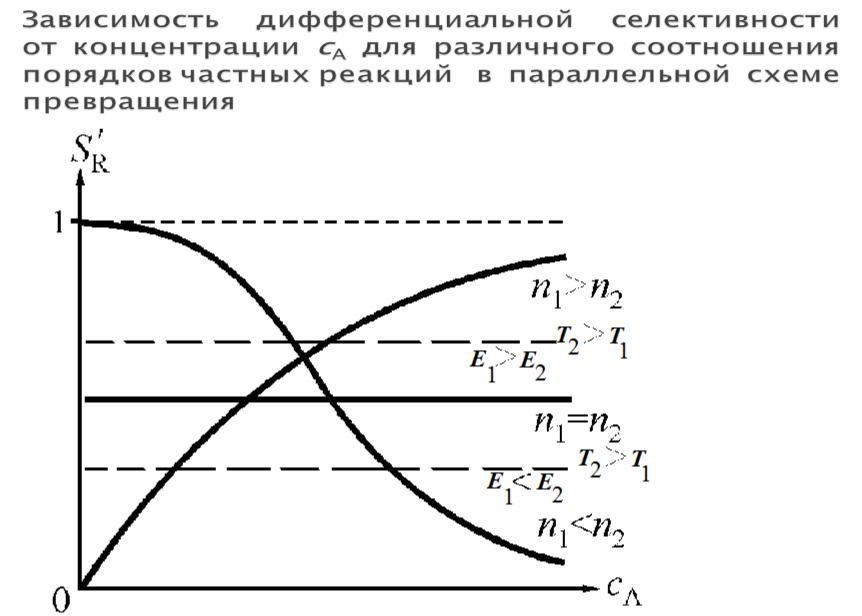
•В сложной реакции необходимо обеспечить максимальную степень превращения исходных веществ в целевой продукт, т.е. максимальную селективность. Селективность бывает интегральная и дифференциальная. Об интегральной селективности см. лекцию 2.
•Дифференциальная селективность S'R− отношение скорости
превращения исходного вещества в целевой продукт к общей скорости превращения исходного вещества.
•Рассмотрим реакцию с параллельной схемой превращения А:
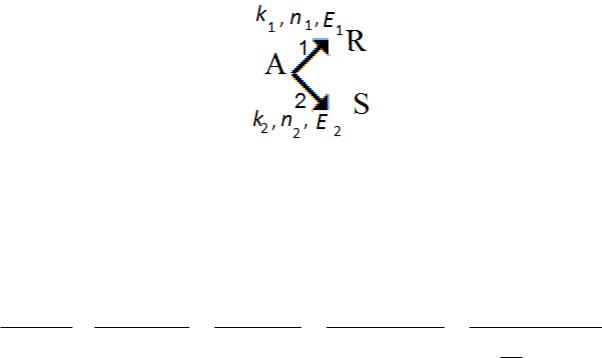
• |
где k1, k2 |
– константы скорости; E1, E2 – энергии активации; |
|
• |
n1, n2 |
– порядки частных реакций. |
|
• |
|
|
|
• S'R=
W |
|
|
|
|
|
|
W |
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
ν |
|
r |
|
|
k c |
1 |
|
|
|
|
1 |
|
|
|
|
|||||
A R |
|
|
|
А 1 |
|
|
R |
|
n |
1 |
A |
n |
|
|
|
|
|
|
|
|
||
W |
|
(r r ) |
W |
W |
|
|
|
|
k2 |
|
n |
|
n |
|
||||||||
ν |
|
|
|
|
|
|
|
|
|
2 |
1 |
|||||||||||
|
|
k c 1 |
k c 2 |
|
1 |
c |
|
|
||||||||||||||
А |
|
А |
|
1 |
2 |
|
R |
S |
1 |
A |
|
|
2 |
A |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|