
лекции / Лекция-2-.15.02.22
.pdf
Теория химических процессов
Лекция 2

ХИМИЧЕСКИЙ ПРОЦЕСС
Это совокупность химических реакций и явлений массо-и теплопереноса.
В этой совокупности химическая составляющая занимает центральное место, поскольку обеспечивает
изменение химической природы веществ.
Физико-химические закономерности химических превращений:
1)Стехиометрические соотношения;
2)Термодинамические и
3)Кинетические закономерности.
Каждый вид ф/х закономерностей решает свои конкретные задачи.
Общая химическая технология |
2 |

Стехиометрические соотношения
Они позволяют:
1)Рассчитать количества веществ, принимающих участие в химическом превращении т.е. являются основой расчетов материальных и тепловых балансов;
2)Провести расчет показателей (расходные
коэффициенты, степень превращения, селективность и другие).

Изменение состава реагирующей смеси происходит в соответствии со стехиометрическими уравнениями реакций. Стехиометрическое уравнение это форма представления взаимодействия веществ, которая показывает, в каком соотношении вещества вступают во взаимодействие друг с другом. Стехиометрическое
уравнение простой реакции (описывается одним уравнением) имеет вид:
AА + BВ +... |
= RR + SS +... |
(1) |
Реагенты А, В расходуются, продукты R, S образуются в соответствии с их стехиометрическими коэффициентами
A, B, R, S. Уравнение (1) можно представить также в форме алгебраического уравнения:
( i Аi) = 0 |
(2) |

N |
A |
N |
A 0 |
|
N |
B |
N |
B 0 |
|
N |
R |
N |
R 0 |
|
N |
S |
N |
S 0 |
const |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
ν |
A |
|
|
|
|
ν |
B |
|
|
|
|
ν |
R |
|
|
|
|
ν |
S |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где Аi – обозначения веществ, вступивших в реакцию или образовавшихся в результате реакции, i – cтехиометрические коэффициенты, причём:
i 0 для исходных веществ и i 0 для продуктов реакции.
Обозначим NA0, NB0, NR0, NS0- исходные количества реагентов и продуктов А, В, R, S; NA, NB, NR, NS – их текущие количества к какому-то моменту времени. Тогда в соответствии со стехиометрическим уравнением (1) получим стехиометрическое балансовое соотношение:
(NA – NA,0)/ A = (NB – NB,0)/ B = (NR – NR,0)/ R = (NS – NS,0)/ S (3)
или (Ni – Ni,0)/ i = const 0.

Сложная реакция, состоит из нескольких частных |
|
реакций, описываемых стехиометрическими |
|
уравнениями следующего вида: |
|
AjA + BjB + ... = RjR + SjS + ... j = 1, …, J |
(5) |
или ( ij Аi) = 0 |
(6) |
где индекс j относится к j-й частной реакции. В уравнении (6) стехиометрический коэффициент ij может быть равен 0, если это вещество не участвует в данной реакции.
Важно! Для количественных расчётов сложной реакции необходимо использовать только
стехиометрические независимые уравнения.

Базисная система стехиометрических независимых уравнений
Такая система однозначно и полно описывает процесс. Доказано, что она должна содержать число уравнений,
равное: для окислительно-восстановительных |
|
|
реакций |
У = B – Э |
(7) |
для обменных реакций |
|
|
|
У = В – Э + 1 |
(8) |
где У – число уравнений в базисной системе; В – число веществ (участников химического превращения); Э – число химических элементов, из которых состоят вещества.
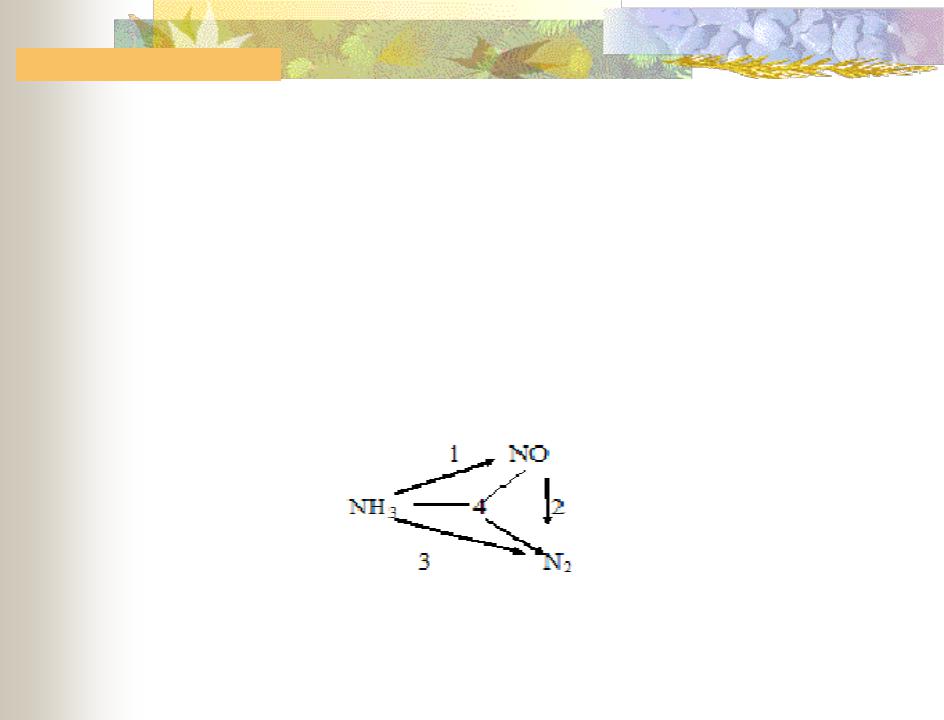
Пример выбора
Окисление аммиака кислородом воздуха до оксида азота как целевого продукта сопровождается протеканием ряда побочных реакций. Общее превращение аммиака можно представить в виде, схемы, состоящей из 4
реакций:
У = B – Э = 5 – 3 = 2

νi
νА
ПОКАЗАТЕЛИ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ
Степень превращения - отношение количества превращенного исходного вещества ∆ N= N0 – N = N0 к его начальному количеству N0.
Степень превращения может быть определена для любого исходного реагента, например, В:
xВ = (NВ,0 - NВ)/NВ,0.
Используя степень превращения ключевого вещества, можно определить по уравнению количество i-го вещества, израсходованного или образовавшегося в результате протекания реакции (1) в соответствии с (3):
N N |
|
|
ν |
i |
(N |
|
N |
|
) |
|
|
или |
N |
|
N |
|
|
|
i |
N |
x |
||||||||
|
|
|
|
|
|
|
i |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
i0 |
|
|
|
|
|
|
|
A0 A |
|||||||||||
i |
|
i,0 |
|
ν |
|
|
|
A |
|
|
A,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Ni |
Ni,0 |
|
|
νi |
|
(NA NA,0 ) или |
N N0 |
|
ν |
NA,0 хА |
||||||||||||||||||
|
ν |
A |
|
ν |
A |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(9)
(10)

Если пренебрегают изменением объема или общего числа молей в ходе реакции, когда ∆ν = 0,
вместо Ni , NА0 и Ni0
можно поставить концентрации Ci, CА,0 и Ci0:
Сi = С i 0 ( i/ A). СA0 xA
В противном случае расчет ведут по формуле:
C |
|
C |
( |
/ |
A |
)C |
A0 |
x |
A |
||
i0 |
i |
|
|
|
|
||||||
i |
|
1 ( / |
|
|
)C |
x |
|
||||
|
|
A |
|
||||||||
|
|
|
|
|
|
A0 A |
|||||
где: Сi =Ni/ N и
С |
N |
/ N |
i0 |
i0 |
0 |
