
лекции / ЛЕКЦИЯ-13 Серная-кислота
.pdfПРИМЕРЫ ПОСТРОЕНИЯ ЭФФЕКТИВНЫХ ХИМИЧЕСКИХ ПРОИЗВОДСТВ
Производство серной кислоты
•Производства минеральных удобрений (суперфосфата, сульфата аммония), являются крупнейшим потребителем серной кислоты. Кислота используется также в нефтепереработке, производстве химических волокон, взрывчатых веществ, лаков красок цветных металлов. Высокая химическая активность и относительно небольшая стоимость предопределили большое разнообразие применения серной кислоты почти во всех промышленных отраслях.
Сырьевая база
•производства серной кислоты - серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место занимают отходящие газы цветной металлургии, получаемые при обжиге сульфидов цветных металлов и содержащие диоксид серы. Некоторые производства используют как сырье сероводород, образующийся в производстве кокса, при сероочистке в нефтепереработке. Первой стадией технологической системы является обжиг серосодержащего сырья для получения диоксида серы.

Химическая схема производства серной кислоты
Сравним 2 схемы производства,
•в которых в качестве сырья выступает серный колчедан или сера. Химическая схема включает реакции:
•обжиг серного
•колчедана:4 FeS2 + 11 O2 → 2Fe2O3 + 8 SO2+Qр
• или серы |
S + O2 → SO2 +Qр; |
•окисление диоксида
• серы |
SO2 + 1/2 O2 SO3 +Qр; |
•абсорбция триоксида
• серы |
SO3 + H2 O H2 SO4 +Qр. |
•С учетом требований по ресурсо-энергосбережению, минимизации отходов и затрат на оборудование сера как сырье – предпочтительнее.
Функциональная производства серной кислоты
|
Воздух |
|
|
|
Н2О |
|
||||
|
|
|
|
|
|
|
|
|
|
Н2SO4 |
FeS2 |
1 |
|
|
2 |
|
|
3 |
|
4 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Fe2O3 (огарок) |
|
|
|
|
|
|||
•1 –отделение (подсистема обжига колчедана), 2- отделение очистки обжигового газа, 3- подсистема окисления диоксида серы, 4- отделение абсорбции SO3.
•Обжиг серосодержащего сырья. Обжиг колчедана (пирита)
является гетерогенным химическим процессом, который описывается моделью «сжимающееся ядро».
•В промышленности обжиг ведут при 850-900 0C. Лимитирующая стадия процесса - внутренняя диффузия кислорода к поверхности свежего пирита и продуктов окисления в газовую фазу. При этих же температурах твердый компонент размягчается, что способствует слипанию его частиц. Эти факторы определили способ проведения процесса и тип реактора.
Организация процесса и реактор
Основной прием интенсификации гетерогенного процесса,
определяемый стадией внутренней диффузиейдробление
частиц. Мелкие частицы можно перерабатывать в кипящем (псевдоожиженном) слое, что реализовано в печах КС - кипящего слоя (рис.). Пылевидный колчедан подается через питатель в реактор. Воздух поступает через распределительную решетку со скоростью, достаточной для взвешивания твердых частиц. Их витание в слое предотвращает слипание и способствует хорошему контакту их с газом, выравнивается температурное поле по всему слою, обеспечивается подвижность твердого материала и его переток в выходной патрубок для вывода продукта из реактора. В слое подвижных частиц можно расположить теплообменные элементы, причем коэффициент теплоотдачи от псевдоожиженного слоя сравним с теплоотдачей от кипящей жидкости. Тем самым обеспечено эффективные теплоотвод из зоны реакции, управление его
температурным режимом и использование тепла реакции.
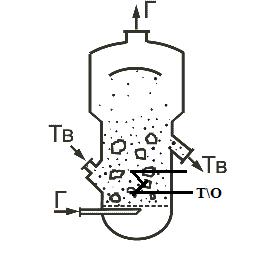
Реактор «КС»
•Основной недостаток печей КС - повышенная запыленность обжигового газа из-за механической эрозии подвижных твердых частиц. Это потребует более тщательной очистки газа от пыли - в циклоне и электрофильтре.
Окисление диоксида серы
• . Физико-химические свойства процесса. Реакция
• SO2 + 1/2O2 SO3 + Qр
•является каталитической, обратимой, экзотермической, протекает на катализаторе с уменьшением объема. Константа равновесия Кр пределяется из уравнения:
•
|
|
P |
, p |
|
|
K |
|
|
SO |
, |
|
p |
3 |
|
|||
|
|
|
|
||
|
P |
|
P |
|
|
|
|
, p |
, p |
||
|
|
SO |
O |
||
|
|
2 |
|
2 |
|
•Равновесную степень превращения диоксида серы xр получим из стехиометрического уравнения и условия
равновесия : |
|
|
|
Kp |
|||
|
xp |
|
|
||||
|
|
|
|
|
|
|
|
|
Kp |
1 |
0,5axp |
|
|||
|
|
||||||
|
|
P b 0,5axp |
|||||
|
|
|
|
||||
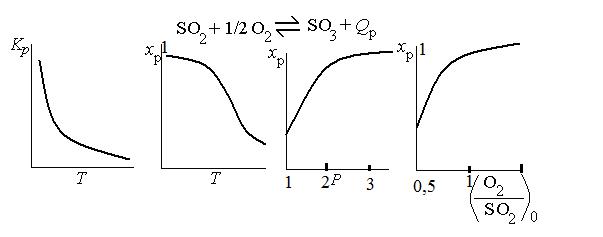
•Зависимости Кр, xp от температуры, состава реакционной смеси и давления, состава газа показаны на рис. (см. лекцию
«термодинамические закономерности»)
Кинетика реакции
•Скорость реакции r описывается уравнением:
|
|
|
P |
|
|
P |
|
|
r kP |
|
|
SO 2 |
|
1 |
SO 3 |
|
|
O |
|
|
|
|
|
|
|
|
|
2 |
P |
A' P |
|
KpP |
P |
||
|
|
SO 2 |
SO 3 |
|
|
SO 2 |
O2 |
|
или более простой и удобный вид уравнения для анализа r = (k1 + k 1) с0 (xp x)
