
- •Рас. 23. Схема почечного клубочка (Bargmann).
- •Воточного поворотного множителя
- •Состав некоторых веществ в плазме крови и в моче в процентах
- •Яичком и надпочечником (Nelson).
- •Количество микробов, обнаруживаемое в 1 и 10 полях зрения микроскопа
- •Зависимость количества колоний в различных секторах чашки Петри от интенсивности бактериурии
- •Артериографическая фаза в норме.
- •Метастазы рака мочевого пузыря в лимфатические узлы по ходу подвздошных сосудов (Alberti).
- •Жизни плода (Kelly- Burnam).
- •Транслюмбальная почечная ангиограмма. Артериографическая фаза.
- •Двусторонняя пиелограмма. Снимок сделан на одной пленке при вдохе и выдохе.
- •Почечная ангиограмма по Сельдингеру.
- •Рас. 149. Разрезы для вне-брюшного обнажения почки.
- •II. Опухоли почечной лоханки и мочеточника
- •Селективная почечная ангиограмма. Нефрографическая фаза.
- •Рас. 205. Этапы трансабдоминальной нефрэктомии.
- •Puс. 210. Рак стенки солитарной кисты почки.
- •Обзорная рентгенограмма (наблюдение в. Д. Грунд).
- •Нефрогенной гипертонии (см. Рис. 239).
- •Оглавление
- •Для заметок
Обзорная рентгенограмма (наблюдение в. Д. Грунд).
Клинические симптомы будут различны в зависимости от того, имеет ли место у больного закрытая гидатидозная киста почки или открытая, т. е. вскрывшаяся в мочевые пути. При закрытой кисте общее состояние больного и его трудоспособность нарушаются мало.
Заболевание обычно проявляется тупыми болями в поясничной области и подреберье. При больших размерах паразитарной кисты последняя может прощупываться; в таких случаях определяется округлая или овальная опухоль с гладкой поверхностью, упруго-эластической консистенции, безболезненная, подвижная. При кистах больших размеров, спаивающихся с диафрагмой или с печенью, больных может беспокоить одышка.
Если киста сращена с окружающими органами, подвижность ее ограничена или совсем отсутствует.
Клиническое течение при открытой форме кисты характеризуется болями типа почечной, resp. мочеточниковой, колики. Колика в таких случаях зависит от прохождения дочерних пузырей и их оболочек по мочевым путям. Моча может содержать дочерние пузыри целые либо лопнувшие, напоминающие шелуху винограда (гидатидурия), а также обрывки хитиновой оболочки. При открытом течении эхинококкоза почки иногда возникают дизурические расстройства. В случае нагноения кисты, при открытом ее течении, имеет место пиурия. Кратковременная макроскопическая гематурия наблюдалась некоторыми клиницистами вскоре после вскрытия кисты в мочевые пути (Surraco, 1954). При обтурации мочеточника дочерними пузырями в случае нагноения кисты могут возникнуть симптомы острого пиелонефрита.
Сравнительно редко наблюдается крапивница в противоположность печеночному эхинококкозу. На 58 случаев эхинококкоза почки, наблюдавшихся Surraco (1954), крапивница имела место только у 4 больных.
Более чем в половине всех случаев почечного эхинококкоза отмечается эозинофилия; частота ее колеблется между 5—12% в отличие от эхинококкоза печени, при котором она достигает высоких цифр (до 40%). Крапивница и эозинофилия при эхинококкозе — признаки не постоянные. Функциональная способность пораженной эхинококкозом почки страдает в различной степени и стоит в связи с локализацией кисты, ее раз-
мерами, количеством сохранившейся паренхимы, со степенью спаянности кисты с соседними органами и прочими осложняющими моментами (нагноение кисты, сопутствующий пиелонефрит и др.).
Моча при закрытой форме почечного эхинококкоза в большинстве случаев изменений не представляет.
В литературе имеются описания единичных случаев прорыва эхинококковой кисты почки в брюшную полость (анафилактический шок!), кишечник, плевральную полость, в желчные пути и даже наружу через кожные покровы.
Исключительно редко наступает самоизлечение при асептической гибели паразитарной кисты с последующим ее омелотворением.
Следует указать, что в настоящее время в связи с более совершенной диагностикой болезни открытые формы эхинококкоза почки встречаются много реже, чем это имело место в прежнее время.
ДИАГНОСТИКА
Распознавание эхинококкоза почки на основании только клинических данных представляется в большинстве случаев очень трудным. Болезнь часто длительное время протекает латентно.
Эхинококкоз почки приходится дифференцировать от гидронефроза, солитарной кисты, опухоли почки и опухолей забрюшинного пространства.
Симптом дрожания гидатид, обусловленный взаимным трением дочерних пузырьков в кисте при толчкообразном ощупывании, встречается очень редко. Наличие гидатидурии — бесспорный признак эхинококкоза почки, однако он имеет место при открытых формах болезни и то не всегда; при гидатидурии следует иметь в виду возможность попадания в мочу эхинококковых пузырьков и из ретровезикального пространства в случае локализации кисты в этой области,
В осадке мочи при открытом течении эхинококкоза почки можно обнаружить сколексы и крючья паразита.
Эозинофилия встречается нечасто и не является характерной только для эхинококкоза.
Весьма ценной для диагностики является интрадермальная реакция, предложенная итальянским врачом Casoni (1911). Эта реакция основана на резком проявлении местной анафилаксии при введении в кожу больного жидкости, полученной из эхинококкового пузыря. При эхинококкозе почки эта реакция бывает положительной в 90% случаев. Она оказывается отрицательной при умершей эхинококковой кисте и при ее нагноении. Реакция отклонения комплемента Вайнберга значительно уступает по точности реакции Казони.
Хромоцистоскопия в большинстве случаев указывает на нарушение, resp. снижение, функциональной способности почки, пораженной эхино-коккозом. В крайне редких случаях благодаря цистоскопии удается поставить диагноз, когда бывает видно выделение из мочеточникового устья цельных или лопнувших дочерних пузырьков или обрывков оболочек.
Несмотря на указанные признаки, решающим в распознавании эхинококкоза почки является рентгенологическое исследование и главным образом данные пиелографии. В случае обызвествления эхинококковой кисты на обзорной рентгенограмме бывает видна кольцеобразная тень соответственно стенке паразитарной кисты, содержащей известковые соли (рис. 221). По данным Surraco, это имеет место в 25,8% всех случаев почечного эхинококкоза.
Пиелографические данные во многом идентичны таковым при солитарной кисте почки, однако для эхинококкоза почки имеются и некоторые патогномоничные рентгенологические признаки. Так, в случае кальцификации кисты, как уже было упомянуто выше, на обзорном снимке может быть видна тень, окружающая кисту на всем ее протяжении или частично в виде полумесяца. Иногда при этом в центре кисты или по периферии ее имеются дополнительные бесформенные тени, соответствующие участкам обызвествления. При ретроградной пиелографии или экскреторной урографии в случаях закрытой формы эхинококкоза почки могут наблюдаться следующие варианты: 1) большая тонкая серповидная тень (рис. 222, А), располагающаяся преимущественно по латеральной стороне почки; иногда эта тень у своего основания является как бы деформированной, содержащей извилины, отдельные пятна (рис. 221); 2) сдавление одной или двух чашечек паразитарной кистой, вследствие на рентгенограмме вокруг одного из полюсов кисты имеется серповидная тень (рис. 222, Б); 3) лоханка принимает форму „пальцев сжатой руки" при локализации кисты в нижнем полюсе и наклонении последней вследствие этого кнаружи и при поднятии кверху.
Для открытой формы эхинококкоза почки характерны следующие два вида: 1) на фоне нежной тени выявляются небольшие плотные округлые очертания, напоминающие грозди винограда и обусловленные проникновением контрастной жидкости по периферии и вокруг дочерних пузырьков (рис. 222, В); 2) наличие тени контрастной жидкости в полости кисты с горизонтальным уровнем, а поверх плотной тени присутствие газа.
К. С. Керопиан указывает, что к 1930 г. только в 6% случаев ставился правильный диагноз при закрытой форме эхинококкоза почки. В настоящее время благодаря совершенствованию рентгеновских методов исследования в урологии правильная дооперационная диагностика почечного эхинококкоза возможна в 82% случаев (Surraco, 1954).
ЛЕЧЕНИЕ
Лечение почечного эхинококкоза оперативное. Подход к пораженной эхи-нококкозом почке экстраперитонеальный. Существовавшая ранее тенденция широко производить при почечном эхинококкозе нефрэктомию ничем не оправдана. Своеобразные особенности патогенеза и патологической анатомии гидатидозного эхинококкоза позволяют в большинстве случаев произвести операцию на почке органосохраняющего характера.
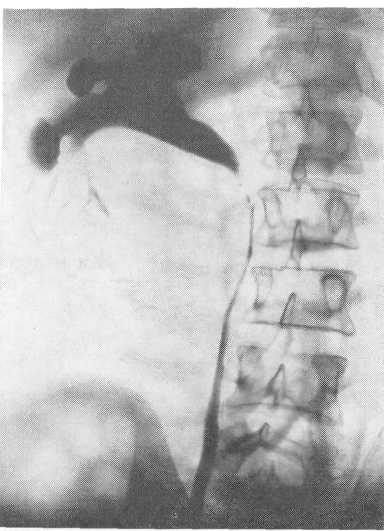
Рис. 221. Эхинококков почки. Обызвествление стенок паразитарной кисты. Ретроградная пиелограмма.
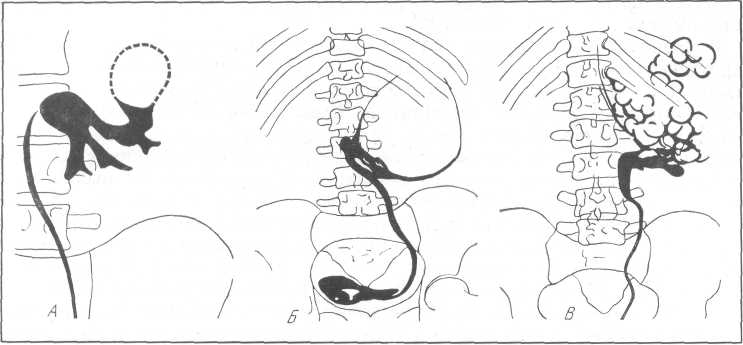
Рис. 222. Схемы рентгенологических изображений почечного эхинококкоза.
При расположении кисты в одном из полюсов почки может быть с успехом произведена резекция почкис полным удалением паразитарной кисты. Эту операцию за последние годы производят все чаще (Aschner и Gechman, 1956).
В последнее время при почечном эхинококкозе прибегают к эхино-коккэктомии, особенно в странах Южной Америки, где эхинококков широко распространен (Surraco, Pirez-Fontana, Kirkland, 1966). При этой операции удаляют целиком паразитарную кисту с окружающей ее фиброзной капсулой (энуклеация). Операция эта, по существу радикальная, весьма травматична и далеко не всегда может быть выполнена из-за опасности угрожающего кровотечения. Это обстоятельство, а также недоказанность экзогенного размножения в почке гидатидозного эхинококкоза у человека не позволяют считать эхинококкэктомию операцией выбора.
Наиболее показанной и за последние годы все чаще применяемой при почечном эхинококкозе является закрытая одномоментная эхинококкотомия (метод Боброва, Посадоса—Спасокукоцкого). После обнажения почки производят пункцию кисты и отсасывают из нее жидкое содержимое. Затем по той же пункционной игле вводят в полость кисты 1 или 2% раствор формалина или эфир с целью уничтожить жизнеспособность дочерних пузырей. Далее кисту вскрывают и удаляют ее содержимое вместе с хитиновой оболочкой и дочерними пузырями. Удалив паразитарную кисту, фиброзную капсулу протирают раствором формалина в глицерине и избыток капсулы, выстоящей над поверхностью почки, иссекают. Оставшуюся полость в почечной ткани закрывают путем сближения боковых стенок фиброзной капсулы кетгутовыми узловатыми или кисетными швами в несколько рядов, начиная со дна полости. Зашив наглухо почечную рану, к ней подводят лишь небольшой резиново-марлевый выпускник (А. Я. Пытель 1940; А. В. Голубчанская, 1955; Kairis, 1956; Meymerian с сотр., 1963).
Закрытая одномоментная эхинококкотомия должна являться операцией выбора при почечном эхинококкозе. Она не противопоказана при перфорации кисты в лоханку.
В случае нагноения эхинококкового пузыря в почке следует его опорожнить, удалить хитиновую оболочку и дочерние пузыри, а затем образовавшуюся полость в почке сузить швами и дренировать. Производить в таких случаях классическую марсупиализацию не следует (открытая одномоментная эхинококкотомия).
В прежние годы широко практиковалась при почечном эхинококкозе марсупиализация. При этой операции по вскрытии паразитарной кисты и максимальном удалении ее содержимого производят подшивание фиброзной капсулы к краям поясничной раны. В образовавшуюся полость почки после опорожнения кисты вводят дренажи или тампоны. Такое вмешательство весьма тягостно для больных, ибо оно сопровождается длительным послеоперационным периодом. На протяжении нескольких месяцев существуют незаживающие мочевые свищи, происходит медленное отторжение некротических масс и столь же медленное гранулирование раны. Марсупиализация показана лишь в исключительных случаях — при распространенном нагноительном процессе в паразитарной кисте и в почечной паренхиме, при плохой функции контралатеральной почки.
Нефрзктомия при почечном эхинококкозе показана при большом разрушении почечной паренхимы и далеко зашедшей атрофии ее, но при условии удовлетворительной функции второй, контралатеральной почки.
Выполняя нефрэктомию при открытом эхинококкозе, следует производить иссечение мочеточника на всем его протяжении, дабы избежать случайного оставления в нем дочерних пузырей (профилактика эмпиемы мочеточника).
При альвеолярном эхинококкозе почки показана только нефрэктомия.
Раннее распознавание эхинококкоза почки обеспечивает в большинстве случаев оперативное лечение органосохраняющего характера.
Прогноз в основном благоприятный.
Летальность после оперативного лечения почечного зхинококкоза за последние десятилетия значительно снизилась и в среднем составляет около 3%.
Литература
Викторов И., Полов Ц. иПатрашковТ. Урология, 1963, 1, 55.
ГолубчанскаяА. В. Урология, 1955, 4, 53.
Грунд В. Д. Урология, 1959, 2, 38.
Джавад-Заде М. Д. Хирургия, 1954, 1, 175.
Керопиан К. С. Эхинококк почки. Краснодар, 1930.
Клепиков Ф. А. и С т р е б к о в В. С. Клин, хир., 1965, 2, 42.
ОвнатанянК. Т. иСернякП. С. Урол. и нефрол., 1966, 1, 8.
ПытепьА.Я. Нов. хир. арх., 1940, 46, 2, 183 и 47, 3, 203.
П ы т е л ь А. Я. В кн.: Многотомное руководство по хирургии. Т. IX. М., 1959, стр. 300.
Я к и м и д и А. И. и П е с и н А. Л. Урол. и нефрол., 1967, 2.
A s с h n е г P. W. a. G е с h m a n В., J. Urol., 1956, 76, 1, 23.
DiazColodreroA. A. etMarrugatO. L., Rev. Medico-quirurg. path, fem., 1946,
25, 2, 120.
H ousel (1891). Цит. по М. Д. Джавад-Заде, 1954. Kairis Z. Урология, 1956, 4, 69. К i r k 1 a n d K., Brit. J. Urol., 1966, 38, 3, 241. KretschmerH. L. Surg. Gyn. Obst., 1923, 36, 2, 196. Meymerian В., Luttermoser G. W., F г а у h a G. J., S с h w a b e C. W. a.
Prescott В., Ann. Surg., 1963, 158, 211. N i с a i s e J. Цит. по К. С. Керопиан, 1930. S u г г а с о L. A., Le kyste hydatique des voies urinaires. Paris, 1954.
Глава восемнадцатая
Острая почечная
недостаточность
Острая почечная недостаточность — это обратимое глобальное поражение функций почек, возникающее в результате различных шокогенных воздействий — травматических, токсических, инфекционных и др., ведущих к острому нарушению почечного кровотока. В патогенезе острой почечной недостаточности известную роль играют такие факторы, как аноксия, повышение внутрипочечного давления, закупорка просвета канальцев, а также нефротоксическое воздействие некоторых веществ.
Клинические проявления острой почечной недостаточности являются выражением потери активной роли почек в выведении продуктов азотистого метаболизма, в сохранении водно-электролитных констант, щелочно-кислотного равновесия, нормотонии, в эритропоэзе. Результатами потери этих функций являются: скопление в организме большого количества продуктов азотистого метаболизма, глубокие изменения электролитного состава вне- и внутриклеточной жидкости, водного обмена, ацидоз, гипертония, анемия.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основная роль в патогенезе острой почечной недостаточности принадлежит шоку. При шоке в организме возникают резкие сдвиги нервного и гуморального характера, нарушение деятельности важнейших его органов и систем. В комплексе этих нарушений возникновение острой почечной недостаточности по существу носит вторичный характер. М. Г. Дурмишьян и Я. А. Эголинский (1938) показали, что так называемая болевая анурия — это явление вторичное. Возникновение анурии нельзя свести к одному рефлексу с места нанесения повреждения на нервы, иннервирующие почки; известно, что анурия наступает и при трансплантации почки на шею, когда нервы почки перерезаны. Все же доказательством ведущего значения воздействия через кору больших полушарий на почки является факт возникновения анурии при условнорефлекторном раздражении. Доказано, что острая почечная недостаточность при шоке происходит в результате неадекватных раздражений нервной системы, эффект которых передается на почку по вегетативным путям и через гормональную систему. Наряду с этим одной из основных причин так называемой болевой анурии является рефлекторная секреция антидиуретического гормона задней доли гипофиза. Исследования последних лет показали большую роль надпочечников в регуляции диуреза.
Установлено, что в первой фазе шока происходит спазм почечных сосудов, благодаря чему сохраняется минимально необходимый уровень кровоснабжения центральной нервной системы и сердечной мышцы. Следовательно, возникает своеобразное „самопожертвование почки" для спасения жизни больного. Оно выражается в том, что при общем снижении объема циркулирующей крови на 50% у больного, находящегося в состоянии шока, объем кровотока в почке уменьшается на 90—95%. В этой фазе острой почечной недостаточности нарушение деятельности почки наступает вследствие только функциональных изменений; прекращение или снижение диуреза обусловлено прекращением или уменьшением фильтрации крови в клубочках. Если неадекватное раздражение продолжается или оно с самого начала было очень сильным, то длительная ишемия почки и сопровождающая ее аноксия ведут к морфологическим изменениям эпителия и основной мембраны почечных канальцев. Нарушение диуреза в связи с этим становится следствием канальцевого повреждения (А. Я. Пытель, И. Н. Кучинский и Г. М. Чебанюк, 1965).
Для объяснения нарушения кровотока в почке при шоке, кроме спазма сосудов, имеют значение и учет своеобразной архитектоники почечного кровоснабжения, наличие негломерулярных артерио-венозных анастомозов и возможности шунтирования крови в обход клубочков. Эти анастомозы известны с конца прошлого столетия. Их описали А. Геберг (1885), В. 3. Голубев (1894), а в последующем Spanner (1924), А. С. Шубин (1952) и др. А. С. Шубин выявил в стенках артерио-венозных анастомозов почки рецепторные аппараты, осуществляющие их вазоконстрикцию, чем обеспечивается направление тока крови в сторону клубочков. Trueta и сотр. (1948) в условиях эксперимента было установлено, что длительное сдав-ление конечностей в результате импульсов, исходящих с поврежденной конечности, ведет к возникновению нервно-сосудистых рефлексов и шунтированию крови по сосудам, расположенным в мозговом веществе почки, в обход коркового вещества, с развитием ишемии последнего. В условиях опыта отмечалось прохождение артериальной крови по почечной вене и даже ее пульсация. Аналогичные данные были получены Trueta и сотр. при введении восприимчивым животным стафилококкового токсина; спустя 24 часа после введения последнего у животных наблюдали некроз кортикального вещества почек вследствие острого расстройства кровообращения. Значение обходного пути крови в почке было недавно показано в наблюдениях В. В. Серова и И. П. Соловьевой (1961). На основании морфологических изменений, найденных на секции умерших от острой почечной недостаточности, протекавшей по типу гепатореналь-ного синдрома, В. В. Серов и И. П. Соловьева пришли к выводу, что в результате кортикальной ишемии имеет место извращение юкстамедулляр-ного кровотока с преимущественным поражением дистальных канальцев. При этом возникают дистрофические изменения в эпителии канальцев вплоть до некроза, а также — разрыв базальной мембраны с последующей неизбирательной реабсорбцией, отеком межуточной ткани, внутрипочечной гипертензией, тромбозом мелких вен, закупоркой просвета канальцев кровяными сгустками, что проявляется олигоанурией. Указанные исследователи считают, что при гепаторенальном синдроме спазм почечных артерий возникает рефлекторно либо под воздействием сосудосуживающих токсических гуморальных факторов. К аналогичным выводам на основании многочисленных экспериментальных исследований и клинических наблюдений пришел еще в 1936 г. А. Я. Пытель. Несмотря на приведенные данные, роль шунтирования крови в патогенезе острой почечной недостаточности в условиях клиники вызывает некоторые сомнения. Vassalli и Richet (1960) считают, что острая почечная недостаточность возникает в результате остановки или замедления кровотока в мозговом слое почек, нарушения распределения крови в почках при шоке.
Имеются и другие высказывания о причинах поражения почки при шоке. Однако механизм этого поражения еще нельзя считать уточненным. Несомненно, что острая почечная недостаточность является в первую очередь следствием острого нарушения кровообращения в почках при шоке. Многочисленные опыты, во время которых осуществлялась анемизация почки путем пережатия ее артерии, показали, что ишемия ведет к нарушению функции, тем более тяжелому и необратимому, чем длительнее был период ишемии. Вредное воздействие ишемии заметно уменьшается в условиях гипотермии; это обстоятельство имеет большое практическое значение при оперативных вмешательствах, во время которых вынужденно прекращается кровоток в почке (операции на почечных сосудах, на аорте). Установлено, что сама гипертония не влияет отрицательно на функцию почек.
Интересные данные были получены и в экспериментах Davis (1960). Двух часовая ишемия в результате сдавления почечных сосудов приводила к гибели почти всех извитых канальцев. Сдавление сосудов под нембуталовым или уретановым наркозом не приводило к такому результату; даже после 3-часового сдавления почечных сосудов канальцы сохранялись. Местная же анестезия сосудистой почечной ножки оказалась неэффективной; при ее применении все же наступали деструктивные изменения в канальцах. Наряду с этим И. Л. Мастика (1965) показал профилактическое значение внутривенной перфузии гипертонического раствора маннита, а также введения гепарина при временном пережатии брюшной аорты.
Следовательно, в развитии некротических изменений в почечной ткани большое значение имеет продолжительность ишемии. У человека гипо-тензия приводит к некротическим изменениям почечной паренхимы, если она длится более 3—4 часов. Примером этому может служить кортикальный некроз почек (рис. 223). Однако продолжительностью гипотонии не исчерпываются условия возникновения острой почечной недостаточности. Весьма существенное значение имеют добавочные патологические факторы, протекающие одновременно с ишемией почки и имеющие зачастую точкой приложения почечную паренхиму. Мы имеем в виду в первую очередь прямое нефротоксическое воздействие и закупорку просвета почечных канальцев (гемо- и миоглобин). Оба этих фактора усугубляют поражение почки в условиях ее ишемии. Их патогенетическое значение меньше, чем значение самой ишемии, однако совокупность перечисленных факторов влияет отрицательно на почечную паренхиму.
Прямым токсическим воздействием на почки обладают ртуть, свинец, щавелевая кислота, четыреххлористый углерод, сульфаниламиды и др., а также бактерийные токсины (рис. 224).
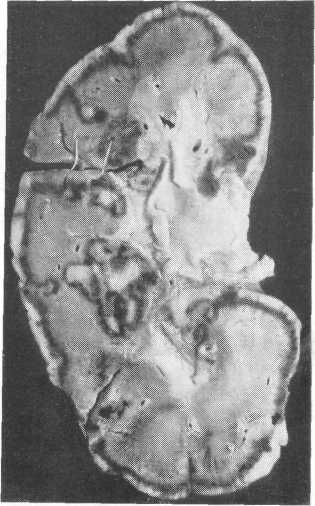
Рис. 223. Некроз коркового вещества почки. Макропрепарат.

Рис. 224. Локализация нефротоксических поражений в различных сегментах нефрона в зависимости от вида яда или токсина. Зоны наибольших поражений канальцев обозначены черным цветом (Oliver).
1 — двухромовокислый калий; 2 — ураляитрат; 3 — сулема; 4 — калиево-натриевый битартрат; 5 — хромистый калий; в — диэтиленгликол; 7 — четыреххлористый углерод; 8 — отравление грибами; 9 — Serin; 10 — сульфаниламиды.
Свободный гемоглобин также обладает некоторым нефротоксическим воздействием на эпителий канальцев. Мнение Hamburger (1962) о большой токсичности гемоглобина для почечной клетки находится в противоречии с экспериментами Finele (1953), который для удобства биопсий ставил опыты на собаках с предварительно выведенной под кожу почкой; животным внутривенно вводили гемоглобин. Спустя час в канальцах были отмечены незначительные изменения, а через 3 часа в них откладывался гемоглобин. Спустя 96 часов канальцы оказывались нормальными, клубочки оставались интактными. В литературе имеется еще ряд высказываний о безвредности свободного гемоглобина. Пагубное воздействие гемоглобина на почки наступает лишь в условиях шока, обезвоживания; это лишний раз показывает, что одним из основных моментов в патогенезе острой почечной недостаточности является ишемия.
Закупорка просвета канальцев наступает при некрозе со слущиванием почечного эпителия, выпадении в просвет канальцев глыбок гемоглобина или миоглобина (Crush syndrome), кристаллов сульфаниламидных препаратов. Значение окклюзии канальцев было подчеркнуто в ряде докладов о физиопатологии острой почечной недостаточности на XIII Международном конгрессе урологов в Лондоне (Guevara-Rojas, 1964).
В генезе острой почечной недостаточности немаловажную роль имеет фактор повышенного внутрипочечного давления.
Просачивание жидкости через нарушенную базальную мембрану почечных канальцев ведет к отеку межуточной ткани, что усугубляет ишемию вследствие сдавления кровеносных и лимфатических сосудов, а также канальцев.
Как видно из изложенного, в патогенезе острой почечной недостаточности участвуют различные механизмы, главнейшими из которых следует признать нарушение кровообращения в почке, а также нефротоксическое воздействие ряда веществ на эпителий канальцев. Описанные механизмы оказывают зачастую влияние на почки в различной сочетанности и последовательности. Так, пищевая интоксикация может привести к острой почечной недостаточности в результате коллапса и нарушения почечной гемодинамики, а также токсического воздействия на почки. К этому присоединяется нарушение водно-электролитного баланса из-за сопровождающей пищевую интоксикацию рвоты. У больных острой почечной недостаточностью, возникшей после приехма сульфаниламидных препаратов, также имеют место ишемия почки, нефротоксическое воздействие, закупорка просвета канальцев выпавшими кристаллами препарата, поражение клубочков аллергического характера, внутрисосудистый гемолиз.
Множественность причин отмечена нами у подавляющего большинства больных острой послеоперационной почечной недостаточностью: потеря крови, переливание несовместимой крови, недостаточное восполнение водно-электролитных потерь, шок, наконец, предшествующая латентная гепато- и нефропатия. Наши наблюдения последних лет позволяют уделять все большее внимание последней причине — латентной гепатопатии и нефропатии в возникновении острой почечной недостаточности (А. Я. Пытель и С. Д. Голигорский, 1965).
КЛАССИФИКАЦИЯ
Установление множества этиологических факторов острой почечной недостаточности послужило поводом к созданию большого числа классификаций этиопатогенетических причин, приводящих к острому нарушению деятельности почек. Острая почечная недостаточность может наступить в результате различных физических травм, в том числе и операционной, ожога, переливания несовместимой крови, повторных профузных кровотечений (например, маточно-плацентарных), чрезмерной инсоляции, различных токсемии, микробных инвазий (особенно часто при септическом аборте), нарушений электролитного и водного состава жидкостей организма.
Некоторые классификации предложены с учетом только этиологического фактора, другие основаны на сочетании последнего с морфологическими изменениями почек. Так, Olanescu с сотр. (1959) описывают 17 видов острой почечной недостаточности, основанных на типе морфологических изменений и этиологических факторов.
Обобщение основных сведений об этиологии и патогенезе острой почечной недостаточности позволяет представить следующую классификацию.
ЭТИОПАТОГЕНВТИЧЕСКАЯ КЛАССИФИКАЦИЯ ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ
ПРЕРЕНАЛЬНЫЕ ФАКТОРЫ
Резкое снижение артериального давления. Шок, уменьшение объема циркулирующей крови (ишемия, гипоксия, гормональная дисрегуляция).Сюда относятся: острая кровопотеря, травматический шок, операционный шок.
Акушерские осложнения (отслойка плаценты, послеродовое кровотечение, аборт).
Гемолиз и миолиз (гемоглобинурический и миоглобинурический нефроз). Переливание несовместимой крови.
Синдром размозжения (Crush syndrome), нетравматическая ишемия мышц. Электротравма. Распространенные ожоги.
Абсорбция гипотонических растворов (трансуретральная резекция простаты с гемолизом в результате промывания раневой поверхности дистиллированной водой).
Большая потеря электролитов. Обезвоживание.
Длительная рвота.
Профузный понос
Ожоги.
Обезвоживание в результате больших операций.
Длительное применение диуретиков, слабительных средств.
Эндогенные интоксикации.
Кишечная непроходимость. Перитонит.
Гепаторенальный синдром (острый панкреатит и др.).
Гестозы. Токсикозы беременных.
РЕНАЛЬНЫЕ ФАКТОРЫ
1. Специфические нефротоксические и нефросенситивные поражения почек
Нефротоксикоз.
Отравление ртутью.
Отравление четыреххлористым углеродом.
Отравление ураном.
Отравление кадмием.
Отравление хромом.
Отравление хлороформом.
Отравление фосфором.
Отравление ядовитыми грибами и др.
Токсико-аллергические поражения.
Сульфаниламиды.
Антибиотики.
Барбитураты.
Салицилаты.
Коллоидное золото.
Висмут и др.
Инфекция.
Анаэробная (септический аборт).
Геморрагическая лихорадка (лептоспироз).
Пиелонефрит (некротический папиллит).
Пневмония.
Сепсис и др.
Процессы, окклюзирующие мочевые пути (экскреторная анурия).
Двусторонняя закупорка мочеточников камнями.
Аденома, рак простаты и др.
Сдавление мочеточников опухолью, исходящей из органов таза.
2. Острая почечная недостаточность, осложняющая существующее почечное заболевание.
Приведенная классификация позволяет объединить клинику наиболее близких друг к другу по этиологии, патогенезу и симптоматологии клинических форм острой почечной недостаточности.
СИМПТОМАТОЛОГИЯ И КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Клиническая картина острой почечной недостаточности чрезвычайно разнообразна; она слагается из признаков нарушенной деятельности почек и симптомов основного заболевания. Клиническое течение острой почечной недостаточности носит цикличный характер. Принято рассматривать 4 стадии острой недостаточности почек: начальную, олигоанурическую, стадию восстановления диуреза и выздоровления.
Большое практическое значение имеет разграничение стадии восстановления диуреза от стадии выздоровления. Клиничесгаш опыт и данные лабораторных исследований убедительно показывают, что восстановление диуреза еще не означает истинное выздоровление. Значительное число летальных исходов приходится на период восстановления диуреза, когда больной выделяет мочу, но она весьма низкой концентрации и, следовательно, почки по-прежнему не могут выделять в должной мере продукты метаболизма и способствовать нормализации электролитного состава плазмы.
Стадия I (начальная) острой почечной недостаточности. На первый план в клинической картине выступают симптомы шока, расстройства со стороны нервной системы и гемодинамики. На фоне шока выявляются первые признаки острого нарушения деятельности почек — олигурия, анурия. В случае дегидратации, вызванной длительной рвотой или поносом, отмечаются жажда, сухость во рту. Обязательным признаком является снижение артериального давления. Большое значение для суждения об интенсивности возникающей гипотонии имеет знание врачом уровня артериального давления, бывшего у больного до развития почечной недостаточности. У гипертоников, находящихся в состоянии шока, артериальное давление может казаться нормальным, хотя произошло его резкое -снижение. По данным Atlas и Gaberman (1958), симптомы шока могут развиться при снижении артериального давления с 210/110 до 110/70 мм рт. ст.
В I, начальной, стадии почечной недостаточности наибольшее значение имеют гемоконцентрация, определяемая с помощью гематокрита и подсчета количества эритроцитов (часто свыше 6 млн. в 1 мл), и метаболические нарушения, вызванные, по-видимому, аноксией тканей. Насыщение артериальной крови кислородом нормальное, тогда как насыщение кислородом венозной крови очень низкое. Имеется наклонность к ацидозу. Гликемия сначала бывает повышенной, а затем снижается вследствие уменьшения резервов гликогена в печени. Нарушение белкового обмена ведет к повышению количества аминокислот в кровяной плазме. В ней также повышается количество неорганических фосфатов и сульфатов. Часто уже в первой стадии почечной недостаточности отмечается тенденция к гиперкалиемии и снижению щелочного резерва плазмы. Тяжесть перечисленных изменений зависит от формы шока и от его степени. Наиболее постоянными являются гемоконцентрация, гипергликемия и тенденция к ацидозу.
В I стадии почечной недостаточности морфологические изменения со стороны почки либо отсутствуют, либо весьма незначительны. Основная тяжесть клинических проявлений зависит от шока, а не от поражения почек. Если наступает смерть, то она также является результатом шока.
После выведения больных из шокового состояния у большинства из них функция почек восстанавливается, у некоторых — начинают выступать на первый план клинические признаки острой почечной недостаточности, т. е. начинается II стадия — олигоанурическая. Длительность олигоанурической стадии колеблется от нескольких дней до 3 недель и даже более [в наших наблюдениях — до 36 суток, Alwall (1964) приводит описание больного, у которого олигоанурия длилась до 84 суток], в среднем 14 дней. Характерным морфологическим поражением в этой стадии является повреждение канальцевого эпителия и канальцевой базальной мембраны. Морфологические изменения, приводящие к острой почечной недостаточности, принято подразделять на ишемические и нефротоксические.
Ишемические изменения сказываются в поражении тубулярного аппарата: разрывы базальной мембраны и некроз эпителиальных клеток. Повреждения стенок канальцев могут отмечаться на всем их протяжении или же между зонами повреждения имеются участки интактной стенки. Первоначально было высказано предположение о преимущественном поражении дистальной части нефрона, это дало основание многим морфологам и клиницистам обозначать такие поражения „нефрозом дистального нефрона". Разрушение базальной мембраны имеет особое значение с точки зрения возможности восстановительного процесса. В месте разрушения базальной мембраны возникает обычно выраженный воспалительный процесс в межуточной ткани (рис. 225).
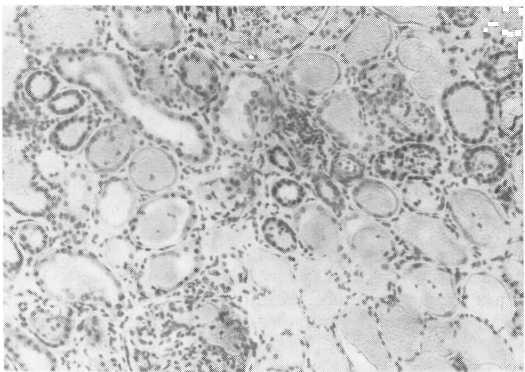
Рис. 225. Некроз эпителия извитых канальцев. Микрофото.
Нефротоксические изменения, связанные с воздействием различных отравляющих веществ, преобладают или локализуются исключительно в проксимальной части нефрона. Токсические вещества выделяются мальпи-гиевыми клубочками и оказывают воздействие главным образом на начальный сегмент канальцевого аппарата. В клетках возникают дегенеративные процессы вплоть до некроза (рис. 226). Ранее считалось, что при нефроток-сических воздействиях базальная мембрана не страдает; новейшие исследования при помощи микродиссекции показали, что обычно к токсическому воздействию яда присоединяется ишемия, вследствие чего в этих случаях возникают почечные поражения как нефротоксического, так и ишемичес-кого типа (А. Я. Пытель и С. Д. Голигорский, 1963).
Клиническая картина олигоанурической стадии слагается из признаков задержки в организме продуктов азотистого обмена и нарушения водно-электролитного равновесия, выражающихся симптомами нарушения деятельности нервной системы, сердечно-сосудистого, пищеварительного аппарата, изменениями со стороны крови. Большое место в клинической картине могут занимать признаки первичного основного заболевания, приведшего к острой почечной недостаточности. Основным признаком в этой стадии почечной недостаточности является олигурия или анурия. Редко острая почечная недостаточность протекает при нормальном диурезе (например, при ожогах).
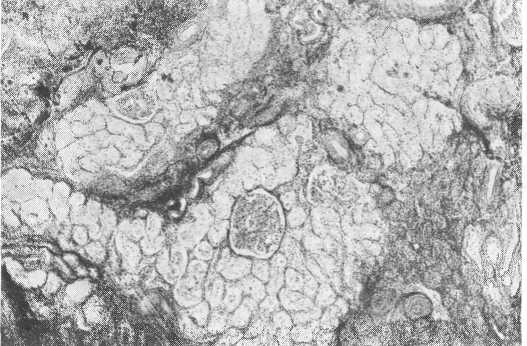
Рис. 226. Острая почечная недостаточность. Почечная биопсия. Микрофото.
Общее состояние больного обычно тяжелое. Имеет место выраженная астения. Температура нормальная или пониженная. Повышение температуры обычно является признаком инфекционного осложнения. На фоне острой почечной недостаточности и снижения реактивности организма инфекционные осложнения протекают с незначительным повышением температуры. Вот почему даже незначительным ее колебаниям следует придавать особое значение. Однако у некоторых больных и без признаков инфекции можно отметить умеренное повышение температуры и лейкоцитоз. У больных, у которых острая почечная недостаточность наступила в результате сепсиса после аборта, температура может быть высокой, но в таких случаях ее повышение связано не с острой почечной недостаточностью, а с первичным воспалительным очагом.
Большое значение в развитии почечной недостаточности имеют различные гуморальные сдвиги. Hamburger с сотр. (1960) и другие клиницисты доказали, что нарушения метаболизма воды часто возникают в результате острой почечной недостаточности и в равной мере нарушения этого метаболизма могут, в свою очередь, вызвать острую почечную недостаточность. Нарушения водного обмена идут одновременно с изменением обмена электролитов. Внеклеточная дегидратация обычно равнозначна потерям хлористого натрия, а внеклеточная гипергидратация — его недостаточному выведению. В свою очередь, изменения внеклеточного сектора влияют на состояние внутриклеточного.
Вода составляет 50—70% веса тела (этот процент выше у худых, ниже — у тучных лиц). Вода распределяется между внутриклеточным сектором (40—50% веса тела) и внеклеточным (16—22%). Потери воды отражаются быстро на общем состоянии организма. Дефицит 1500 мл воды составляет приблизительно 2% веса тела, что ведет к небольшой жажде; потери 4200 мл воды (6% веса тела) — к сильной жажде, снижению количества слюны, сухости рта, олигурии и общей слабости; при потере 5000—10 000 мл воды (7—14% веса тела) указанные симптомы становятся более выраженными, состояние больного становится тяжелым, наблюдаются галлюцинации и бред.
Почки играют активную роль в сохранении воды в организме и ее выведении В норме вода переходит из внутриклеточного во внеклеточный сектор и обратно в основном в результате изменений осмотического давления. В патологических условиях передвижение воды из одного сектора в другой зависит, по-видимому, и от нарушений клеточного метаболизма.
О роли клеточного катаболизма в изменениях гидратации говорят следующие наблюдения Hamburger с сотр. (1962). У больных острой почечной недостаточностью в течение периода анурии образуется в среднем 243 г мочевины. При разрушении 100 г тканей организма происходит катаболизм 25 г белков, что ведет к образованию 8,5 г мочевины, при этом из тканей высвобождается 75 мл воды. Одновременно в результате окисления белков добавочно образуется на каждый 1 г белков 0,41 мл воды. Таким образом, в результате катаболизма тканей при образовании 8,5 г мочевины высвобождается и образуется 85 мл воды. При расчете, что за период анурии образуется в среднем 243 г мочевины, следует, что за это время высвобождается и образуется 2430 мл воды.
Жировая ткань содержит мало воды, но окисление 1 г жиров ведет к образованию 1,07 мл воды. Следовательно, окисление разрушенных жиров ведет к образованию еще 6000 мл воды. Другими словами, катаболизм тканей ведет у больных острой почечной недостаточностью к образованию более 8 л воды, количеству весьма внушительному, которое следует принимать в расчет при определении водного режима этих больных.
Возможные виды нарушения водного баланса организма представлены на следующей схеме.
Схема нарушений водного баланса организма
(по Hamburger)

Внеклеточная дегидратация наступает при потерях воды и особенно хлористого натрия. Больные жалуются на прогрессирующую общую слабость. Тургор кожи и тонус глазного яблока у них снижены. Артериальное давление понижено. Может наступить периферический коллапс и развиться острая почечная недостаточность. В результате потерь хлористого натрия снижается осмотическое давление плазмы. Определение хлора и натрия плазмы не дает полного представления о степени их дефицита потому, что у больных имеется всегда сгущение крови. До возникновения анурии можно получить более точное представление о дефиците натрия и хлора по определению их в моче. Внеклеточная дегидратация с потерей хлористого натрия приводит к повышению азотемии за счет увеличенного катаболизма тканей и недостаточного выведения мочевины. Азотемия бывает выше у больных с одновременной внутриклеточной гипергидратацией. В основе возникновения так называемой хлорпенической почки лежит внеклеточная дегидратация.
Клеточная дегидратация — результат либо потерь воды, либо избытка хлористого натрия во внеклеточном секторе, т. е. повышения его осмотического давления (при недостаточности сердца, почек, некоторых неврологических заболеваниях — менингите, в послеоперационном периоде вследствие нарушений механизмов, регулирующих выделение хлористого натрия). Потери воды особенно ощутимы при наличии одновременной поли-урии (хронический нефрит с полиурией, диабетическая кома). Признаками клеточной гипогидратации являются: сероватая окраска кожных покровов, западение и гипотония глазных яблок, повышение температуры, часто сопровождающееся повышенным лейкоцитозом с полинуклеозом. Потеря в весе значительная. При выраженной дегидратации появляются признаки поражения нервной системы — астения, сонливость с периодами возбуждения, мышечные подергивания; могут наблюдаться нарушения психики, кома. Со стороны пищеварительного тракта—жажда, сухость слизистых оболочек, анорексия, иногда дисфагия. У некоторых больных отмечаются нарушения ритма дыхания. Лабораторно определяется повышение эффективного осмотического давления плазмы.
Гипергидратация клеточного сектора возникает в результате нарушения равновесия между количеством вводимой в организм и выводимой из него воды или же при значительной потере электролитов со снижением осмотического давления плазмы и переходом воды из внеклеточного в клеточный сектор. Такое состояние возникает вследствие потери соли через пищеварительный тракт, недостаточности надпочечников, при заболеваниях нервной системы, нефропатиях. При острой почечной недостаточности гипергидратация клеточного сектора может возникнуть в результате избыточного введения в организм воды, особенно раствора глюкозы (каждый грамм глюкозы при сгорании ведет к образованию 0,55 г воды). Больные жалуются на общую слабость, утомляемость. Температура остается нормальной, но может быть пониженной. Артериальное давление обычно нормальное, иногда повышенное. Отмечаются признаки поражения нервной системы: мышечные непроизвольные сокращения, невралгии, головные боли, психические нарушения, кома. Наиболее характерными при этом бывают симптомы со стороны пищеварительного тракта. При умеренной гипергидратации клеточного сектора больные жалуются на отсутствие аппетита, тошноту, рвоту. Возникает порочный круг: рвота, являющаяся следствием гипергидратации клеточного сектора, приводит к потере электролитов, а это ведет в итоге к усугублению внутриклеточной гипергидратации. Отмечаются снижение эффективного осмотического давления плазмы, гипонатриемия, снижение содержания гемоглобина. Гипергидратацию клеточного сектора Hamburger (1960) образно назвал „отравлением водой" организма.
Olanescu с сотр. (1959) различают два вида внеклеточной гипергидратации. При первом имеет место увеличение количества воды и интерстици-альной ткани без увеличения ее в плазме, что клинически проявляется отеками. При втором — увеличение количества воды в плазме, что наблюдается при сердечной недостаточности или после избыточного введения кортикостероидов, либо при острой почечной недостаточности, когда больному вводят излишнее количество воды и соли.
Характерными нарушениями при острой почечной недостаточности являются изменения со стороны электролитного состава плазмы.
Установлено, что ионы натрия, хлора и бикарбоната обеспечивают 85% общего осмотического давления плазмы, остальные 15% относятся к другим ионам и недиссоциированным веществам. Глюкоза и мочевина имеют лишь небольшое значение в обеспечении осмотического давления плазмы, что объясняется, с одной стороны, их диффузионными свойствами, а с другой — большей молекулярной массой. Так, молекулярная масса глюкозы приблизительно в 3 раза больше массы хлористого натрия; к тому же хлористый натрий находится в плазме в виде ионов хлора и ионов натрия. Другими словами, при одинаковой концентрации хлористый натрий влияет на осмотическое давление в 6 раз больше глюкозы. К этому добавляется указанное выше свойство глюкозы к диффузии. Практически осмотическое давление глюкозы и мочевины равно нулю. Поэтому осмотическое давление плазмы можно высчитать путем дозирования важнейших электролитов или с помощью криоскопии. В норме осмотическое давление плазмы равно 0,55°. Увеличение осмотического давления — гипертония плазмы — ведет к клеточной дегидратации, уменьшение или гипотония плазмы — к внеклеточной дегидратации, часто с внутриклеточной гипергидратацией. Осмотическое давление плазмы принято измерять миллиосмолами. Миллиосмол — тысячная часть осмола, т. е. осмотического давления, развивающегося при растворении одной грамм-молекулы в 1 л воды.
За исключением]ионов калия, кальция и, в меньшей мере, магния, которые обладают определенными физиологическими свойствами и благодаря этому могут непосредственно влиять на клетки и ткани, остальные ионы имеют значение в основном вследствие определенного уровня их концентрации в плазме, чем обеспечивается ее осмотическое давление. Избыточное накопление ионов фосфата, сульфата и органических кислот харак-ерно для метаболического ацидоза, ионов бикарбоната — для дыхательного.
При острой почечной недостаточности наблюдается снижение количества основных трех ионов плазмы: натрия, хлора и бикарбоната. Тем самым уменьшается количество электролитов плазмы в целом. В среднем вместо обычных 310 м-экв./л при острой почечной недостаточности электролите-мия выражается цифрами порядка 286—296 м-экв./л. Осмотическое давление еще более снижено, чем электролитемия, в связи с увеличением количества двухвалентных ионов. Гипертония плазмы при острой почечной недостаточности наблюдается лишь у больных, которым ошибочно назначают обильное введение гипертонических растворов или проводят избыточную дегидратацию при применении методов внепочечного очищения.
Основным катионом плазмы является натрий; его концентрация вместе с хлором фактически определяет величину осмотического давления плазмы. Колебания концентрации натрия и хлора не всегда протекают параллельно. Ионы хлора могут выводиться независимо от ионов натрия. Хлор замещается широко ионами НСОз. Замещение натрия может происходить за счет ионов калия, кальция или магния, однако малое количество последних ограничивает возможность замещения натрия. Экономия ионов натрия обеспечивается почечной канальцевой реабсорбцией. У взрослого человека нормальный баланс натрия может сохраняться при введении в сутки всего 0,5 г хлористого натрия. При бессолевой диете резервы натрия начинают снижаться на 30—-40-й день. Если потери натрия происходят внепочечным путем, снижение уровня натрия плазмы происходит быстро, в силу чего наступают изменения водного баланса, нарушается функция почек. Дальнейшее снижение резервов натрия наступает при ацидозе, когда теряется способность почек регулировать кислотно-щелочное равновесие путем замещения ионов натрия ионами водорода или аммония. В свою очередь, возникновение острой почечной недостаточности на почве недостатка соли и дегидратации способствует дальнейшей потере электролитов вследствие частой рвоты и поноса. Значительная потеря натрия имеет место в III стадии острой почечной недостаточности, которая характеризуется поли-урией. Гипонатриемия клинически проявляется быстрой утомляемостью, апатией, потерей аппетита, головокружениями, обмороками.
Большое значение в клиническом проявлении острой почечной недостаточности имеют изменения содержания в плазме калия. Калий участвует в обмене белков, в синтезе гликогена. Он является медиатором в деятельности вегетативной первной системы, влияет на мышечную систему, в частности на миокард. Калий пищи (калий находится почти во всех продуктах питания) выделяется в основном почками (почти 90%). Калий находится главным образом в клетках. В клеточной жидкости его концентрация достигает 112—150 м-экв./л. Во внеклеточной жидкости — всего лишь 3,5—5,3 м-экв./л. По количественному определению калия в плазме нельзя иметь точное представление о его содержании в клеточном секторе. Существует тесная связь между метаболизмом натрия и калия, что имеет большое значение для выяснения некоторых патофизиологических процессов. Введение при ацидозе больших доз натрия (в виде бикарбоната или цитрата) ведет к его миграции в клеточный сектор и вытеснению из него калия. При хорошей функции почек калий выделяется ими и может возникнуть гипокалиемия, а при почечной недостаточности — гиперкалиемия. При острой почечной недостаточности в период олигоанурии отмечается обычно гиперкалиемия, которая с восстановлением диуреза переходит в гипокалие-мию. Однако такое чередование не обязательно. Не у всех больных острой почечной недостаточностью отмечается выраженная гиперкалиемия; последняя характерна для почечной недостаточности, протекающей с высоким катаболизмом белков, при котором высвобождается калий (при обширных ожогах, травмах с размозжением мягких тканей, травматическом и, в частности, послеоперационном шоке). Гемолиз также ведет к высвобождению значительного количества калия, что имеет место после переливания несовместимой крови, анаэробном сепсисе после аборта, гемолитической анемии. При остром гемолизе с разрушением 60% эритроцитов высвобождается до 5 г калия, что может привести к смерти. Гиперкалиемия может возникнуть и при переливании одногруппной крови после длительной ее консервации. Значительно реже гиперкалиемия наблюдается у больных острой почечной недостаточностью вследствие отравлений и интоксикаций (если интоксикация не ведет к гемолизу). Гиперкалиемии способствуют ацидоз и гипергидратация внутриклеточного сектора. Нет параллелизма между степенью азотемии и гиперкалиемии, хотя у большинства больных при высокой азотемии имеется и высокая гиперкалиемия. Клинически гиперкалиемия проявляется признаками поражения нервной системы и сердечной мышцы: общая слабость, парестезии, снижение сухожильных рефлексов, иногда параличи, брадикардия, аритмия, сердечная недостаточность. Однако у ряда больных клинические проявления гиперкалиемии незначительны, хотя ее опасность весьма велика. У больных острой почечной недостаточностью гиперкалиемию определяют дозированием калия плазмы. В определении калиемии используют и электрокардиографию. На электрокардиограмме выявляются типичные изменения: заострение зубца Т, снижение интервала S—Т, удлинение расстояния Р—R. В последующем зубец Р исчезает. Нарастание гиперкалиемии ведет затем к расширению QRS, его двухфазности, нарушению ритма сердца. Нарастающая блокада может привести к остановке сердца в диастоле. Не всегда рост калиемии приводит к летальному исходу. Известны случаи острой почечной недостаточности, протекающей у больных с высокой гиперкалиемией и закончившейся благополучно. Опасность гиперкалиемии зависит от сопутствующих нарушений (ацидоз, степень концентрации других электролитов и катаболитов) и погрешностей в ведении больного (гипергидратация, введение в организм больного солей калия в периоде олигоанурии). Не следует забывать, что при острой почечной недостаточности не может иметь место изолированное нарушение метаболизма одного электролита; клиника недостаточности слагается из множественных метаболических нарушений, в том числе и обмена кальция.
Не весь кальций плазмы физиологически активен. Часть его связана с белками плазмы и не активна. Полностью ионизирован лишь хлористый кальций, частично — другие его соединения. При острой почечной недостаточности наблюдается обычно гипокальциемия. Снижение белков плазмы ведет к снижению его неионизированной доли, а увеличение количества неорганических фосфатов и сульфатов — изменению рН ионизированной крови. Вследствие ацидоза имеется пропорциональное увеличение ионизированной доли кальция, благодаря чему не наблюдается признаков тета-
нии. Повышенная возбудимость больных находит свое объяснение в низкой концентрации ионизированного кальция в спинномозговой жидкости. Гипокальциемия может быть также результатом введения больным больших доз цитрата натрия при обменных переливаниях крови. Гипокальциемия ведет у ряда больных к изменениям электрокардиограммы —удлинению QT и особенно ST.
Длительная гиперкальциемия (гиперпаратиреоз, отравление витамином D, саркоидоз, обширные костные разрушения) также может быть причиной возникновения острой почечной недостаточности.
Магний занимает значительное место среди электролитов внутриклеточного сектора организма — 35 м-экв./л и небольшое во внеклеточном — 1,5 м-экв./л; 15—20% последнего связано с белками, остальная часть ионизирована. Количество магния при почечной недостаточности может быть нормальным, пониженным или повышенным. Гипомагниемия — результат поносов и отсутствия магния в вводимой в организм больного жидкости. Гипермагниемия наблюдается при гипогидратации, повышенном введении солей магния. Гипомагниемия может быть причиной тетании, нарушения психики; гипермагниемия вызывает сонливость, коматозное состояние.
Для острой почечной недостаточности характерна гипохлоремия; количество хлора плазмы снижается до 80—90 м-экв./л. Известны случаи гипохлоремии порядка 50—60 м-экв./л. Основной причиной резкого снижения концентрации хлора являются его потери с рвотой. Zosin (1958) объясняет гипохлоремию миграцией хлора из внеклеточного сектора в клеточный. Большое значение при этом имеет увеличение количества ин-терстициальной жидкости, в результате чего возникает не глобальное, а пропорциональное снижение хлора (гипергидремия — результат катаболизма тканей и избыточного введения воды). Гипохлоремия возникает с первых дней острой почечной недостаточности и в последующем подвергается небольшим колебаниям, зависящим в значительной мере от метода лечения.
Анионы плазмы представлены главным образом анионами хлора. Остальные разделены приблизительно поровну между НСОз и так называемой фракцией R (rest-fraction). Последняя состоит из РО4Н, SO4, органических кислот и щелочного эквивалента белков плазмы. В норме эта фракция равняется в среднем 25 Мэкв./л. Анионы НСО3 являются мобильными. Их количество приспосабливается к вариациям хлора и R-фракции. Уменьшение последних компенсируется в норме увеличением НСО3 и наоборот. У больных острой почечной недостаточностью R-фракция увеличивается, а количество хлора и НСОз снижается. Уменьшение количества ионов НСОз означает снижение щелочного резерва плазмы.
Между уровнем рН плазмы и ее щелочным резервом нет обязательного параллелизма. Единственным точным критерием определения щелочно-кислотного равновесия является рН. Возможен ацидоз при нормальном и даже повышенном щелочном резерве. Клинически невозможно определить нарушения кислотно-щелочного равновесия, так как гипервентиляция может отсутствовать при ацидозе, а тетания — при алкалозе (например, при гиперкапнии). У больных острой почечной недостаточностью постоянно наблюдается увеличение анионов R-фракции, несмотря на уменьшение количества ионов хлора, для уравновешивания количества катионов происходит уменьшение щелочного резерва. Этот приспособительный механизм, сохраняющий обычную реакцию внутренней среды, нарушается при тяжело протекающих формах почечной недостаточности, когда происходит понижение как рН, так и щелочного резерва. У больных острой почечной недостаточностью, протекающей со значительным расстройством
дыхания, происходит нарушение выделения СО2 через легкие, что ведет к увеличению щелочного резерва при снижении рН плазмы. Zosin считает, что в клинических условиях, когда имеется ясное представление о причине нарушения щелочно-кислотного равновесия, можно ограничиться только определением щелочного резерва. В других случаях определение рН плазмы обязательно, так как в противном случае можно не заметить опасности ацидоза.
У ряда больных острой почечной недостаточностью алкалоз возникает в результате введения большого количества двууглекислого натрия, обменных переливаний крови. При обменном переливании крови, когда больному вводят до 6 л крови, одновременно поступает в организм большое количество цитрата натрия (84 м-экв./л натрия). К алкалозу могут привести также обильная рвота, длительная абсорбция желудочного содержимого, особенно в послеоперационном периоде. Алкалоз нередко наблюдается в период восстановления диуреза, когда он приходит на смену ацидозу.
Белки плазмы играют большую роль как важнейший фактор регулирования объема крови. В крови содержится 70—80 г белков на 1 л, а в интерстициальной жидкости — всего несколько граммов на 1 л. Этим объясняется большая разница в онкотическом давлении и притяжении воды. Потери белков поэтому ведут к отекам, гемоконцентрации, падению количества циркулирующей крови, к коллапсу. Отеки особенно характерны для хронической белковой недостаточности, а гемоконцентрация — для острой. Однако гипопротеинемия может отсутствовать при пропорциональных потерях организмом белков и воды. Поэтому параллельно следует определять гемоконцентрацию, гематокрит.
При острой почечной недостаточности обычно имеет место небольшая гипопротеинемия. Согласно данным Ргоса (1957), протеинемия при острой почечной недостаточности снижается до 15 м-экв./л вместо обычных 16 м-экв./л и лишь в редких случаях гипопротеинемия достигает 11 м-экв./л. В период олигоанурии иногда наблюдается на фоне гемолиза гиперпротеинемия. Исключение- составляет гемолиз при септическом аборте, при котором заболевание протекает с особо выраженной гипопроте-инемией, что можно объяснить быстрым разрушением гемоглобина. В период восстановления диуреза гипопротеинемия часто сменяется гипер-протеинемией. Извращается соотношение альбуминов к глобулинам вследствие повышения количества альфа- и гамма-глобулинов и снижения количества альбуминов. Отсутствие гипергаммаглобулинемии имеет плохое прогностическое значение.
Постоянным признаком острой почечной недостаточности является повышение содержания в плазме азота, которое можно определить дозированием мочевины либо остаточного азота. Большинство нефрологов считает вполне достаточным количественное определение мочевины плазмы. Фактически большая часть азота плазмы, исключая азот белков плазмы, приходится на долю мочевины. Только при одном условии определение мочевины может дать неправильные показания. Известно, что последние этапы образования мочевины происходят в печени. Если одновременно с острой почечной недостаточностью имеется заболевание печени, то количество мочевины в плазме может либо не повыситься, либо повыситься в меньшей мере, чем это соответствует степени почечной недостаточности; зато произойдет рост количества других продуктов азотистого обмена, особенно аминокислот. Ввиду этого у больных острой почечной недостаточностью, протекающей с поражением печени, целесообразнее определять остаточный азот.
Повышение количества мочевины плазмы объясняется отсутствием возможности выведения ее из организма — повышенным образованием ее за счет катаболизма белков тканей. В норме существует равновесие между количеством вводимого с пищей азота и катаболизмом тканей. Примером подобных состояний может служить так называемая хлорпеническая почка. Hamburger (1960) рекомендует следующую формулу для определения эндогенной фракции азота мочевины, позволяющей судить о размерах катаболизма тканей больного. Мочевина благодаря ее большой диффузионной способности распределена приблизительно одинаково в жидкостях организма, поэтому достаточно умножить общее количество жидкости на содержание мочевины в плазме. Количество жидкости составляет приблизительно 60% веса тела. Если за 24 часа, к примеру, количество мочевины увеличилось на 20 г, а с мочой выделилось 15 г, то это означает, что за эти 24 часа образовалось в общем 35 г мочевины. Из этого количества нужно вычесть экзогенную фракцию (количество мочевины, образующейся из белков пищи) и результат укажет на уровень эндогенной мочевины. Вычисление производят по формуле:
эндогенная
фракция = 0,6 Х(Р2
— Р1)+Е![]() ,
,
где X — вес тела;
А — количество белков пищи в граммах;
Е — количество мочевины в моче в граммах;
Р1 — мочевина плазмы в начале исследования;
Р2 — мочевина плазмы в конце исследования.
В нормальных условиях имеет место образование 5 г эндогенной мочевины в сутки. Для того чтобы получить представление о возможных нарушениях, достаточно указать, что при ожогах происходит распад 80—100 г белков, что составляет 500 г ткани в сутки.
При наличии острой почечной недостаточности, протекающей с сохранением диуреза, Hamburger придает большое значение количеству мочевины за 24 часа, нежели ее концентрации в моче. Он считает, что если количество мочевины в моче значительно, значит функция почек еще удовлетворительная, даже при наличии высокой азотемии, и, наоборот, при низком содержании мочевины в моче — функция почек тяжело поражена, несмотря на умеренную азотемию. В этих случаях несоответствие между поражением почек и высотой азотемии, как уже указывалось, объясняется интенсивностью катаболизма тканей. Hamburger придает также большое значение определению клиренса мочевины; при острой почечной недостаточности количественное определение мочевины плазмы дает представление об азотистой ретенции, сравнение же мочевины плазмы и мочевины мочи позволяет определить, в какой степени азотемия зависит от нарушения функции почек и в какой — от избыточного образования мочевины в организме.
При острой почечной недостаточности параллельно с повышением количества мочевины имеет место увеличение содержания в плазме и других продуктов азотистого обмена: креатинина, креатина, мочевой кислоты. Повышается также содержание ароматических веществ.
Основными гематологическими нарушениями в период олигоанурии являются: анемия, повышенная кровоточивость и в меньшей мере повышенный лейкоцитоз. Анемия наступает в результате нарушения эритро-поэза, уменьшения длительности жизни эритроцитов, а также гемолиза у больных с гемолитическими изменениями. Различные кровотечения (носовое, желудочно-кишечное, пурпура) наступают чаще в течение 2-й недели олигоанурического периода. Они находят свое объяснение в повышенной хрупкости капилляров, ибо как длительность кровотечения и свертывания крови, так и протромбиновый индекс и количество тромбоцитов остаются в пределах нормы. У ряда больных вне инфекционных осложнений наблюдается высокий лейкоцитоз, который может сочетаться с нейтрофильным полинуклеозом. Лейкоцитоз может достигать 20 000 и более в 1 мм.
У больных острой почечной недостаточностью повышение артериального давления — симптом не постоянный. Гипертония может быть результатом задержки соли и воды во внеклеточном секторе или повышенного выделения прессорного вещества в кровь в результате почечной ишемии. Последним фактором можно объяснить возникновение гипертонии в первые дни заболевания. Е. М. Тареев (1958) сравнивает гипертонию при полном прекращении выделительной функции почек с аренальной гипертонией.
У больных наблюдается тахикардия. При возникновении сердечной недостаточности уменьшается наполнение пульса, отмечается уменьшение систолического и диастолического давления. Некоторые клиницисты прибегают к прощупыванию пульса сначала в положении больного лежа, а затем после приподнятая его головы и туловища. Малое наполнение пульса в положении лежа, становящееся еще более выраженным после приподнятая туловища, указывает на опасность коллапса. Состояние периферических вен может служить показателем нарушения равновесия воды. В норме подкожные вены быстро опорожняются при поднятии вверх верхних конечностей и заполняются вновь за 3—5 секунд после их опускания. При значительной гипогидратации заполнение вен происходит лишь за 10— 12 секунд. У некоторых больных заполнения вен вообще не происходит. Замедленное опорожнение вен при поднятии конечности говорит о гипергидратации (Schreiner и Maher, 1961).
Дыхание обычно учащенное в результате ацидоза. В тяжелых формах болезни, в прекоматозном состоянии наблюдается куссмаулевское или чейн-стоксово дыхание.
У 57% больных острой почечной недостаточностью I стадии (олигоан-урическая) и II стадии (восстановление диуреза) имеет место общая гипергидратация, которая отягощает .течение заболевания и может привести к летальному исходу. В то время как клинические признаки скрытой гипергидратации (тахикардия, повышенное артериальное давление и др.) непостоянны, рентгенологические изменения со стороны органов грудной клетки, ретроперитонеального пространства и почек позволяют сравнительно рано распознать органную и общую гипергидратацию.
Весьма ценными диагностическими признаками скрытой гипергидратации являются: „Fluid lung" — „водяные легкие" (Alwall, 1964), выпот-ной плеврит, выпотной перикардит, ретроперитонеальный отек и увеличение размеров почек. Эти признаки могут наблюдаться отдельно и в сочетании друг с другом.
Наличие рентгенологического признака „Fluid lung" с несомненностью указывает на гипергидратацию организма. Он наблюдается у половины больных острой почечной недостаточностью. В зависимости от интенсивности изменений в легких следует различать I, II, III степень феномена „Fluid lung" — „водяные легкие".
Среди существующих теорий патогенеза „Fluid lung" — „водяного легкого" — наиболее приемлемой являетя токсико-гипергидратационная теория (А. Ф. Даренков, 1964). У больных острой почечной недостаточностью вследствие интенсивного катаболизма происходит накопление в крови значительного количества азотистых шлаков, токсических продуктов, а также образование большого количества свободной жидкости. Легкие являются органом, способным замещать некоторые функции почек благодаря сли-зисто-белковым железам, способным элиминировать токсические вещества и тем самым взять на себя утраченную выделительную функцию почек.
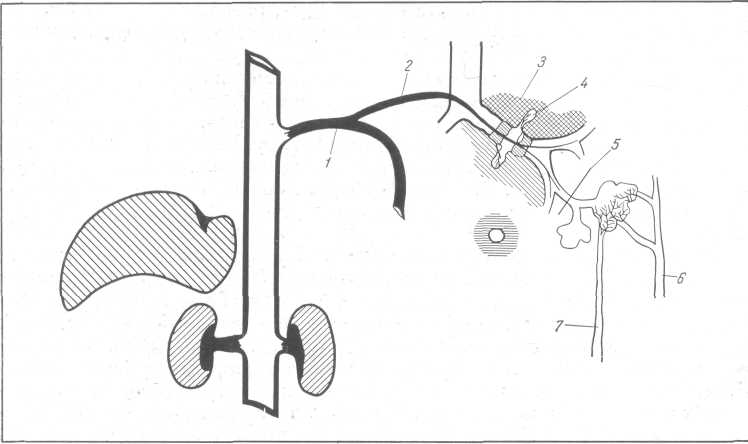
Рис. 227. Уремический отек легкого (А. Ф. Даренков).
1 — межреберная артерия; 2 — бронхиальная артерия; 3 — токсический интерстициальный отек; 4 — слизисто-белковые железы; S — респираторный бронх; в — легочная вена; 7 — легочная артерия; S — бронх.
Вследствие притока большого количества катаболических продуктов к слизисто-белковым железам происходит токсическое поражение питающих их бронхиальных артерий. Одновременно повышается систолическое давление в железах за счет накопления в них низкомолекулярных соединений. Повышение осмотического градиента влечет увеличение притока к слизисто-белковым железам воды, которая проникает в интерстициальное пространство бронхов как через нарушенную стенку артерий, так и из клеток гипергидрированных слизисто-белковых желез (рис. 227). Последние расположены преимущественно в рыхлых соединительнотканных межхрящевых пространствах, и жидкость может легко проникать во все ин-терстициальные перибронхиальные щели. Бронхиальные артерии и слизисто-белковые железы распространяются до респираторного отдела, вследствие чего накопление воды может происходить только в центральных отделах легкого. Рентгенологический феномен „Fluid lung" обусловлен уплотнением тканей центральной зоны легких за счет накопившейся в ней жидкости. Вся кортикальная зона легких, которая снабжается легочной артерией (система малого круга кровообращения) не подвергается гипергидратации и поэтому остается свободной от рентгенологических изменений (рис. 228, 229). Скопление жидкости по ходу бронхов, идущих в сагиттальном направлении, выявляется на рентгенограммах либо в виде очаговых пятен, либо в виде облаковидных теней. Бедная клиническая картина „водяного легкого" обусловлена тем, что просвет бронхов остается „сухим", в то время как интерстиций их гипергидрирован. Наличие у больного „Fluid lung" требует срочных лечебных мер.
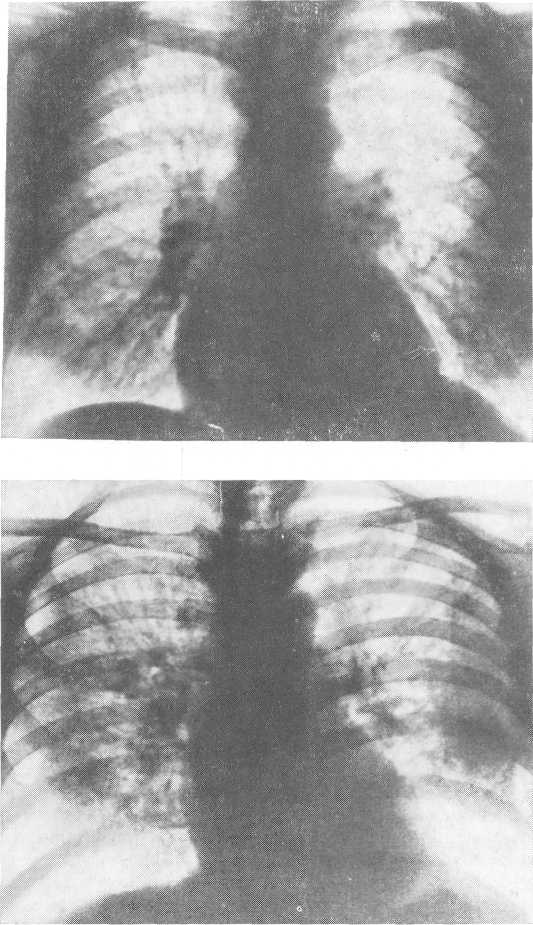
Рис. 228. Уремический отек легкого, II стадия по Alwall.
Рис. 229. Уремический отек легкого, III стадия по Alwall.
Своевременная дезинтоксикация, которая приводит к уменьшению осмотического давления в слизисто-белковых железах, и дегидратация обеспечивают быстрое исчезновение рентгенологических признаков „водяного легкого". Тщательный рентгенологический контроль и периодические взвешивания на специальных весах являются эффективными средствами, позволяющими следить за водным балансом больных как в олигоанурической, так и полиурической фазах болезни, и делают возможным предотвратить грозные проявления гипергидратации. Имеется параллелизм между снижением веса тела больного (находившегося в состоянии гипергидратации) и уменьшением рентгенологически устанавливаемых легочных изменений типа „Fluid lung". Снижение веса тела больного наступает либо в результате искусственно вызванной диареи или ультрафильтрации при помощи искусственной почки. Легочные осложнения типа „Fluid lung" при своевременном проведении соответствующей терапии у 65% больных подвергаются обратному развитию.
Известное диагностическое значение имеет рентгенологическое определение размеров почек. Почки оказываются увеличенными в I и II стадии острой почечной недостаточности у 32% больных. Увеличение почек в олигоанурической стадии обусловлено глубоким нарушением координированной работы противоточно-множительной системы почки вследствие уменьшения кровяного дебита в vasa recta и увеличения осмотического давления в интерстициальной ткани. Это происходит вследствие нарушения системы пассивного перехода воды из vasa recta в интерстиций и далее в просвет канальцев и наоборот. Уменьшение притока жидкости из сосудистого русла в интерстициальное пространство области петли Генле способствует быстрому повышению осмотического давления в клетках эпителия нисходящего отдела канальца и активной реабсорбции воды из его просвета. Моча в нисходящем отделе канальца и колене петли Генле становится более гипертоничной. Относительный избыток ионов натрия быстро реабсорбируется в восходящем отделе петли Генле, который непроницаем для воды, но обладает факультативной способностью поглощать натрий.
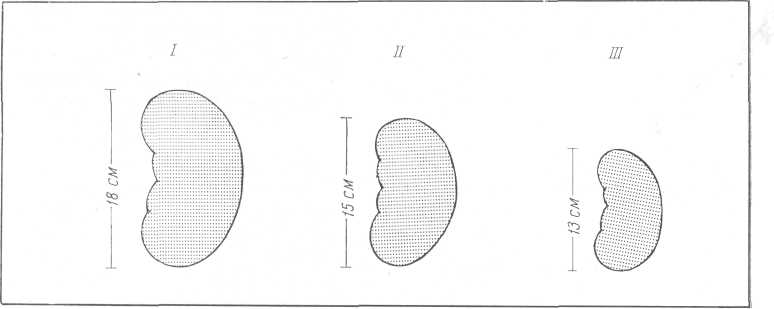
Рис. 230. Изменение рентгенологических размеров почек у больных острой почечной недостаточностью. Объяснения в тексте.
Данное явление способствует увеличению и без того высокого осмотического давления в интерстиций. Вследствие этого интерстициальная ткань почки превращается в мощный насос, извлекающий жидкость из просвета канальцев, притом в огромных количествах. Создается парадоксальное явление: имея большое количество жидкости, почка не в состоянии выделить ее. Она как бы тонет в жидкости и, перегруженная ею, намного увеличивается в размерах. Только значительной гипергидратацией можно объяснить быстрое и относительно безболезненное увеличение такого плотного паренхиматозного органа, как почка. По мере нарастания острой почечной недостаточности вода из интерстициальной ткани почки проникает в сосудистое русло почки, а также в околопочечную и ретропе-ритонеальную клетчатку. Вследствие этого ретроперитонеальное пространство превращается в резервуар, способный вместить большие количества избыточной жидкости. У 29% больных острой почечной недостаточностью рентгенологически определяется ретроперитонеальный отек. В стадии восстановления диуреза размеры почек весьма быстро уменьшаются, достигая нормальных величин в стадии выздоровления. Согласно наблюдениям урологической клиники II Московского медицинского института средние размеры почек у больных острой почечной недостаточностью таковы: в олигоанурической стадии длина почки 18 см, в стадии восстановления диуреза — 15 см, в стадии выздоровления — 13 см (А. Ф. Дарен-ков, 1966) (рис. 230).
Болезнь в олигоанурической стадии, особенно при очень высокой и затяжной азотемии, может осложниться стоматитом, паротитом, панкреатитом, изъязвлениями слизистой оболочки желудка и кишечника с возникновением желудочно-кишечных кровотечений перикардитов.
Стадия III острой почечной недостаточности знаменуется восстановлением диуреза (при анурии) или его значительным увеличением (при олигу-рии). С первых же дней этой стадии количество мочи за сутки достигает 2— Зли более. Моча низкого удельного веса —1002—1003. Несмотря на восстановление диуреза, функциональная недостаточность почек все же сохраняется: азотемия в начале этой стадии остается еще значительной, имеются нарушения водно-электролитного баланса. Больные теряют большое количество воды и соответственно снижается вес тела. Потеря воды наблюдается у всех больных, в том числе и у тех, которым был обеспечен правильный водный режим во время стадии олигоанурии. Речь здесь идет о воде, образовавшейся и накопившейся в организме в результате окисления белков, углеводов и жиров. Снижение веса может достигнуть 10 кг.
У многих больных в этой стадии происходят большие потери калия с мочой: на смену гиперкалиемии приходит гипокалиемия, которая клинически проявляется астенией и гипотонией скелетных мышц, их парезом. Гипотония может распространяться и на дыхательные мышцы. При дальнейшем снижении калиемии возникают вялые параличи с исчезновением сухожильных рефлексов. Характерные изменения наблюдаются со стороны сердечной мышцы. На электрокардиограмме отрезок ST прогрессивно стирается, уменьшается амплитуда зубца Т, который становится изоэлектри-ческим, а иногда и отрицательным, увеличивается в несколько раз зубец V. Происходит расширение сердца со снижением артериального давления. Появление аритмии является признаком опасности остановки сердца в диастоле. При значительно выраженной гипокалиемии течение заболевания может осложниться паралитическим илеусом, расширением желудка. Гипокалиемия протекает обычно на фоне алкалоза и сочетается с гипокаль-циемией.
У некоторых больных в фазе восстановления диуреза ацидоз сменяется алкалозом (Derot с сотр., 1961), проявляющимся головными болями, нарушением сознания вплоть до психоза. В результате сопутствующего снижения ионов кальция у больных наступают признаки тетании.
В начале III стадии продолжающиеся нарушения водно-солевого обмена столь велики, что ряд больных погибает, несмотря на восстановление диуреза. При благополучном течении заболевания концентрационная способность почки, ее роль в водно-солевом равновесии улучшаются, что ведет к постепенному выравниванию содержания электролитов, снижению азотемии, исчезновению изменений со стороны форменных элементов крови. В этой стадии в виде позднего осложнения может возникнуть тенденция к кровотечению и вторичной анемии. В конечной стадии острой почечной недостаточности анемия может быть следствием электробластопении.
Стадия IV острой почечной недостаточности — стадия выздоровления. В зависимости от тяжести заболевания стадия выздоровления длится до 6 месяцев, иногда и больше. К концу ее восстанавливается равновесие электролитов, количество мочевины приходит к норме, однако почечные пробы на очищение, а нередко и проба Зимницкого указывают на остаточные умеренные нарушения функции почек. Исследование раздельно функций почек показывает, что остаточные могут наблюдаться и спустя 3 года после возникновения острой почечной недостаточности, несмотря на отсутствие клинических признаков болезни. У больных, у которых ранее не было заболевания почек, функция последних обычно восстанавливается полностью. У тех больных, у которых острая почечная недостаточность раз-
вилась на фоне ранее существовавшего заболевания почек или мочевых путей, часто остается длительное время более выраженное снижение функциональной способности почек по сравнению с исходными данными.
Итак, острая почечная недостаточность имеет циклическое течение, проходит через ряд стадий и у значительного числа больных завершается при условии правильного ведения и применения современных методов лечения выздоровлением. Однако летальность при ней еще высокая. Смерть наступает в I стадии острой почечной недостаточности в результате причинного заболевания, во II и III стадии — от нарушения водно-электролитного баланса и глубокой интоксикации организма вследствие накопления в крови продуктов метаболизма.
клинические формы
острой почечной недостаточности
Hamburger (1960) описывает два вида клинических форм острой почечной недостаточности в соответствии с органическим или функциональным характером почечного поражения.
К органическим поражениям он относит: 1) острый канальцевый нефрит (токсические канальцевые нефропатии, нефропатии при гемолитических процессах, состояниях шока и других различных острых заболеваниях); 2) острый гломерулонефрит; 3) острый интерстициальный нефрит; 4) поражения мочевыводящих путей; 5) инфаркт почки, тромбоз почечных вен и двусторонний кортикальный некроз.
К поражениям функционального характера Hamburger относит нарушения обмена воды и электролитов, коллапс. Derot и Prunier (1963) рассматривают 5 основных клинических форм: 1) анурия вследствие нарушения почечного кровообращения; 2) анурия вследствие первичного нарушения водно-солевого обмена; 3) анурия вследствие урологических заболеваний; 4) анурические нефриты, пиелонефрит, сосочковый некроз; 5) острые канальцевые нефропатии и гепатонефриты. Ргоса (1957) различает 7 клинических форм острой почечной недостаточности: 1) почечная недостаточность в основном нейрогенного происхождения (рефлекторного характера); 2) почечная недостаточность, связанная с нарушением кровообращения (снижение артериального давления, асистолия, инфаркт почки, инфаркт миокарда); 3) почечная недостаточность вследствие первичного нарушения равновесия электролитов; 4) почечная недостаточность в результате острого канальцевого нефрита (сюда же относится и послеоперационная острая почечная недостаточность); 5) почечная недостаточность, обусловленная острым гломерулонефритом или пиелонефритом; 6) почечная недостаточность, возникшая вследствие урологических заболеваний; 7) острая почечная недостаточность неизвестной причины.
Приведенные разграничения клинических форм острой почечной недостаточности имеют определенные достоинства, ноне лишены и существенных дефектов. Деление Hamburger грешит в том смысле, что далеко не всегда удается провести грань между функциональными и органическими поражениями почек. При описании органических почечных поражений в одну группу входят токсические и различные посттравматические формы заболевания. Между тем, по крайней мере с точки зрения клинического течения, между ними имеются определенные различия.
Derot и Prunier, говоря о различных видах анурии, пользуются устаревшей терминологией. В предложенную ими группу острых канальцевых нефропатии, основанную больше на признаке морфологических нарушений, локализации их, опять-таки входят разнообразные клинические формы. В классификации Ргоса сначала берется за основу функциональный этиологический момент (первые 3 группы), затем — морфологические изменения. Вряд ли можно объединить в одну группу все формы острого нарушения артериального давления, приводящего к почечной недостаточности в результате асистолии или инфаркта почки. Нельзя также согласиться с отнесением к группе острого канальцевого нефрита всех случаев послеоперационной острой почечной недостаточности, при которой нервный механизм играет исключительно большую роль. Кроме того, не ясна грань между первой и второй группой. Несомненно, что нервный фактор является основным в возникновении сосудистых нарушений, приводящих к падению артериального давления.
Исходя из указанного и руководствуясь в основном удобствами клинических требований, мы считаем наиболее приемлемой из предложенных классификаций клинических форм острой почечной недостаточности классификацию Е. М. Тареева (1958), тем более что она учитывает одновременно и особенности патогенеза.
Е. М. Тареев выделяет 5 клинических групп острой почечной недостаточности: 1) поражение почек при массивном гемолизе — гемолитическая почка; 2) травматическая уремия; 3) поражение почек при обесхлоривании и обезвоживании — хлорпеническая почка; 4) поражение почек при различных интоксикациях; 5) поражение почек при инфекциях.
Правда, и эта классификация не охватывает все многообразие клинических форм острой почечной недостаточности. Так, известно, что ряд инфекционных и токсических поражений сопровождается гемолизом. Выше было указано на возможность сочетания разных патогенетических механизмов в возникновении острой почечной недостаточности. Но все же приведенная классификация в настоящий момент больше других удовлетворяет клиницистов. Мы позволили себе лишь добавить к ней еще шестую группу — острую почечную недостаточность, возникающую при урологических заболеваниях.
Острая почечная недостаточность
в результате водно-электролитных нарушений
«Азотемия вследствие недостатка соли» известна давно. Клинический опыт последних двух десятилетий показывает, что острая почечная недостаточность может возникнуть в результате нарушения водного обмена, извращенного обмена хлористого натрия, калия, значительно реже — других электролитов.
Дегидратация и потеря соли являются причиной возникновения выраженного катаболизма тканей и нарушения функций почек. Последнее следует объяснить расстройством почечного кровотока нервно-сосудистого характера (Е. М. Тареев) и в известной степени гуморальными факторами. Большие потери натрия вводят в действие экономящий натрий механизм — гиперсекрецию альдостерона, повышенную реабсорбцию натрия и воды дистальными сегментами почечных канальцев. Снижается диурез, но уменьшается и количество выделяемой мочевины. Нарастает азотемия, что, в свою очередь, вызывает усиление рвоты. В итоге создается порочный круг.
Острая почечная недостаточность наблюдается при потерях воды и соли пищеварительным трактом, кожей и почками у больных со стенозом привратника, нарушением проходимости кишечника, перитонитом, различными интоксикациями, у больных с продолжительным поносом, длительной аспирацией желудочного и кишечного содержимого в послеоперационном периоде, иногда при кишечных свищах, обильном потоотделении, заболеваниях почек с большой потерей соли, при длительном бессолевом режиме.
Потеря воды и электролитов при частой рвоте у больных стенозом привратника желудка приводит к различным нарушениям в зависимости от причины стеноза — рака или язвы. У больных язвой имеется гиперсекреция и повышенная кислотность желудочного сока; в результате частой рвоты потеря электролитов у них более значительная. Кроме того, они теряют больше ионов хлора, чем ионов натрия, что способствует возникновению алкалоза. При стенозе желудка и больных раком желудочный сок содержит мало соляной кислоты (или вообще ее не содержит), вследствие чего не наступает нарушений кислотно-щелочного равновесия. Le Quesne (1961) отмечает, что в начальных стадиях алкалоза у больных с язвенным стенозом привратника и обильной рвотой моча щелочная. Это рассматривается им как компенсаторный механизм. Однако позже наблюдается парадоксальное явление; несмотря на алкалоз, моча становится кислой реакции. Такое явление можно объяснить гипонатриемией и гипокалиеми-ей, а также задержкой натрия вследствие повышенного выделения альдостерона. Последний ведет к увеличению калиурии, даже при гипокалиемии, что является добавочной причиной нарушения электролитного баланса.
Длительно частый понос различного происхождения, в том числе и потери жидкости, связанные с частым применением слабительных, также ведут к потерям воды и электролитов. При различных пищевых интоксикациях понос нередко сочетается со рвотой, и потери воды и электролитов тогда чрезмерны.
При тяжело протекающих заболеваниях нарушения почек перестают носить функциональный характер; в почках могут возникнуть органические изменения вплоть до некроза канальцевого эпителия. Гистологические исследования показывают, что некроз может наблюдаться в любом сегменте канальца и что зоны некроза чередуются с зонами регенерации. Наиболее часто некротические изменения в канальцах наблюдаются при поносах у детей. При алкалозе могут отлагаться соли кальция в петле Генле и в дистальном сегменте нефрона. Есть основание считать, что при некоторых видах острой почечной недостаточности в основе нарушения кровообращения в почке и возникновения органических изменений находится первичное поражение почек (А. Я. Пытель, 1936; Fishberg, 1954).
К аналогичным результатам могут привести длительный бессолевой режим и потери соли через почки. Понятно, что бессолевой режим приводит быстрее к азотемии у тех больных, у которых еще сохранилась в достаточной мере выделительная функция почек, особенно в случае так называемого „нефрита с потерей натрия". .
Характерная картина хлоргидропенической почки наблюдается у некоторых больных вследствие лечения ртутными мочегонными. Как известно, последние имеют выраженный натриуретический эффект; потери натрия превалируют над потерями хлора, поэтому заболевание протекает с явлениями ацидоза. Терапия меркузалом может привести к столь плачевным результатам у больных, которым лечение проводилось без достаточных к тому показаний или же без должного контроля.
Итак, потери воды, натрия, гипер- или гипокалиемия могут стать причиной острой почечной недостаточности с высокой азотемией. По-видимому, основными патогенетическими механизмами являются: уменьшение кровотока в почках, ишемия, нервные и эндокринные воздействия, первичное нарушение функции печени. К счастью, нарушение функции наступает далеко не у всех больных стенозом привратника, перитонитом и т. д. Большое значение имеет интенсивность потерь за короткий промежуток времени. У больных стенозом привратника, находящихся в состоянии крайнего истощения," но со рвотой не более 2—3 раз в сутки, зачастую нарушения функции почек не наступает. У них имеет место олигурия,
связанная с недостаточным поступлением жидкости в организм, однако концентрационная способность почек остается удовлетворительной и содержание мочевины в сыворотке крови не выходит за пределы нормы. Когда же рвота повторяется многократно в течение суток, что вызывает за короткий промежуток времени потерю очень большого количества воды и электролитов, подобные потери представляют для организма чрезвычайную опасность и вызывают глубокие изменения гемодинамики, нарушение функций печени и почек. Другим важнейшим фактором является фон, на котором возникают потери воды и электролитов. Острая почечная недостаточность развивается более часто вследствие гидро-электролитных потерь в послеоперационном периоде, когда эти потери воздействуют на фоне нарушений гомеостаза, связанных с самим оперативным вмешательством или с осложнениями послеоперационного периода. О роли фона говорит и более тяжелое течение заболевания в раннем детском возрасте, у лиц с заболеваниями нервной системы.
Острая почечная недостаточность вследствие гемолитического шока
Гемолиз и острая почечная недостаточность наблюдаются при ряде инфекционных заболеваний, интоксикациях и индивидуальной тенденции к гемолизу. Так, гемолиз и острая почечная недостаточность осложняют течение септического аборта, реже малярии, пневмонии. Они могут возникнуть после приема хинина, сульфаниламидных препаратов, у больных парок-сизмальной гемоглобинурией при охлаждении (иногда — инсоляции), при аноксии вследствие пребывания на больших высотах, после весьма длительного и тяжелого физического напряжения. Классическим примером так называемой гемолитической почки является острая почечная недостаточность, обусловленная переливанием несовместимой крови (по групповой несовместимости или резус-фактору).
Экспериментальные исследования и клинические наблюдения над больными, которым было произведено переливание несовместимой крови, позволили коренным образом пересмотреть представление о патогенезе почечной недостаточности при гемолизе. Оказалось, что переливание несовместимой крови больным, находившимся в состоянии наркоза, иногда может не отразиться на функции почек, а новокаиновая блокада почечной ножки или спинномозговая анестезия устраняют анурию, возникающую после внутривенного введения гемолизированной крови. Наблюдения А. Л. Петрова (1959) над больными, которым с лечебной целью вводили несовместимую кровь в количестве 40—100 мл, показали, что медленное введение этой крови не приводит к йарушению мочеотделения, а быстрое — влечет к его остановке под конец введения крови. Однако анурия при этом бывает кратковременной. В последующем в моче определялись белок, эритроциты и цилиндры. Опыты с введением гемоглобина животным также показали, что одной закупоркой просвета канальцев глыбками гемоглобина невозможно объяснить острую почечную недостаточность (Finele, 1953). Ряд клинических наблюдений и эксперименты с введением гемоглобина в кровяное русло животным позволили убедиться, что острая почечная недостаточность наступает лишь в условиях шока, обезвоживания.
Со времени применения в клинике гемодиализа и обменного переливания крови удается спасти почти всех „терапевтических" больных с острой почечной недостаточностью, обусловленной переливанием несовместимой крови, и лишь только половину больных— „хирургических". Объяснить это можно суммированиемгемолитического шока с операционным и возникновением посттрансфузионного осложнения на фоне тяжело протекающего после-
операционного периода, сопровождающегося глубокими нарушениями электролитного и водного равновесия. Так же тяжело протекают посттрансфу-зионные осложнения у больных, имеющих травмы. В ряде более благоприятно протекающих заболеваний удается добиться выздоровления при помощи обычных лечебных мероприятий без применения гемодиализа. Это относится в основном к больным без операционного шока.
Частой формой так называемой гемолитической почки является острая почечная недостаточность у больных с септическим абортом. Это заболевание почти у всех больных раньше завершалось летальным исходом. Лишь с применением обменных переливаний и гемодиализа прогноз почечной недостаточности у этой категории больных значительно улучшился.
Острая почечная недостаточность
после больших травм, ожогов, размозжения
конечностей и больших мышечных пластов.
Острая почечная недостаточность после
больших травматических оперативных вмешательств
В группу так называемой травматической почки следует включить все случаи острой почечной недостаточности, наступающие после тяжелых травм, сопровождающихся значительным разрушением мышц — crush syndrom, после больших весьма травматичных оперативных вмешательств, после ожогов. При этих видах почечной недостаточности имеет место выпадение пигмента в просвет почечных канальцев: в одном случае гемоглобина, во втором — миоглобина. Однако не это является главным в патогенезе почечной недостаточности. Выпадение пигмента в просвет канальцев не может быть воспринято как основная причина острого нарушешш функции почек, а выпадение миоглобина имеет место только в тех случаях острой почечной недостаточности травматического происхождения, при которых произошло обширное размозжение мышц. Миоглобинурия может отсутствовать у больных „травматической почкой", если у них размозжения мышц не произошло. Главным пунктом сходства этих двух групп заболеваний является наличие выраженного шока.
Синдром размозжения может протекать и без острой почечной недостаточности. Безусловно, crush syndrom во многих случаях остается не обнаруженным, так как больные быстро погибают от шока. Но и среди больных, вышедших из шока, этот синдром может отсутствовать. К исследованиям времен второй мировой войны (Bywaters, 1941, 1944; А. Я. Пытель, 1945, 1946) и отечественным данным о пострадавших при землетрясении (Н. Н. Еланский, 1950; М. И. Кузин, 1960) в литературе последнего времени прибавились наблюдения над больными, перенесшими синдром размозжения во время землетрясения в Агадире. Эти наблюдения подтвердили наличие очень глубоких и многогранных изменений в организме у пострадавших при землетрясении, больших обвалах и т. п. О весьма глубоких нарушениях при этом виде травмы говорит следующий факт. Mirouze и сотр. (1960) наблюдали 22 больных с синдромом размозжения, из которых у 11 успели применить искусственную почку; погибли все 11 человек, которым не был осуществлен гемодиализ, а также 7 человек, несмотря на проведенный им гемодиализ. Mirouze считает, что летальный исход у этих больных наступил вследствие нарушения функции миокарда в результате гиперкалиемии. При наличии гиперкалиемии спасение возможно только при условии весьма раннего применения гемодиализа. В последующем смерть может наступить от сепсиса, гипертонии и отеков на почве гипо-натриемии и гипохлоремии. Последние можно выравнить с помощью гемодиализа, однако при этом происходит клеточная гипергидратация.
Острая почечная недостаточность может наступить при различных травматических поражениях и после больших продолжительных оперативных вмешательств на различных органах и частях тела. Имеются указания на сравнительно большую частоту острой почечной недостаточности при травмах головного мозга, печени, поджелудочной железы и других органов. Признаки острой почечной недостаточности могут наступить вскоре после травмы или операции либо через 2—3 суток. В последнем случае острая почечная недостаточность оказывается обусловленной какой-либо причиной, являющейся осложнением перенесенной травмы или операции. Taylor и Reid (1958) сообщили результаты лечения 42 больных, у которых острая почечная недостаточность наступила после травмы или после операции на головном мозгу. Спасти удалось лишь 5 больных. У 11 из умерших на секции были найдены признаки ранее не распознанного хронического заболевания почек, безусловно сыгравшего предрасполагающую роль в возникновении острой почечной недостаточности. Из 31 больного без предшествовавшего почечного заболевания умерло 26, однако только у 9 смерть наступила непосредственно от острой почечной недостаточности. У 6 больных последняя имела определенное значение для летального исхода, у остальных 11 больных смерть наступила от тяжелой травмы или ее осложнений.
Весьма часто в основе возникновения острой почечной недостаточности лежит предшествовавшая неполноценность деятельности печени — латентная гепатопатия. В таких случаях острая почечная недостаточность является по существу гепаторенальным синдромом.
Проблема о гепаторенальном синдроме обстоятельно изучалась в Советском Союзе А. Я. Пытелем (1936, 1938, 1941, 1956, 1962) и А. И. Франкфуртом (1940). Помимо их монографий, этой проблеме посвящен ряд работ других авторов (Е. М. Тареев, 1933; И. Г. Руфанов, 1933; Heyd, 1931; Henschen, 1932; Воусе, 1941, и др.). М. О. Стернин (1961) в работе о шоке и печеночно-почечной недостаточности после панкреато-дуоденальной резекции также указывает на значение гепатопатии как фактора, способствующего шоку и тем самым и острой почечной недостаточности. Среди 30 больных, подвергшихся панкреато-дуоденальной резекции, летальный исход наступил у 19, причем у 5 больных от шока и у 5 от острой почечной недостаточности. М. О. Стернин полагает, что в патогенезе печеночно-почечной недостаточности большую роль играет аммиачное отравление, наступающее в результате нарушения дезаминирующей функции печени. К такому заключению пришел на основании своих классических экспериментальных исследований еще свыше полувека назад И. П. Павлов.
Выше были приведены данные В. В. Серова и И. П. Соловьевой (1961) относительно наблюдений острой почечной недостаточности, протекавшей по типу гепаторенального синдрома. Эти исследователи пришли к выводу, что в их наблюдениях имело место извращение почечного кровотока по типу юкстамедуллярного с преимущественным поражением дистальных сег-ронментов канальцев.
Близки к этим сообщениям случаи острого панкреатита, протекающие также с острой почечной недостаточностью. Beisel, Herndon и Myers (1959) у 5 из 32 больных острым панкреатитом наблюдали острую почечную недостаточность, приведшую к летальному исходу. У больных были шок, гемоконцентрация, аноксия. У/4 из этих 5 больных, несмотря на высокую температуру (феномен Heyd), дегидратацию и массивный некроз поджелудочной железы, не отмечалось гиперкалиемии. Гистологически во всех случаях определен некроз канальцевых клеток, в одном случае — двусторонний кортикальный некроз.
За последнее десятилетие появились многочисленные сообщения о возникновении острой почечной недостаточности после операций, связанных с необходимостью временного пережатия аорты. Нарушение почечной функции в этих случаях может быть объяснено операционным шоком и нарушением гемодинамики. Острая почечная недостаточность наступает у некоторых больных и после резекции аорты ниже места отхождения почечных артерий. После этих операций недостаточность почек чаще бывает кратковременной, но иногда может длиться и несколько недель.
Согласно данным Dimitriu и Beroniade (1963), причинными факторами острой почечной недостаточности, возникающей после больших, тяжелых оперативных вмешательств, являются: шок, массивная потеря жидкости, переливание несовместимой крови, гистолиз, токсикоинфекция, рефлекторное воздействие на почки, инфаркт почки.
В гинекологической, так же как и в хирургической, практике большое значение имеет своевременное определение причины анурии в послеоперационном периоде: травма, шок, пережатие мочеточников или нарушение функции почек вследствие других причин. O'Connor, Libretti и Grayhack (1961) провели экспериментальные исследования на 40 собаках: у 13 были перевязаны оба мочеточника, у 16 — в течение 4 часов почечные сосуды, у 11 — вызывали острую дегидратацию в течение свыше 2 часов с помощью перитонеального диализа 10% раствором декстрозы. Функциональное состояние почек определяли повторной изотопной ренографией.
Только в течение первых 48 часов можно было определить с помощью ренограмм причину почечной недостаточности; в последующем кривые теряли свою специфичность. После перевязки мочеточников имело место в течение 48 часов постоянное накопление изотопа в области почек без признаков его экскреции; при пережатии почечных сосудов отмечались в течение первых 24 часов небольшое повышение сосудистой фазы, плоская линия фазы аккумуляции. Ренограммы после острой дегидратации были сходны с ренограммами животных с перевязанными мочеточниками.
На основании 200 наблюдений Hamburger (1960) предложил делить острую почечную недостаточность, возникающую у больных в послеоперационном периоде, на 5 категорий: 1) функциональная почечная недостаточность, зависящая от нарушений гемостаза и нарушений кровообращения; 2) органические нарушения деятельности почек: острый канальцевый некроз, интерстициальный нефрит; 3) почечная недостаточность, возникшая вследствие переливания несовместимой крови; 4) почечная недостаточность в результате предшествовавшего ей заболевания почек; 5) острая почечная недостаточность вследствие комплекса различных причин.
При обширных ожогах острая почечная недостаточность наступает вследствие нарушения гемодинамики в целом и почечного кровотока в частности. Monsaingeou, Tauret и Daussy (1949) наносили животным ожоги, а затем через различные промежутки времени вводили внутривенно в аорту или в сердце красящее вещество. Их опыты позволили подтвердить данные Trueta (1945) о шунтировании крови при шоке. Роль раздражения нервной системы в возникновении ожогового шока, а тем самым и его последствий, доказана рядом отечественных исследователей (3. Е. Горбугаина, 1959, и др.).
Острая почечная недостаточность
вследствие отравления ядами и лекарственными препаратами
Различные токсические вещества могут привести к острой почечной недостаточности. Окончательно не установлено, является ли в этих случаях воздействие данных веществ избирательным по отношению к почечной ткани или же поражение последней происходит вследствие токсического шока. Schorcher и Loblich (1960) с помощью электронного микроскопа исследовали почки после отравления сулемой и нашли, что сулемовый нефроз возникает в результате повреждения сосудистых стенок, а не функциональной ишемии. Одновременно происходит токсическое повреждение сулемой канальцевых клеток. Е. М. Тареев (1958) указывает, что „почечный фактор патогенеза сулемового отравления сложный, нельзя представлять упрощенно, что почечные канальцы поражаются только под влиянием местного воздействия на них ртути при реабсорбции или секреции ее". Несомненно, следует учитывать и нервно-сосудистый фактор, нарушение почечного кровообращения, хлоргидропению, возникающую в результате частой рвоты. Известный интерес представляют опыты Г.Г. Мелкумова (1954), изучавшего влияние декапсуляции и денервации почки на исход отравления сулемой. Эти опыты наглядно показали роль воздействия через нервную систему. Если рассмотреть влияние различных токсических веществ и механизм их воздействия на функцию почки, становится ясным, что одним нефротоксическим воздействием невозможно объяснить патогенез острой почечной недостаточности. Влияние токсических веществ на почки является комплексным. Так, сульфаниламидные препараты влияют путем внутрисосудистого гемолиза аллергического поражения клубочков, канальцевого некроза и выпадения кристаллов в просвет канальцев. В патогенезе токсической почки большое значение имеет спазм ее сосудов. Е. М. Тареев (1958) приводит данные, указывающие, что предварительная денервация почек, предотвращающая спазм почечных сосудов, препятствует проявлению нефротоксического действия кантаридата калия.
При отравлении веществами, вызывающими ожог слизистой оболочки пищеварительного тракта, значение шока в возникновении острой почечной недостаточности играет доминирующую роль. Мы неоднократно наблюдали больных, выпивших с целью самоубийства уксусную эссенцию, у которых в последующем возникала острая почечная недостаточность.
Острая почечная недостаточность может возникнуть в результате отравления сулемой и другими ртутными препаратами, свинцом, фосфором, кантаридином, мышьяковистыми соединениями, висмутом, ураном, четы-реххлористым углеродом, тетраэтиленом, сульфаниламидными препаратами, антифризом, алкоголем и др. Острая почечная недостаточность может развиться и после приема большой дозы салициловых препаратов.
Поражения, вызванные некоторыми из указанных веществ, имеют характерные особенности. Так, при отравлении четыреххлористым углеродом возникает гепаторенальный синдром, т. е. имеет место поражение не только почек, но и печени (рис. 231). При интоксикации ураном в начальной стадии отмечается полиурия, на смену которой приходит олигоанурия.
Острая почечная недостаточность наблюдалась после приема больших доз сульфаниламидных препаратов, особенно белого стрептоцида, сульфидина, сульфазана, сульфатиазола, т. е. препаратов, подвергающихся в организме ацетилированию. Острая почечная недостаточность может возникнуть иногда после приема даже небольших доз сульфаниламидных препаратов. Профилактически рекомендуется назначение двууглекислого натрия одновременно с сульфаниламидами, поскольку растворимость последних увеличивается в щелочной среде, а также сочетание нескольких препаратов сульфаниламидной группы.
В настоящее время „сульфаниламидная почка" встречается значительно реже, что можно объяснить использованием сульфаниламидных препаратов, не подвергающихся ацетилированию.
Согласно данным Rhamy и Segar (1961), 18% летальных отравлений у детей младше 5 лет относятся к отравлению салицилатами, протекающему с гиперпирексией, дыхательным алкалозом, сменяющимся тяжелым метаболическим ацидозом, а у ряда больных осложняющимся шоком и острой почечной недостаточностью. Подобные осложнения описаны и у взрослых.
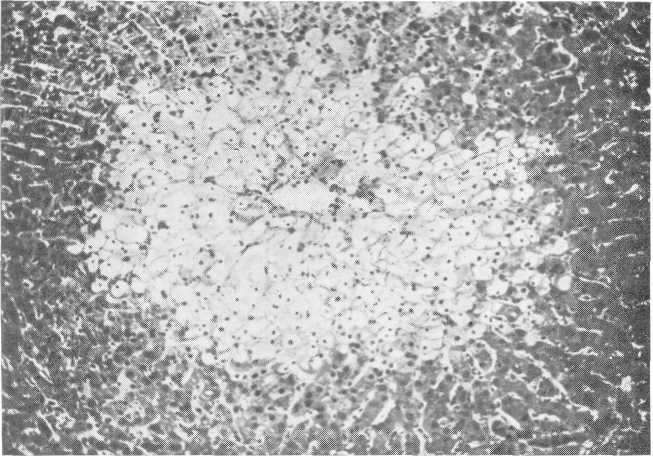
Рис. 231. Гидропическая дегенерация печеночных клеток при острой почечной недостаточности при хроническом пиелонефрите.
Острая почечная недостаточность у больных острым алкогольным психозом может остаться нераспознанной. На секции выявляется двусторонний кортикальный некроз и некротический нефроз. S. Gavrilescu и М. Gavrilescu (1958) экспериментально доказали возможность воспроизведения острой почечной недостаточности отравленных алкоголем кроликов, которым предварительно вводили кортизон.
Острая почечная недостаточность при острых инфекциях
В большинстве случаев возникновения острой почечной недостаточности вследствие микробной инвазии — бактериемического шока — происходит внутрисосудистый гемолиз (сепсис после аборта, иктерогеморрагический лептоспироз и др.). Иногда гемолиз может отсутствовать (сепсис, в том числе раневой, брюшной тиф, острый пиелонефрит).
За последние годы тяжелые осложнения после эндоскопических урологических исследований стали более частыми и у ряда больных протекают особенно тяжело; это можно в известной мере объяснить инфекцией штаммами микробов, чаще всего стафилококков, резистентных к антибиотикам. Бактериемический шок после эндоскопии может привести к летальному исходу при резко выраженной гипертермии, однако он не всегда сопровождается ясными признаками острой почечной недостаточности.
В клинической картине острой почечной недостаточности, возникающей в результате бактериемического шока, наряду с признаками поражения почки наблюдаются и симптомы основного заболевания. При особо тяжело протекающей инфекции острая почечная недостаточность может не быть своевременно распознана. Отсутствие надлежащих мероприятий по борьбе с ней приводит к дальнейшему ухудшению состояния больного. У больных острыми инфекционными процессами, в частности острым пиелонефритом, необходимо следить за диурезом. Малый диурез не следует по шаблону относить за счет больших потерь воды внепочечным путем вследствие высокой температуры. Определение удельного веса мочи и мочевины плазмы позволяет установить, имеется ли только снижение диуреза из-за внепочечных потерь или же развивается острая почечная недостаточность.
Острая почечная недостаточность
при урологических заболеваниях
К этой категории относятся главным образом больные острой почечной недостаточностью, возникающей вследствие острого пиелонефрита, уро-сепсиса, острой непроходимости верхних мочевых путей, чаще всего калькулезного происхождения. У ряда больных, страдающих хронической задержкой мочи, острая почечная недостаточность наступает вслед за устранением препятствия к оттоку мочи (после эпицистостомии, аденом-эктомии, нефростомии).
Острая почечная недостаточность у больных непроходимостью мочеточников имеет свои отличительные черты. Механизм нарушения кровообращения в почке несколько другой, нежели в предыдущих описанных выше условиях. Заболевание начинается острой непроходимостью мочеточников, ведущей к повышению внутрилоханочного и внутрипочечного давления, интерстициальному отеку с последующим нарушением внутри-почечного кровообращения. Нарушение кровообращения не принимает катастрофических масштабов, не ведет к возникновению некротических и деструктивных изменений почечных канальцев. Функциональная способность почки, несмотря на анурию, остается сохраненной. Устранение препятствия к оттоку мочи ведет к немедленному восстановлению диуреза. Обычно отмечается полиурия с низким удельным весом мочи.
Мочекаменная болезнь приводит к острой почечной недостаточности тогда, когда возникает закупорка конкрементами обоих мочеточников при двустороннем уретеролитиазе или одного мочеточника при наличии единственной почки (единственной врожденной почки, после нефрзктомии или при наличии единственной функционирующей почки). В литературе приводятся наблюдения так называемой рефлекторной анурии, когда происходит закупорка одного из мочеточников, а вторая почка перестает функционировать вследствие рефлекса с больной почки на здоровую. С. П. Федоров (1923) отрицал такую возможность и в каждом случае калькулез-ной анурии рассматривал либо возможность двустороннего процесса, либо наличие врожденной единственной почки. Такого же мнения придерживался Legueu (1914), выразившийся весьма образно: „Больной анурией — это лицо, которое накануне жило одной почкой".
Наш клинический опыт показывает, что лишь исключительно редко не удается во второй почке обнаружить серьезных патологических изменений.
Trueta с сотр. (1948) высказывали предположение, что прекращение выделения мочи второй здоровой почкой является следствием нарушения в ней кровотока в результате болевых и прессорных импульсов, возникающих при почечной колике на пораженной стороне. Такое объяснение приближает патогенез острой почечной недостаточности при закупорке одного из мочеточников к патотенезу других форм острой почечной недостаточности.
При сдавлении обоих мочеточников, возникающем нередко у больных раком матки либо другими новообразованиями малого таза или склеротическими процессами в тазовой клетчатке, отмечается парадоксальное явление: возникает медленно нарастающее сдавление мочеточников, неожиданно приводящее к. анурии. Нам приходилось неоднократно наблюдать больных анурией, возникающей вследствие сдавления мочеточников раковым инфильтратом, исходящим из шейки матки, при отсутствии гидронефротической трансформации, которую логично было ожидать в подобных условиях. Почечные лоханки оказывались обычных размеров, и наложение нефростомы в случае их внутрипочечного варианта представляло значительные технические трудности. Можно было бы предположить, что анурия наступает внезапно вследствие присоединения какого-нибудь добавочного фактора, например отека. Однако опыт показывает, что после нефростомии у бльных раком шейки матки в последующем проходимость мочеточников не восстанавливается.
Успех оперативного вмешательства, направленного на ликвидацию непроходимости мочеточников, зависит от его своевременности. Рано предпринятая операция приводит к восстановлению диуреза. Чем позже она производится, тем менее она эффективна. В случае запоздалой помощи не удается вывести больного из состояния острой почечной недостаточности, уремии, поскольку продолжают оставаться глубокие поражения функции почек, проявляющиеся главным образом низким и монотонным удельным весом мочи, неудовлетворительными результатами проб на очищение.
Неоперативные мероприятия у больных экскреторной уремией, возникающей в результате окклюзии мочеточников конкрементами, при наличии удовлетворительного общего состояния следует ограничить двумя, максимум тремя днями. Если функция почек была недостаточной еще до возникновения анурии, то более суток с операцией ждать нельзя. Особенно это относится к больным с единственной почкой. Среди консервативных мер борьбы с анурией у калькулезных больных главное место занимает катетеризация мочеточников.
Для облегчения последней, учитывая наличие мочеточникового спазма, перед катетеризацией следует либо произвести новокаиновую блокаду но Лорин—Эпштейну, либо ввести больному литический коктейль из аминазина, димедрола, промедола и атропина.
У больных анурией вследствие сдавления мочеточников новообразованием не следует выжидать с операцией. Убедившись путем катетеризации в непроходимости мочеточников, следует предпринять оперативное отведение мочи тем или другим способом. Учитывая тяжесть состояния этой категории больных, понятно, что чем раньше будет произведена операция, тем больше имеется шансов на улучшение состояния больного.
Патогенез острой почечной недостаточности, возникающей после эпи-цистостомии у больных аденомой простаты, аналогичен патогенезу так называемой хлорпенической почки. После устранения препятствия оттоку мочи обычно возникает значительно выраженная полиурия с большой потерей электролитов. Помимо этого, возникновению острой почечной недостаточности способствует наличие предшествовавшего, столь обычного для запущенных форм аденом простаты, поражения почек. Лечение состоит в принятии мер по восстановлению электролитного и водного равновесия.
ЛЕЧЕНИЕ БОЛЬНЫХ
ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
Лечение больных острой почечной недостаточностью должно быть комплексным. Оно предусматривает мероприятия, направленные на устранение патологических факторов, приводящих к нарушению функций почек, а также меры по сохранению гомеостаза. Лечебные мероприятия делятся на: 1) методы диетические и лекарственные, 2) методы внепочечного очищения.
Этиопатогенетическое лечение варьирует в зависимости от причины острой почечной недостаточности. Так: а) при так называемой гемолитической почке показаны массивные обменные переливания крови; б) при так называемой травматической почке — борьба с шоком: переливание крови, вливание плазмы, белковых растворов, физиологического раствора, введение аналептиков, среди которых лучшим является норадреналин: в) у больных хлоргидропенической почкой назначают вливания гипертонического и физиологического растворов хлористого натрия; г) после отравлений показаны соответствующие антидоты, промывание желудка и др.; д) у больных так называемой инфекционной почкой проводят антибактериальное лечение.
При наличии острой почечной недостаточности сульфаниламидные препараты противопоказаны.
Так как ожидать результатов антибиограммы не позволяет острота заболевания, то, взяв мочу (а при необходимости и кровь) на посев и анти-биограмму, следует сразу начать введение больному антибиотиков. При их назначении необходимо руководствоваться следующим: больные острой почечной недостаточностью плохо переносят введение лекарственных веществ перорально, эти вещества вызывают тошноту и рвоту. Отсутствие выделения антибиотиков в достаточной концентрации с мочой заставляет бояться их кумулятивного действия, вследствие чего дозы вводимых антибиотиков следует уменьшить. Целесообразнее прибегать к введению больным пенициллина с левомицетином, так как период распада этих антибиотиков более короткий. Левомицетин следует вводить в свечах. В условиях диализа допускается введение больным больших доз антибиотиков.
Режим питания и уход за больными имеют огромное значение в лечение всех форм острой почечной недостаточности. В случаях легкого течения заболевания правильное питание и тщательный уход за больными могут сами по себе обеспечить излечение. Вместе с тем неправильно проводимое питание, игнорирование водного и солевого обмена больного могут привести к ухудшению его состояния и летальному исходу.
У каждого больного острой почечной недостаточностью необходим строгий контроль за водным балансом и обменом электролитов. Опыт показывает, что гипергидратация — в большинстве случаев результат неправильного лечения. Доказательством могут служить многочисленные наблюдения гипергидратации в послеоперационном периоде у больных, которым вводится чрезвычайно большое количество физиологического раствора хлористого натрия и особенно глюкозы.
Важнейшим условием рационального ведения больного острой почечной недостаточностью является правильное его питание, обеспечивающее борьбу с катаболизмом. Доказано, что при голодании выделяется с мочой до 10 г азота за сутки. В этот же период теряется 1—1,5 г азота с каловыми массами. Таким образом, при голоде происходит уничтожение в среднем 70 г ткани. Это количество увеличивается в значительной мере (до 100 г и больше) при острых заболеваниях. Катаболизм сопровождается выделением большого количества калия из тканей — на каждый грамм ткани приблизительно 2 м/экв. калия. Катаболизм резко снижается при обеспечении калорийного питания жирами и углеводами. У здорового человека в условиях такого питания выделяется с мочой 1,5—2,5 г азота. Если к ним добавить азот кала, получается 3,5 г азота, что соответствует в среднем 20—22 г ткани и ведет к высвобождению значительно меньшего количества калия. Таким образом, в условиях острой почечной недостаточности борьба с катаболизмом означает не только экономию тканевых белков, предупреждение быстрого нарастания азотемии, но и калиемии.
Borst (1948) первым предложил обеспечить питание больных острой почечной недостаточностью жирами и углеводами. Предложенный им режим составлен из 200 г сливочного масла, 200 г сахара, 12 г муки и немного кофе. Все это смешивают и содержат на льду: больному дают частями в течение 24 часов. Диета по Борсту обеспечивает больному 2600 калорий. Недостатком ее является плохая переносимость больными, страдающими отсутствием аппетита, тошнотой. Hamburger (1960) рекомендует давать больному острой почечной недостаточностью в сутки: хлеба — 50 г, сливочного масла — 60 г, меда — 100 г, компота из груш или яблок — 100 г и сахара — 150 г. У больных с гиперкалиемией из этого рациона исключают фруктовый компот. Рацион, предложенный Hamburger, обеспечивает 1840 калорий. Несколько лучше воспринимается больными режим питания, рекомендуемый Derot и включающий 100 г бисквита, 60 г сливочного масла и 120 г варенья; этот рацион содержит небольшое количество белков и обеспечивает больному только 1200 калорий.
Если больной отказывается принимать пищу, то последнюю можно вводить в желудок по зонду. Рекомендуют вводить таким образом эмульсию из 400 г сахара, 100 г растительного масла и 500 г воды. Эмульсию вводят капельным способом. Мы прибегаем к следующей методике у больных, у которых пероральное питание оказывается невозможным. После обильного промывания желудка содовым раствором (мероприятия, обычно применяемого у больных острой почечной недостаточностью), не удаляя зонд, вводят по нему одномоментно 200 мл слабого чая, в котором разведены 50 г сахара и 30 г сливочного масла. После предшествовавшего промывания желудка больной переносит такое питание сравнительно легко, рвоты не наступает. Ту же пищу и в том же количестве вводят повторно вечером после второго промывания желудка. Приведенный рацион пополняют внутривенным введением глюкозы в гипертоническом 40% растворе или в виде 5% физиологического раствора, когда показано большее введение жидкости.
Ряд нефрологов, и среди них Reubi (1961), подчеркивают, что накопление мочевины в крови может происходить быстро, несмотря на сравнительно достаточный режим питания у больных, у которых имеет место значительное разрушение тканей вследствие травмы или тяжелой интоксикации.
При неукротимой рвоте единственным путем введения калорийных веществ остается внутривенный. Опыт, однако, показывает, что внутривенное введение большого количества раствора глюкозы может привести к гипотонии плазмы, к гипергидратации. Поэтому введение глюкозы должно сочетаться с введением хлористого натрия.
Положение значительно изменяется тогда, когда лечение больного острой почечной недостаточностью проводится в специальном лечебном учреждении, располагающем возможностью гемодиализа. Искусственная почка позволяет варьировать режим питания больного. Установлено, что безбелковая диета способствует катаболизму, поэтому, располагая искусственной почкой, можно с 10-го дня (а при необходимости и раньше) назначить в пищу до 20—30 г белков в сутки.
Количество жидкости в сутки определяют на основании: 1) потерь воды через кожу, легкие, рвотой, поносом; 2) лабораторными исследованиями крови и мочи; 3) определением колебаний веса больного. При отсутствии рвоты и поноса больной теряет 800—1000 мл воды в сутки. Часть этой воды покрывается за счет пищи и катаболизма. Следовательно, больному необходимо вводить в сутки не более 600—750 мл воды. Если больной выделяет небольшое количество мочи (олигурия), соответственно увеличивается количество вводимой жидкости. При наличии рвоты и поноса необходимо также возмещение водных потерь. В этом случае необходимо восстановить и потери электролитов. С этой целью в период олигоанурии вводят обычно ежедневно 1 г хлористого натрия. Снижение щелочно-кислотного равновесия может привести к необходимости введения бикарбоната или лактата натрия. Особенно осторожным следует быть при наличии отеков: необходимо наблюдение за весом больного, артериальным давлением и эффективным осмотическим давлением плазмы. Введение калия показано при тех формах острой почечной недостаточности, которые сопровождаются гипокалиемией; вопрос этот решается на основании электрокардиограммы и определения содержания калия в плазме. Консервативными мероприятиями можно бороться с гиперкалиемией лишь в относительной мере, исключая из пищи полностью калий и назначая глюконат кальция (последний уменьшает токсический эффект калия). Показано введение глюкозы с инсулином, так как в синтезе гликогена в печени используется калий. Борьба с ацидозом также благоприятствует снижению калиемии. У большинства больных снизить калиемию удается путем гемодаилиза. Только с помощью искусственной почки можно добиться эффективного снижения ацидоза при анурии. В этих случаях нельзя вводить много бикарбоната натрия (ацидоз зависит не столько от недостатка ионов натрия, сколько от накопления стойких кислот). Избыток натрия ведет к внеклеточной гипергидратации. Помимо этого, необходимо введение комплекса витаминов.
Медикаментозное лечение, направленное на улучшение почечного кровообращения, снижение катаболизма, борьбу с тошнотой, рвотой и поносом, практически малоэффективно. Существующими медикаментами практически не удается улучшить условия почечного кровообращения. Reubi (1961) считает возможным рекомендовать для улучшения почечного кровообращения сочетание апресолина (из группы гидроазинофталазинов) с эфедрином. Такое сочетание оправдано гипотензивным влиянием апресолина, которое уравнивается эфедрином, причем аналептическое воздействие последнего не сопровождается почечной вазоконстрикцией. Заслуживает большого внимания введение тестостерон-пропионата. Согласно многочисленным клиническим наблюдениям, андрогены обладают анаболическим эффектом. Имеются также экспериментальные данные о благоприятном их воздействии на почечную функцию, об уменьшении морфологических изменений клеток почечных канальцев при некоторых интоксикациях (сулема, уран). Мы вводим больным острой почечной недостаточностью тестостерон-пропионат 2 раза в сутки по 1 мл 5% раствора. Ряд клиницистов указывает на благоприятное действие соматотропного гормона гипофиза. Следует помнить, что кортикостероиды противопоказаны при острой почечной недостаточности, так как увеличивают катаболизм тканей.
У некоторых больных в начальной стадии острой почечной недостаточности, когда доминирует спазм почечных сосудов, с целью его устранения может быть применена поясничная новокаиновая блокада. Однако не следует возлагать больших надежд на этот метод. Среди группы 106 больных, лечившихся у нас по поводу острой почечной недостаточности, у 72 была применена в других лечебных учреждениях околопочечная новокаиновая блокада по Вишневскому и у многих из них неоднократно. Только у 7 больных блокада в комплексе с другими лечебными средствами, возможно, содействовала выздоровлению (посттрансфузионная почечная недостаточность). У остальных больных мы не видели от нее определенного эффекта. Новокаиновая околопочечная блокада, если и содействует в определенных случаях терапевтическому успеху, то лишь в самых начальных стадиях заболевания и только в комплексе с другими лечебными методами. В последние годы при лечении больных острой почечной недостаточностью околопочечную блокаду мы не применяем.
Остановимся еще на двух методах лечения — гибернации декапсуляции почек. При гибернации наступает значительное снижение обмена, что сберегает резервные силы организма и уменьшает его интоксикацию
(Burghele и Ргоса, 1962). Однако, как справедливо отмечает Reubi (1961), одновременно с катаболизмом гибернация может подавить и темпы восстановления поврежденного канальцевого эпителия.
Тяжелое, часто безнадежное, состояние больных острой почечной недостаточностью побуждало врачей к применению декапсуляции, которая, согласно экспериментальным наблюдениям, может привести к улучшению почечного кровообращения. Считалось, что декапсуляция почек ведет к снижению внутрипочечного давления путем воздействия на их иннервацию.
В работах многих экспериментаторов, изучавших влияние декапсуляции на почечную функцию, и в сообщениях клиницистов, проводивших наблюдения над лечением больных острой почечной недостаточностью с применением декапсуляции, имеются разноречивые толкования результатов этого метода, начиная от полного отрицания до признания за ним большой эффективности.
Исследования Bounous и Shumacker (1961) и других экспериментаторов (Gottschalk, 1960; Murphy, 1960) убедительно показывают, что гемодинамика почки и лимфообращение в ней взаимно обусловлены состоянием интерстициального почечного давления, артериального давления и тонуса фиброзной капсулы почки. Bounous и Shumacker установили, что спустя несколько часов после декапсуляции значительно улучшается почечное кровообращение. Максимальное увеличение почечного кровотока наступает после декапсуляции на 2-й и 3-й день и в среднем на 30% по сравнению с исходными данными. По Winton (1952), после декапсуляции внутрипочечное давление снижается наполовину исходной величины, исчезает цианоз почки и она „краснеет". Еще четверть века назад Fuchs и Popper (1937) было установлено, что лимфатические сосуды обеих почек могут, минуя регионарные лимфатические узлы, впадать непосредственно в цистерну грудного протока; в таких случаях между лимфатической системой обеих почек существует „корреляция лимфооттока". Это объясняет неоднократно наблюдаемое явление, когда после декапсуляции одной почки улучшается также и функция другой, ибо восстановление оттока интерстициальной жидкости ив декапсулированной почки содействует улучшению циркуляции интерстициальной жидкости во второй почке. Клиницистам часто приходится наблюдать, как после декапсуляции из поясничной раны долго просачивается в большом количестве бесцветная, не обладающая запахом серозная жидкость.
Декапсуляция является одновременно также и частичной почечной денервацией. По мнению И. Русняка, М. Фельди и Д, Сабо (1957), лечебное действие декапсуляции может быть объяснено устранением спазма лимфатических капилляров почки.
Ознакомление с анатомо-физиологическими особенностями соединительнотканной системы почки, с системой периваскулярных щелевых пространств и связи их с субкап-сулярным пространством делают во многом понятным принцип декапсуляции при остром отеке почки, ее экстрацеллюлярпой гипергидратации.
Критический анализ опубликованных за последние годы работ, посвященных почечной декапсуляции и влиянию ее на внутрипочечное давление, а также наши личные клинические наблюдения позволяют признать, что декапсуляция, произведенная по определенным показаниям и в начальном периоде тех видов острой почечной недостаточности, при которых повреждается в основном тубулярный аппарат, может дать в комплексе с другими лечебными средствами несомненный успех. В то же время весьма большая эффективность гемодиализа, особенно при раннем его применении, позволяет с каждым годом все реже прибегать к декапсуляции почек.
Внепочечные методы очищения. К методам внепочечного очищения относятся: 1) промывания желудка и кишечника; 2) применение ионообменных смол; 3) обменные переливания крови; 4) перитонеальный диализ; 5) применение искусственной почки.
Наиболее простыми и широкодоступными являются обильные промывания желудка и кишечника, перфузия кишечника. Промывания желудка производят большим количеством слабого раствора двууглекислого натрия (по 10 л раствора 2 раза в течение дня). При тяжелых видах уремии этим способом удается вывести из организма довольно значительное количество мочевины. Необходимо производить количественное определение мочевины в промывных водах. Из общего количества промывных вод следует посылать в лабораторию 100 мл для определения в ней мочевины, а затем высчитать общее количество мочевины в промывных водах. Концентрация мочевины в промывных водах может достигать 20 мг.%, что за два промывания равняется 4 г. Нами отмечено, что при повторных промываниях желудка количество мочевины в промывных водах уменьшается, несмотря на тяжелую азотемию. Поэтому необходимо определять уровень мочевины в промывных водах при каждом промывании желудка. При небольших количествах мочевины не имеет смысла продолжать промывания желудка.
Промывания кишечника производят с помощью сифонных клизм. Значительно более эффективна, но зато и сложнее, перфузия кишечника с помощью специального зонда с двумя каналами и металлическим ман-дреном длиной 2 м. Один из каналов служит для раздувания баллончика, которым зонд фиксируется в просвете кишки. Под контролем рентгеноскопии зонд проталкивают в двенадцатиперстную кишку, а затем далее. Больного помещают на кровать-весы. С помощью насоса по зонду вводят в течение 2—3 часов 8—12 л гипертонического раствора, подогретого до 37°. Жидкость вводят равномерно. Медленное введение опасно из-за гипергидратации, быстрое — гипогидратации. Hamburger (1960) рекомендует раствор следующего состава: сахарозы 86 г, глюкозы 7,7 г, КС1 0,2 г, СОзНЛта 1 г, NaCJ 0,7 г, воды 1 л. У больных с сохранившимся диурезом к этому раствору прибавляют 2,5 г SO4Na2 и 0,05 г PC>4H2Na. Жидкость выделяется через трубку, введенную в прямую кишку, и собирается в сосуд. Hamburger приравнивает кишечную перфузию по эффективности к брюшинному диализу. При резко выраженной азотемии, порядка 300—400 мг%, за сеанс удается удалить из организма 5—10 г мочевины. Кишечная перфузия позволяет также снизить калие.мию. Помимо этого, у больных с гипергидратацией можно удалить значительное количество воды из организма (от 1 до 3 л), используя более гипертоничные растворы. Несмотря на это, несомненное предпочтение следует отдать перитонеальному диализу и особенно гемодиализу.
В литературе имеются разноречивые данные о показаниях к лечению больных острой почечной недостаточностью ионообменными с м о-л а м и. Показанием к их применению является гиперкалиемия. Применять их можно перорально или ректально. Пероральный путь более эффективный, однако прием ионообменных смол у больных, страдающих тошнотой, чрезвычайно затруднен. Практически применение этих смол находит показание только у больных с выраженной гиперкалиемией при отсутствии возможности применить искусственную почку.
Обменные переливания крови сопряжены со значительными техническими трудностями. Если обменные переливания в несколько сот миллилитров общедоступны, большие переливания в количестве 5—6 и даже 10 л крови наталкиваются на необходимость одномоментного использования большого количества доноров. Трудности подбора доноров чрезвычайны, когда речь идет о больных с резусотрицательной кровью (обменные переливания крови, в частности, показаны при острой почечной недостаточности, обусловленной переливанием резуснесовместимой крови).
Кровь переливают в одну из вен локтевого сгиба, а забирают кровь из нижней полой вены по полиэтиленовому катетеру, введенному через большую подкожную ве"ну бедра. Выведение и введение крови производят одновременно, и разница в количестве выпускаемой и вводимой крови не должна превышать в течение всей процедуры несколько сот миллилитров. Кровь в количестве 500 мл переливают в среднем за 10—15 минут.
При обменных переливаниях крови могут наблюдаться некоторые осложнения. При большой разнице в быстроте выведения и введения крови возможен у одних больных коллапс, у других отек легких. Поступление в организм большого количества цитрата натрия (3 г на 1 л крови) может привести к осложнениям при наличии гипернатриемии. Во избежание тетании вследствие алкалоза и уменьшения фракции ионизированного кальция необходимо одновременно вводить в кровь кальций.
Несмотря на обменный характер, за время переливания происходит лишь небольшое „очищение" организма от продуктов азотистого обмена. Согласно существующим подсчетам, при переливании 5—6 л крови происходит обновление только 2/3 плазмы, что равняется 1/6 внеклеточной или х/15 всей жидкости организма. Мочевина вследствие высокой диффузионной способности распределена почти в равной концентрации во всей жидкости. Таким образом, массивное обменное переливание крови обеспечивает удаление из организма лишь 1/15 избытка мочевины плазмы. Учитывая это обстоятельство и технические трудности, связанные с использованием большого количества свежей крови, обменные переливания крови применяются в основном при острой почечной недостаточности, возникшей вследствие массивного гемолиза. Проводить их нужно в первые же часы. Hamburger рекомендует обменные переливания крови также у больных острой почечной недостаточностью, сопровождающейся выраженной анемией, падением эффективного осмотического давления плазмы и ацидозом. В этих случаях обменное переливание позволяет добиться увеличения количества эритроцитов, повышения электролитемии и снижения ацидоза благодаря введению цитрата натрия.
Перитонеальный диализ производят различными методами. Раньше наиболее принятой была методика, основанная на введении в брюшную полость двух полиэтиленовых трубок. Трубки вводили через троакар или путем небольшого разреза брюшной стенки в обеих подвздошных областях. Обычно вводили сначала трубку слева и по ней в брюшную полость — раствор. Лишь после поступления в брюшную полость 2,5 л раствора вводили вторую трубку справа для выведения раствора. Раствор вводили из расчета приблизительно 2 л в час. Длительность брюшинного диализа — 10—16 часов, в течение которых через брюшную полость протекало 20—30 л раствора. К концу диализа, когда введение раствора прекращалось, обе трубки служили для опорожнения брюшной полости от остатков раствора. После удаления трубок накладывали на места пункции брюшной стенки повязки с коллодием. Большинство клиницистов для перито-неального диализа применяют гипертонический раствор следующего состава: хлористый натрий — 6,10 г, хлористый калий — 0,35 г, хлористый магний — 0,05 г, хлористый кальций — 0,23 г, PO4H2Na — 0,07 г, двууглекислый натрий — 2,20 г, глюкоза — 20 г, вода — до 1 л. На каждый литр раствора добавляют 100 000 ЕД пенициллина и столько же стрептомицина, а также 10 мг гепарина. Состав такого раствора видоизменяют соответственно имеющимся у больного электролитным нарушениям.
Рис. 232. Перитонеальный диализ.
В настоящее время почти повсеместно применяют прерывистый перитонеальный диализ (рис. 232). По средней линии живота на границе нижней и средней трети расстояния между пупком и лобком производят небольшой лапаротомный разрез. В брюшную стенку вшивают специальную фистулу, по которой вводят перфорированную трубку. По трубке диализирую-щий раствор поступает в брюшную полость, где он остается 1—2 часа (Gasteyer, 1966). Затем жидкость выпускают через ту же трубку. За 10— 12 часов через брюшную полость пропускают от 20 до 24 л раствора. Допустимо, чтобы при опорожнении брюшной полости в ней оставалось 100— 200 мл диализирующего раствора. Если из брюшной полости вытекает каждый раз меньше раствора, то следует увеличить его гипертоничность добавлением декстрозы или глюкозы. Для перитонеального диализа применяют специальный инструментарий, изготовляемый НИИЭХАиИ. Перитонеальный диализ с помощью аппарата искусственной почки обеспечивает большую его эффективность (Напо, 1966; Г. Я. Алапин с сотр., 1967).
Перитонеальный диализ противопоказан при острой инфекции органов брюшной полости и при обширных сращениях в ней. Среди осложнений перитонеального диализа особого внимания заслуживает возможность внесения инфекции в брюшную полость. Добавление антибиотиков позволяет эффективно бороться с инфекцией, предупреждать возникновение воспалительного процесса в брюшной полости. У некоторых больных возникает динамическая непроходимость кишечника, возможен коллапс. Для перитонеального диализа имеется меньше противопоказаний, нежели для гемодиализа.
Коллапс и гипергидратацию можно предупредить тщательным наблюдением за больным. Во время диализа следует вводить несколько раз глюконат кальция, так как количество ионов последнего в плазме уменьшается под воздействием диализирующего раствора, имеющего щелочную реакцию.
В результате перитонеального диализа происходит снижение содержания мочевины в плазме, в меньшей мере — других продуктов азотистого обмена — креатинина, мочевой кислоты и др. По данным Reubi (1961), за один сеанс удается удалить из организма в среднем до 50 г мочевины, согласно Hamburger (1962) — 20—40 г, по нашим данным — до 20—40 г. Одновременно при этом наступает снижение ацидоза, калиемии, фосфатемии. Одного сеанса брюшинного диализа обычно оказывается недостаточно, его приходится повторять. Этим методом удается на несколько дней вывести больного из тяжелого состояния.
Эффективность перитонеального диализа при острой почечной недостаточности несомненна. Перитонеальный диализ, проведенный перед большой операцией, в том числе на органах мочеполовой системы, и затем продолженный диализ в послеоперационном периоде обеспечивают более благоприятный прогноз. С помощью диализа удается гораздо лучше подготовить больного почечной недостаточностью к операции.
Нарастание содержания в крови мочевины, наличие олигурии-анурии и гиперкалиемии (7 мэкв./л и выше) являются показаниями к применению перитонеального диализа. Если ранее считали, что диализ следует применять при содержании мочевины в крови свыше 250—300 мг%, то сейчас признано, что целесообразнее начинать лечение диализом при содержании мочевины в крови уже свыше 150 мг%; при таком состоянии функция почек обеспечивается лишь на 5%, поскольку функционирует только 100 000 нефронов вместо 2 млн. нефронов при нормальной деятельности почек. Как наши наблюдения, так и данные литературы показывают, что при относительно раннем проведении гемо- и перитонеального диализа имеют место значительно лучшие результаты лечения больных острой и хронической почечной недостаточностью (Л. И. Дунаевский и Ф. М. Яжгур, 1955; Воеп, 1965, и др.); в поздних стадиях почечной недостаточности, естественно, ждать большого успеха не приходится. Эти наблюдения привели к мысли о целесообразности проведения профилактического диализа (Gasteyer, 1966).
Профилактический перитонеальный диализ особенно эффективен перед предстоящей урологической операцией, особенно на единственной почке. Таким больным за несколько дней до операции вводят в брюшную полость катетер, с тем чтобы "перед операцией, а затем во время нее и в послеоперационном периоде осуществлять перитонеальный диализ.
С внедрением в клиническую практику гемодиализа с помощью аппарата „искусственная почка" была открыта новая эра в лечении больных острой почечной недостаточностью. В аппарате „искусственная почка" происходит процесс, основанный на разности концентрации веществ, растворенных в крови больного и в диализирующей жидкости, благодаря чему возникает их диффузия через полупроницаемую целлофановую мембрану, их разделяющую. Через эту мембрану проходят кристаллические вещества, но не проходят коллоиды. В аппарате происходят также осмос и ультрафильтрация. Благодаря этому с помощью „искусственной почки" удается извлечь из крови избыток азотистых шлаков и электролитов, выравнять дефицит электролитов и удалить воду при наличии гипергидратации (с помощью ультрафильтрации).
Во время гемодиализа из крови в диализирующий раствор поступают продукты азотистого обмена (мочевина, креатинин, мочевая кислота, индикан, аминокислоты), электролиты, находящиеся в крови в избытке, в более высокой концентрации — калий, сульфаты, фосфаты. В результате гемодиализа происходит также переход необходимых электролитов из диализирующего раствора в кровь больного, выравнивается гидростатическое давление. Так как гуморальные нарушения различны у разных больных, необходимо при выборе диализирующего раствора подходить индивидуально, добавлять некоторые ингредиенты или, наоборот, их удалять.
Рис. 233. Артерио-венозный шунт Скрибнера.
Аппарат „искусственая почка" должен отвечать ряду важнейших требований. Система в которой циркулирует кровь, должна быть герметичной во избежание утечки крови в диализирующую жидкость и проникновения последней в кровяное русло. Диализирующая поверхность должна быть возможно большей для ускорения процесса диализа. Поэтому кровь располагается в аппарате очень тонким слоем. Необходимо обеспечить ритмичный постоянный ток крови в аппарате, поддерживать определенную температуру диализирующей жидкости, периодически добавлять антикоагулянты для предотвращения свертывания крови в аппарате. Эти качества обеспечены в советстком аппарате, созданном НИИЭХАиИ.
Быстрота диализа и количество удаляемой за сеанс мочевины и других веществ зависят также от разницы в концентрации этих веществ, величины молекул и их электрического потенциала.
В течение всего сеанса гемодиализа проводят постоянный контроль за биохимическими показателями крови больного, диализирующим раствором, общим состоянием больного (пульс, артериальное давление, вес и др )* Гемодиализ незаменим в тех случаях, когда необходимо в экстренном порядке корригировать значительно выраженные гиперкалиемию ацидоз гиперазотемию. С помощью аппарата искусственной почки удается добиться значительной коррекции водно-электролитного баланса в течение 2—4 часов. У некоторых больных в последующем до восстановления диуреза можно продолжить лечение с помощью перитонеального диализа. Чаще гемодиализ приходится проводить повторно и иногда много раз. Проведение повторного гемодиализа облегчает предварительно наложенный на предплечье артерио-венозный шунт по Скрибнеру (рис. 233).
При установлении показаний к гемодиализу и решении вопросов о противопоказан ияхк нему следует придавать особое значение оценке общеклинического состояния больного и особенно симптомам поражения центральной нервной системы, столь чувствительной к изменениям гомеостаза. Большое значение в определении показаний к гемодиализу имеют данные нарушений со стороны сердечно-сосудистой систем (аритмия, блокада вследствие гиперкалиемии), желудочно-кишечного тракта (упорная тошнота, рвота, метеоризм) при продолжающейся анурии. Наряду с этитт показанием к применению гемодиализа служит наличие 11—III степени острого уремического отека легких ( ,Fluid lung") как проявления тяжелой гипергидратации организма больного (И Н Кучинский, 1965; А. Ф. Даренков, 1966).
Среди биохимических изменений в крови больных острой почечной недостаточностью абсолютными показаниями к гемодиализу служат: а) содержание мочевины выше 350 мг%; б) содержание калия выше 7 м-экв./л; в) снижение щелочного резерва ниже 12 м-экв./л. Далее необходимо учитывать степень креатининемии; повышение уровня креатинина в крови выше 15 мг% является признаком значительной гиперазотемии. В ряде случаев приходится применять гемодиализ при меньшей степени азотемии, когда показатели содержания мочевины в крови указывают на 150 мг%, но превалируют грозные симптомы со стороны сердечно-сосудистой и центральной нервной системы.
Противопоказаниями к гемодиализу являются: резко выраженные нарушения сердечно-сосудистой системы (инфаркт миокарда, миогеныая дилятация сердца, коллапс), значительное снижение артериального давления, тяжелые формы почечной недостаточности — гепатаргия, геморрагический диатез, значительно выраженные маточные, желудочно-кишечные кровотечения, а также септический процесс, обусловивший острую почечную недостаточность, проявляющийся бактериемическим шоком.
В настоящее время благодаря своевременному применению комплекса терапевтических мероприятий удается добиться значительно лучших результатов лечения больных острой почечной недостаточностью, нежели это имело место 10 лет назад. Так, по данным ряда крупных советских нефрологических учреждений, средний процент выздоровления от острой почечной недостаточности составляет 67; летальность же с каждым годом имеет тенденцию к еще большему снижению. Значительное место в достигнутом успехе несомненно принадлежит различным видам виводиализа (перитонеальный диализ, гемодиализ). Однако виводиализ надо рассматривать не как самостоятельный метод лечения, а лишь как вспомогательный, позволяющий в комплексе с другими видами терапии достичь наилучших результатов в лечении больных острой почечной недостаточностью.
Литература
Аграненко В. А. В кн.: Материалы V Всесоюзной конференции урологов. М., 1965, стр. 83.
А л а п и н Г. Я., К ле п и к о в Ф. А. и С е м ч енко Ю. П.Урол. и нефрол., 1967, № 2. А м б у р ж е Ж., Р и ш е Г., Кро с н и е Ж. и Функ - Б р е н т а н о Ж.—Л. Почечная недостаточность. Пер. с франц. М., 1965.
Г е б е р г A. Internat. Monatschr. Anat. u. Physiol., 1885, 2, 223. Голигорский С. Д. В кн.: Материалы V Всесоюзной конференции урологов. М.,
1965, стр. 70. Голубев В. 3. О кровеносных сосудах в почках млекопитающих и человека. Дисс.
Казань, 1894. Горбушина 3. Е. Новокаиновая блокада в лечении ожоговой болезни. Дисс.
Кишинев, 1959.
Д а р е н к о в А. Ф. Урология, 1964, 5, 7.
Даренков А. Ф. Рентгенодиагностика острой почечной недостаточности. Автореф. дисс. М., 1966.
Дунаевский Л. И. и ЯжгурФ. М. Урол. и нефрол., 1965, 3, 24. ДурмишьянМ. Г. иЭголинский. Я. А. Изв. научн. Ин-та им. И. Ф. Лесгафта,
1938, 21, 1—2, 161.
Еланский Н. Н. Хирургия, 1950, 1, 3.
К у з и н М. И. В кн.: Шок и терминальные состояния. Л., 1960, стр. 26 . КучинскийИ. Н. О показаниях и противопоказаниях к применению гемодиализа.
Урол. и нефрол., 1965, 3, 60. Кучинский И. Н. Показания и противопоказания к гемодиаливу. Автореф. дисс.
М., 1965.
Мастика И. Л. Урол. и нефрол., 1965, 4, 33.
МелкумовГ. Г. Проблемы реактивности в патологии. М., 1954, стр. 209. П е т р о в А. Л. Вестн. хир., 1959, 3, 21.
П у н г а В. К. В кн.: Актуальные проблемы нефрологии и урологии. Труды Кишиневск.
мед. ин-та, 1964, 24, 44. Пытель А. Я. Клин, мед., 1936, 6, 838. ПытельА. Я. Печеночно-почечный синдром в хирургии (гепатонефриты). Волгоград,
изд. 1-е, 1938; изд, 2-е, 1941. Пытепь А. Я. Клин, мед., 1945, 9, 3. П ы т е л ь А. Я. В кн.: Вопросы хирургии войны и абдоминальной хирургии (сборник
под ред. Е. Л. Березова). Горький, 1946, стр. 119.
ПытельА. Я. В кн.: Труды XXVI Всесоюзного съезда хирургов. М., 1956, стр. 51. ПытельА. Я. В кн.: Многотомное руководство по хирургии. Под ред. Б. В. Петровского. Т. VIII. М., 1962, стр. 68. Пытель А. Я. и Голигорский С. Д. Острая почечная недостаточность.
Кишинев, 1963.
П ы т е л ь А. Я. и Голигорский С. Д. Вестн. хир., 1965. 6, 66. ПытельА. Я. и Голигорский С. Д. Урол. и нефрол., 1965, 2, 30. ПытельА. Я., К у ч и н с к и й И. Н. и Ч е б а н ю к Г. М. Урол. и нефрол., 1965,
3, 16. РуснякИ., ФельдиМ. и Сабо Ц. Физиология и патология лимфокровообраще-
ния. Будапешт, 1957.
РуфановИ. Г. Сов. хир., 1933, 5, 1—3, 391. С е р о в В. В. и С о л о в ь е в а Н. П. Арх. патол., 1961, 1, 71. СтернинМ. О. Хирургия, 1961, 7, 93. Т а р е е в Е. М. Почки и организм. М., 1933. Т а р е е в Е. М. Нефриты. М., 1958.
Федорове. П. Хирургия почек и мочеточников. В. 1. Пг., 1923. Франкфурт А. Н. Гепаторенальный синдром. Киев, 1940.
Alwall N., Therapeutic and diagnostic problems in severe renal failure. Stockholm 1964.
Atlas D. H.a. Gaberman P., Reversible renal insufficiency. Diagnosis and treatment Baltimore, 1958.
BeiselW. R., HerndonE. G. a. MyersJ. E., Arch, intern, med., 1959, 104, 539.
В о e n S. Т., Peritoneal dialysis in clinical medicine. Springfield, 1965.
Borst J. G. G., Lancet, 1948, 1, 824.
В о у с е F. F., The role of the liver in surgery. Springfield, 1941. . В run C, Acute anuria. Munksgaart, Copenhagen, 1954.
BurgheleTh. et ProcaE., Chirurgia, 1962, 6, 801.
BurgheleTh. et RugendorffEr. W., Le rein des etats de choc. Physiopatholo-gie, morphopathologie, clinique, indications therapeutiques. Bucarest, Ed. Acad et Paris, Ed. Masson, 1966, p. 426.
BywatersE.G.L, Brit. med. J., 1941, 1, 427.
В у w a t e r s E. G. L., J. A. M. A., 1944, 124, 1103.
ChorcherCh. u. LoblichH., Virchows Arch., 1960, 333, 6, 578.
D a v i s S. H., J. Path. Bact., 1960, 79, 2, 337.
DerotM. et Prunier Ph. Les consultations journalieres en nephrologie. Paris, 1963.
Derot M., Tchobroutsky G., Mauvais-Jarvis P. et Guedon J J d'Urol., 1961, 1, 57.
D i m i t r i u С. С. et В е г о n i a d e V., Nefrologie. Bucuresti, 1963.
D о у 1 e J. E., Extracorporeal hemodialysis therapy in blood chemistry disorders. Springfield, 1962.
F i n e 1 e A. L., Urol., 1953, 70, 665.
FishbergA. M., Hypertension and nephritis. 5th edition. Philadelphia, 1954.
F u с h s F. u. P о p p e r H., Virchows Arch., 1937, 299, 203.
G a s t e у е г К. Н., Urologe, 1966, 6, 271.
GavrilescuS. etGavrilescu M., Medicina interna, 1958, p. 361. ч
Grollmann A., Acute renal failure. Springfield, 1954.
Guevara-Roj as A., XIIIе Congres de la Soc. Internat. d'Urologie. Londres, 1964. Edinburg a. London, 1964, p. 249.
Hamburger J., Presse med., 1960, 6, 279.
Hamburger J., Richet G., Crosnier J. et F u n с k - В r e n t a n о J. L., L'insuffisance renale. Handbuch der Urologie. Bd. IV. Berlin—Gottingen—Heidelberg 1962.
H a n о J. E., Shear L. a. Barry K. G., Ill Internat. Congress of Nephrology. Washington, 1966, v. II, p. 206.
HenschenC, Arch. klin. Chir., 1932, Bd. 173; Kongressbericht, 1932, S. 488.
HeydCG., J. A. M. A., 1931, 97, 1847.
L e g u e u F. Lithiase renale. Encyclopedie francaise d'Urologie. T. II. Paris, 1914.
L e Q u e s n e L. P., Surg. Gyn. Obst., 1961, 1—3, 1, 1.
M i г о u z e J., F a u r e H. et al., Presse med., 1960, 48, 1777.
MonsaingeouA., TauretP. etDaussyM., Presse med., 1949, 81, 1212.
M u г p hy J. J., M у i n t M. K., R a 11 n e r W. H., J. Urol., 1958, 80, 1, 1.
O'G о n n о r V. J., L i b г e 11 i J. V. a. Gr а у h а с к Т., J. Urol., 1961, 86, 2, 276.
Olanescu Gh., Georgescu L. et Dimitriu M., Insuficienta renala acuta.
Bucuresti, 1959.
P г о с а Е., Insuficienta renala acuta. Buouresti, 1957. Reubi F., Nephrologie chlinique. Paris, 1961. R h a m у R. K. a. S e g a r W. В., J. Urol., 1961, 86, 2, 205. SchreinerG. E. a. MaherJ. E., Uremia: biochemistry, patliogenesis and treatment.
Springfield, 1961.
ShumackerH. B. a. GarrettR., Surg. Gyn. Obst., 1955, 100, 6, 758. S'p a n n e r R., Anat. Anz., 1924, 58, 23.
T а у 1 о r W. H. a. R e i d J. V. O., Brit. J. Surg., 1958, 46, 196, 136. True t a J., Bar clay A. E., Daniel R. M., Franklin K. J. a. Pri chard
M. M. L., Studies of the renal circulation. Oxford, 1948.
V a s s a 11 i P. et R i с h e t G., I Congres Internat. nephrol. (1960), Basel, 1961, p. 236. W i n t о n F. R., Transact. Ill Confer, in renal function. New York, 1952. Zollinger H. U., Anurie bei Chromoproteinurie. Stuttgart, 1952. Z о s i n C. Actualitati de patologie renala. Bucuresti, 1958.
Глава девятнадцатая
Заболевания сосудов почек, нефрогенная гипертония
Нефрогенная гипертония чаще всего возникает вследствие первичного сте-нозирующего поражения почечной артерии и ее главных ветвей или первичного поражения почечной паренхимы в результате хронического пиелонефрита. Исходя из этого, различают нефрогенную гипертонию пиелонефритического и ангиогенного генеза; последнюю часто именуют вазоренальной гипертонией.
Много реже приходится наблюдать гипертонию нефрогенного генеза у больных прочими заболеваниями почек, как-то: туберкулезом, опухолью, гидро- и пионефрозом, осложненным калькулезом, кистозными заболеваниями и др.
В настоящей главе мы ограничимся описанием тех видов нефрогенной гипертонии, которые обусловлены преимущественно односторонними поражениями почек, главным образом хроническим пиелонефритом, и стеноти-ческими поражениями почечных артерий.
Патогенез. Многочисленными исследованиями ряда экспериментаторов (Goldblatt, 1934, 1964; Page, 1939; Hawthorne с соавт., 1953, и др.) установлено, что сужение почечной артерии вызывает у животных развитие гипертонии вследствие активного выделения ренина ишемичвской тканью почки. Такой же гипертензивный эффект наблюдается у людей при сужении просвета почечных сосудов.
А. М. Вихерт (1963), А. А. Крамер, А. М. Вихерт, П. П. Герасименко и Н. А. Ратнер (1964) обнаружили в удаленных почках у больных нефрогенной гипертонией высокую активность ренина при одновременном наличии гиперплазии, гипертрофии и значительно выраженного гранулирования клеток юкстагломерулярного аппарата. Их исследования подтверждают положение о значении юкстагломерулярного аппарата в секреции ренина и роль гиперфункции юкстагломерулярных клеток в повышенной продукции ренина и, следовательно, развитии гипертонии.
Возникновение почечной гипертонии основывается не только на гумо-рально-действующем принципе ренин-ангиотензивного механизма, но и на сложном совместном действии прессорных субстанций, внутри- и внеклеточных электролитных сдвигов и функции коры надпочечников (увеличение секреции альдостерона).
С того времени, как ведутся исследования по изучению функциональных нарушений в почках, вызывающих гипертонию под влиянием ренина-ангиотензина, существует мнение, согласно которому нормальная здоровая почка может предупреждать развитие гипертонии, а последняя возникает вследствие нарушения противогипертензивной функции почек (В. В. Парин и Ф. 3. Меерсон, 1960; Grollman, 1964; Albrecht, 1966; Kawazoe, 1966, и др.). Полагают, что гипертония является следствием недостатка антипрессорной субстанции, вырабатываемой нормальной почкой.
Доказано, что гипертензивные лица не способны нейтрализовать вазо-констрикторную активность ангиотензина в периферической крови в такой степени, как нормотензивные лица.
Несомненно, что наличие нормальной интактной почечной ткани является важным обстоятельством для сохранения нормального артериального давления и что нормальная почечная ткань обладает защитной функцией resp. антигипертензивной функцией в отношении гипертонии.
Согласно исследованиям Muirhead (1960), есть основание считать, что в ткани мозгового слоя почки вырабатывается антигипертензивное вещество. Хотя имеется еще недостаточно сведений о механизме, которому нормальная почка оказывает свое защитное антигипертензивное действие, однако концепция о том, что интактная почка обладает способностью активно сек-ретировать депрессорную субстанцию или разрушать циркулирующие в крови прессорные вещества энзимным путем, заслуживает большого внимания и должна учитываться клиницистами при изучении многогранной проблемы — патогенеза гипертонической болезни.
Нефрогенная гипертония может протекать в доброкачественной и злокачественной форме. Доброкачественная гипертония характеризуется ди-астолическим артериальным давлением ниже 120 мм рт. ст. и ретинопатией; злокачественная гипертония — диастолическим давлением постоянно выше 120 мм рт. ст., ретинопатией и иногда почечной недостаточностью.
Стенозирующие и окклюзирующие поражения почечной артерии, приводящие к гипертонии (вазоренальная гипертония)
Артериальная гипертония, вызванная окклюзирующими заболеваниями почечной артерии, встречается у 10—15% среди всех больных гипертонией вообще (Albrecht, 1965; Poutasse, 1964) и у 30% среди больных нефрогенной гипертонией (Auvert, 1963; Poutasse, 1964).
Существуют значительные вариации как в видах, так и в локализации стенотических и окклюзивных поражений почечных артерий. Наиболее частой причиной стенотического поражения почечной артерии является атеросклероз, встречающийся среди всех видов стеноза почечной артерии в 62%. Атеросклеротические окклюзивные поражения в виде атероматоз-ных бляшек локализуются у 74% больных в проксимальных сегментах почечной артерии вблизи аорты; много реже, у 16% больных атероматоз-ные утолщения интимы наблюдаются в среднем сегменте артерии и весьма редко в дистальной части артерии, вблизи бифуркации ее — у 5% больных и столь же редко в ветвях почечной артерии (5%). Атеросклеротические бляшки, локализующиеся в добавочных артериях, могут также привести к их стенозу и тем самым вызвать нефрогенную гипертонию; по De Bakey с сотр. (1964), это встречается у 10% больных. В группе больных ате-росклеротическим стенозом почечной артерии мужчин больше, чем женщин (2 : 1).
Следующим видом стенотического поражения почечной артерии является сегментарная фибромускулярная гиперплазия, встречающаяся у 24% больных вазоренальной гипертонией. Этот вид поражения, локализующийся в средней трети артерии, наблюдается преимущественно у молодых женщин. Мужчины заболевают редко; соотношение женщин и мужчин 5:1. Стенки почечной артерии при фиброму окулярной гиперплазии содержат большое количество соединительной ткани с большими очагами гипертрофированной мышечной оболочки. В таких случаях имеются множественные, следующие друг за другом^ циркулярные сужения артерии с постсте-нотической дилятацией после каждого сужения. Это создает картины весьма напоминающие колье из жемчуга или бисерную цепочку Первичные ветви почечной артерии фибромускулярной гиперплазией обычно не поражаются,
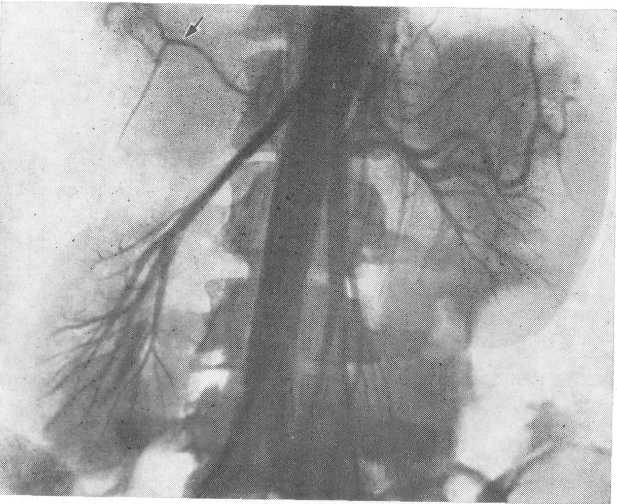
Рис. 234. Нефроптоз, приведший к гипертонии. Вертикальная почечная ангиография по Сельдингеру. Симптом „Метлы". Стрелка указывает на a. suprarenalis.
К стенотическим поражениям почечной артерии следует отнести чрезмерное ее натяжение и ротацию при нейроптозе, приводящие к резким гемодинамическим расстройствам, содействующим возникновению гипертонии (8%). Почечная артерия при нефроптозе сильно изгибается и суживается, а почечная вена сильно расширяется, принимая косое направление снизу вверх, особенно при значительных физических напряжениях больного; вследствие этого возникает ишемия почки. А. Я. Пытель и Н. А. Лопаткин (1965) показали, что патологически подвижная почка может обусловить развитие, фибромускулярной гиперплазии почечной артерии и тем самым привести к гипертонии (рис. 234).
Остальные виды стенотических поражений почечной артерии способных вызвать гипертонию, наблюдаются редко, в среднем в 6% случаев К ним относятся: врожденный стеноз артерии (наиболее частая причина гипертонии у детей), аневризма почечной артерии, травматический тромбоз и эмболия, коарктация аорты со стенозом почечной артерии панарте-риит аорты и ее ветвей, тромбангиит и др. У больных нефрогенной гипертонией иногда приходится наблюдать стенотическое поражение почечной артерии одновременно с пиелонефритом.
Гипертония, возникающая вследствие стенозирующего поражения почечной артерии, по существу представляет собой синдром Гольдблатта.
Его причины двояки: одни вызывают изменение кровообращения по всей почке, другие — инфаркт почки с перифокальной зоной относительной почечной ишемии. К причинам, вызывающим нарушение кровообращения во всей почке, относятся стеноз почечной артерии, аневризма почечной артерии, сдавление сосудистой почечной ножки опухолью или инородным телом, склерозирующий педункулит и др. К причинам, вызывающим гипертонию в результате инфаркта почки, относятся травма почки, оперативные вмешательства на почке и добавочных ее сосудах, эмболия почечной артерии, возникающая при сердечных заболеваниях, тромбоз с непроходимостью ветви почечной артерии. К числу оперативных вмешательств на почке, которые могут привести к гипертонии, относится перевязка добавочного сосуда и резекция почки. Вследствие этого при призводстве резекции почки необходимо следить, чтобы перевязанный сосуд соответствовал удаленному участку почки, а при перевязке добавочного сосуда следует резецировать соответствующий сегмент почки.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Гипертония при синдроме Гольдблатта характеризуется у большинства больных внезапным началом, быстрым развитием и тенденцией к злокачественному течению. Однако встречаются больные, у которых болезнь долгое время протекает доброкачественно и не сопровождается другими симптомами гипертензивного сосудистого заболевания.
Продолжительность гипертонии весьма вариабельна. Так, у одних больных она длится лишь несколько недель или месяцев, проявляясь тяжелыми симптомами, а у других — несколько лет, протекая доброкачественно.
Гипертония, обусловленная заболеванием почечных сосудов, наблюдается в любом периоде жизни, однако у большинства — в возрасте от 20 до 40 лет и чаще всего у женщин (отношение полов 2,5:1). Уровень повышения артериального давления различен. Для почечной гипертонии вообще и особенно для гипертонии, обусловленной значительным сужением почечной артерии, характерны высокие цифры диастолического давления. У некоторых больных диастолическое артериальное давление достигает 170 мм рт. ст. Почечная функция — глобальная — сохраняется довольно долго.
Офтальмологическое обследование больных устанавливает ясно выраженную ретинопатию лишь у 30%. У большинства больных ангиоспасти-ческие изменения сетчатки указывают на относительно недавнюю гипертонию.
У многих больных при аускультации живота обнаруживают шум. Он отчетливее всего выслушивается в правом или левом верхнем квадранте и по задней стенке грудной клетки. Наличие этого признака указывает на возможность окклюзивной болезни почечной артерии. Шум обычно несильный, систолический и легко может быть отдифференцирован от шума, выслушиваемого при артерио-венозной фистуле почки, при которой, как и при атероматозном поражении брюшной аорты, шум грубый и продолжительный. Наличие в верхней части живота длительного высокочастотного шума с поздним систолическим усилением является важным признаком, говорящим в пользу фиброзного и фибромышечного стеноза почечной артерии у гипертензивных больных.
ДИАГНОСТИКА
Больные, у которых г.ипертония развилась до 35-летнего возраста или после 55 лет либо у них неожиданно возникла гипертония после острых болей в пояснице, весьма подозрительны в отношении наличия у них гипертонии, обусловленной поражением крупных сосудов почки. Неожиданное возникновение гипертонии или внезапное резкое ухудшение до того доброкачественно протекавшей гипертонии также является весьма подозрительным для реноваскулярного ее генеза.
Такие исследования, как экскреторная урография, изотопная реногра-фия, дифференцированные тесты экскреторной функции почек, пункцион-ная биопсия почек и особенно почечная ангиография (аортография), обеспечивают отбор больных нефрогенной гипертонией для оперативного лечения среди большого числа страдающих гипертонической болезнью.
Экскреторная урография. Согласно нашим наблюдениям, экскреторная урография устанавливает чаще всего замедленное выделение почкой рент-геноконтрастного вещества при нормальной картине мочевых путей на ретроградной пиелограмме. При длительном существовании стенозирую-щего процесса в почечной артерии отмечается уменьшение объема почки. Различие в длине на 2 см и больше свидетельствует об атрофии почки, что может быть обусловлено сосудистой ее недостаточностью. Отставание в интенсивности тени от рентгеноконтрастного вещества на первом уже снимке при экскреторной урографии позволяет заподозрить нарушение сосудистой гемодинамики почки. Далее по нефрографическому эффекту на снимках, производимых в течение первых 3 минут после быстрого введения в вену рентгеноконтрастного вещества, можно основательно заподозрить по уменьшенной тени почки или сегментарной атрофии ее заболевание почечных артерий. Особенно ценной оказывается томография в комбинации с экскреторной урографией, выполняемая спустя 15 минут после внутривенного введения рентгеноконтрастного вещества. У многих больных с заболеваниями почечной артерии удается обнаружить на экскреторных уро-граммах значительные различия в размерах почек и во внешних их контурах, а также плохой нефрографический эффект либо одностороннюю гиперконцентрацию контрастного вещества.
Важно знать, что экскреторная урограмма может быть нормальной у больных артериальной гипертонией, обусловленной поражением почечной артерии. У 2/3 больных все же удается отметить некоторые отклонения от нормы, позволяющие заподозрить реноваскулярную гипертонию.
Иногда обнаруживают атрофию только части почки вследствие окклю-зирующего заболевания одной из ветвей почечной артерии или добавочного сосуда. В таких случаях контур почки изменен с истончением коркового слоя в атрофичной зоне; чашечки в этой зоне тонкие, узкие по сравнению с широкими и более четко выраженными чашечками в нормальной части почки.
Степень интенсивности концентрации контрастного вещества почкой и время его появления на урограмме, а также уменьшение в размерах почки говорят в пользу поражения почечной артерии, приведшего к гипертонии; однако ни один из этих признаков не может считаться точным для диагностики гипертонии почечного происхождения. Только аортография является в полной мере надежным методом, обеспечивающим точное распознавание поражения основных сосудов почки.
Радиоизотопная ренография иреносцинтиграфия (скеннография).Радиоизотопная ренография позволяет судить о кровоснабжении почки, канальцевой функции и экскреции мочи каждой почкой в отдельности (рис. 235, а). Реносцинтиграфия дает представление о контурах и структуре почки, даже при тяжелой почечной недостаточности (рис. 235, б).
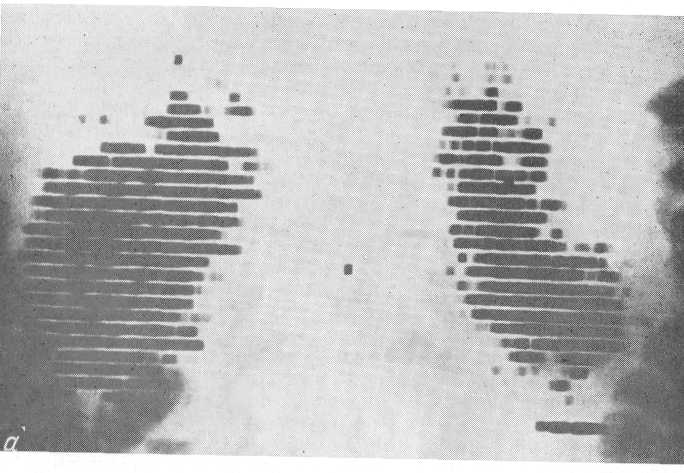
Рис. 235. Инфаркт верхнего полюса левой почки, гипертония.
а – почечная скенограмма; б – изотопная ренограмма; 1 – экскреторная фаза; 2 – функциональная фаза;
3 – сосудистая фаза
При нарушении проходимости почечной артерии отмечается заметное снижение первого подъема кривой, т. е. сосудистой артериальной фазы с больной стороны, задержка радиоактивности больной почкой, уменьшение васкулярного индекса и рост паренхиматозного индекса.
Радиоизотопная ренография дает в 82% случаев правильную оценку функционального состояния почек в результате ишемического их поражения. Однако нормальные ренограммы не исключают заболеваний почечной артерии, ее основных ветвей и добавочных артерий почки
De Bakey (1964) показал, что у 13% больных вазоренальной гипертонией изотопные ренограммы оказываются нормальными, и, следовательно их результаты могут иногда неправильно указывать сторону почечного поражения. При поражении одной из основных ветвей почечной артерии ренограммы бывают неизменными у 60% обследованных больных.
Функциональные клиренстесты. Помимо данных экскреторной уро-графии, результатов изотопной ренографии, важны показатели клиренса инулина, эндогенного креатинина и парааминогиппуровой кислоты каждой почки в отдельности.
При стенозирующих и окклюзирующих заболеваниях почечной артерии или основных ее ветвей инулин и креатинин находятся в моче в увеличенной концентрации в связи с повышенной реабсорбцией их канальцами ишемической почки.
Положительный тест Говарда, показывающий уменьшение концентрации в моче натрия и хлора и уменьшение выделения почкой воды, считается якобы характерным для стеноза почечной артерии. Однако большая потеря соли и воды является своеобразной физиологической реакцией на пиело-нефритические изменения. Такая реакция может наблюдаться при пиелонефрите независимо от того, является ли он причиной гипертонии или нет. Следовательно, катетеризационно-мочеточниковый метод Говарда не в состоянии отдифференцировать гипертонию, обусловленную стенозом почечной артерии или хроническим пиелонефритом.
Показатели дифференциальной реабсорбции натрия и воды по методу Говарда оказываются ошибочными в 20% случаев, вследствие чего для диагностики одностороннего поражения почек рекомендуют данные теста Говарда сопоставлять с клиренсом креатинина и парааминогиппурана.
Rapoport (1960), Stamey с сотр. (1961) и др. предложили модификации катетеризационно-мочеточниковых клиренс-методов, получивших широкое применение.
Раздельное определение функционального состояния почек при помощи клиренса эндогенного креатинина и других клиренс-тестов следует проводить в следующих случаях: 1) когда имеются указания на двустороннее заболевание почечных артерий и необходимо установить степень наибольшего поражения в одной из почек; 2) когда почечная ангиограмма технически оказалась неудовлетворительной; 3) когда имеются противопоказания к почечной ангиографии; 4) когда не исключается возможность нефр-эктомии, хотя планируется выполнение органосохраняющей операции (реваскуляризация почки).
В распознавании гипертонии, обусловленной поражением почечной артерии, следует учитывать показатели следующих функциональных тестов.
Почка с односторонним стенотическим resp. окклюзирующим заболеванием почечной артерии имеет уменьшенный ток плазмы, устанавливаемый с помощью клиренса парааминогиппуровой кислоты, и увеличенную реабсорбцию воды, превосходящую 45%, что вызывает гораздо большую ос-мотичность плазмы, нежели в контралатеральной почке. Помимо этого, на ранней экскреторной урограмме, произведенной через 1—2 минуты после внутривенного введения контрастного вещества, и на снимке, сделанном вскоре после почечной ангиографии, отмечается при односторонних вазо-ренальных поражениях уменьшение нефрографического эффекта на больной стороне; это связано с уменьшенным током плазмы. На последующих -экскреторных урограммах имеет место увеличение плотности контрастного вещества на пораженной почке, что обусловлено повышенной реабсорбцией воды с последующей усиленной концентрацией контрастного вещества. Уменьшенная концентрация контрастного вещества на поздних урограммах может указывать на канальцевую дисфункцию или уменьшенную клубочковую фильтрацию. Таким образом, при односторонних сосудистых поражениях, когда клубочковая фильтрация и тубулярная функция нарушены не сильно, можно видеть разницу в концентрации контрастного вещества пораженной и непораженной почкой, что выражается в увеличенной плотности почечной тени на больной стороне, поскольку тубулярный аппарат сохраняет повышенную способность реабсорбировать воду. В далеко зашедших стадиях болезни со значительным угнетением клубочковой фильтрации и тубулярной функции способность концентрировать резко уменьшается. В таких случаях вместо увеличенной концентрации имеет место уменьшение ее на пораженной стороне. То же самое происходит при .двусторонних стенотических процессах почечных артерий; в таких случаях нельзя ожидать различия в концентрационной функции и нефрографическом эффекте, особенно когда имеется одинаковая степень поражения.
Значительная разница в длине почек на экскреторных урограммах в случаях одностороннего почечного заболевания, особенно когда эта разница сопровождается уменьшенным нефрографическим эффектом на пораженной стороне, является важным признаком, говорящим в пользу рено-васкулярной причины гипертонии. Разница по длине 1 см или более, а также запаздывание в появлении тени контрастного вещества в одной почке, особенно на первой рентгенограмме, являются показаниями для почечной ангиографии.
Пункционная биопсия почки. С помощью почечной биопсии можно выявить ранние признаки артериосклероза и других поражений почек, приводящих к гипертонии, которые не всегда удается обнаружить при функциональном исследовании почек. Хотя этот метод не всегда позволяет получить ответ в отношении установления причины нефрогенной гипертонии, однако он находит применение в тех случаях, когда обычные диагностические методы не позволяют уточнить вид гипертонии, а в лечении больного возникает необходимость назначения оперативного пособия.
Пункционную биопсию почки применяют главным образом у больных, у которых гипертония вызвана нарушением проходимости почечной артерии, а также у больных хроническим пиелонефритом, приведшим к гипертонии. Помимо этого, показаниями к почечной биопсии являются: необходимость установления характера морфологических изменений в „здоровой" почке у больных нефрогенной гипертонией, обусловленной хроническим пиелонефритом в другой, контралатеральной почке; необходимость получения сведений о морфологических изменениях в обеих почках у больных вазоренальной гипертонией.
Итак, больные с соответствующими анамнестическими, клиническими и пиелографическими данными, а также показателями теста Говарда и Рапопорта, указывающими на нефрогенное происхождение гипертонии, должны быть подвергнуты почечной ангиографии, несмотря на те или иные показатели изотопной ренографии и сцинтиграфии. Изотопная ренография в состоянии лишь установить степень функциональных расстройств вследствие заболевания почечной артерии, но не в состоянии установить локализацию, вид и степень окклюзирующего сосудистого поражения почки.
Почечная ангиография. Для окончательного диагноза стенозирующего поражения почечной артерии и заболеваний почечной паренхимы, приводящих к нефрогенной гипертонии, часто прибегают к почечной ангиографии. Это исследование надо производить лишь тем больным гипертонией, у которых результаты предшествующих исследований, произведенных другими методами, указывают на восможную заинтересованность в ее возникновении и развитии поражения почечных артерий. Однако приступить к ангиографии следует тогда, когда больному можно помочь и если вероятный риск проводящегося исследования оправдывается возможностью излечения больного или облегчения его состояния.
Предпочтительнее трансфеморальный метод по Сельдингеру перед методом транслюмбальным. На почечных ангиограммах хорошо бывает виден стеноз почечной артерии, а дистальнее его — веретенообразное расширение артерии. На нефрограммах — уменьшение величины пораженной почки. Наиболее частой локализацией сужения почечной артерии оказывается участок, расположенный вблизи аорты.
Ангиографические признаки различных стенозирующих и окклюзирующих поражений почечной артерии, вызывающих гипертонию. Среди поражений почечной артерии, приводящих к гипертонии, наиболее простым и наглядным является нефроптоз. У больных с патологически подвижной почкой, проявляющейся гипертонией, почечная артерия оказывается натянутой, резко вытянутой; она отходит от аорты под острым углом, диаметр ее сужен. Удлиненные и располагающиеся в форме метлы ветви ее указывают на значительную торзию не только артериальных, но и венозных сосудов. Почечная вена патологически мобильной почки обычно оказывается весьма контрастной и имеет косое направление снизу вверх. Такое натяжение и ротация почечных сосудов приводят к резким гемодинамическим расстройствам, причем в большей степени венозного, нежели артериального характера.
Выраженный локализованный стеноз артерии в результате интрамурального фиброза с постстенотической дилятацией ее является тяжелым поражением почечной артерии. Картина стеноза почечной артерии на ангиограмме настолько типична, особенно при наличии постстенотической дилятации, что не требует специального описания. Симметричное сужение локализуется всегда в средней трети артерии. Нефрограмма при этом заболевании ничем не отличается от нормальной.
Атеросклеротический стеноз почечной артерии, приводящий к ее деформации, обусловлен атероматозной бляшкой с тромбозом или без него и располагается чаще всего вблизи аортального отверстия артерии (рис. 236). Такой стеноз может сочетаться с постстенотической дилятацией артерии или без таковой. На ангиограмме этот вид стеноза выявляется дефектом в аорте, туго наполненной контрастной жидкостью; дефект обусловлен бляшкой, располагающейся вблизи устья почечной артерии. Часто на ангиограмме атеросклеротический стеноз артерии сочетается с другими признаками атеросклероза аорты и ее ветвей.
Фибромышечный стеноз локализуется в средней и дистальной трети основной артерии или ее главных ветвей. Такой же стеноз может поражать и добавочные почечные артерии. Характеризуется неравномерными очагами гиперплазии фиброзных или фибромышечных элементов артериальной стенки и ангиографически выявляется в виде многоочагового концентрического сужения артерии, создавая бисерную картину или картину аккор-деонообравной складчатости пораженной части сосуда (рис. 237). У большинства больных такой стеноз располагается на 2 см дистальнее места отхождения артерии от аорты.
Рис. 236. Стеноз правой почечной артерии с постстенотической дилятацией. Гипертония. Транслюмбальная аортография.
Рис. 237. Правосторонний нефроптоз. Фибромускулярная гиперплазия правой почечной артерии. Гипертония. Вертикальная почечная ангиограмма по Сельдингеру.
Для тромбоза (эмболии) почечной артерии и ее ветвей характерным ангиографическим симптомом является наличие уже на первых начальных ангиограммах слепого окончания ствола почечной артерии или одной из ее основных ветвей. Нефрограмма характеризуется сегментарным выпадением тени части почечной паренхимы при эмболии или тромбозе одной из ветвей артерии, а при тромбозе основного ствола артерии нефрограмма вовсе отсутствует. Тромбоз почечной артерии осложняет вообще артериальную гипертонию. Он наблюдается при калькулезном пионефрозе, кавернозном туберкулезе почки, опухолях с прорастанием новообразования в сосуды. Тромбоз почечной артерии встречается у 10% всех больных нефрогенной гипертонией.
Панартериит аорты и ее ветвей. Среди поражаемых при этом заболевании крупных ветвей аорты вовлекаются часто в стенозирующий процесс и почечные артерии, что приводит к ишемии почек и, следовательно, к гипертонии. На аортограмме находят узурацию стенок брюшной аорты; наряду с сужением почечной артерии, начиная от места отхождения ее от аорты, иногда отмечается признак обрыва контрастной тени, указывающий на тромбоз артерии. Часто наблюдаются стенотические поражения и других ветвей аорты.
Аневризма почечной артерии. До внедрения в практику аортографии это заболевание прижизненно диагностировали исключительно редко. Аневризма имеет мешкообразный или веретенообразный вид и чаще всего атеросклеротическую этиологию. Располагается преимущественно в области ворот почки. Стенки аневризмы почечной артерии часто кальцинируются, и обусловленная этим тень бывает хорошо видна на рентгенограмме, что содействует распознаванию аневризмы. Разновидностью аневризмы почечной артерии является так называемая расслаивающаяся аневризма. При ней на артериограмме видно мешкообразное расширение с двойным просветом в центре его и по периферии. Только благодаря ангиографии удается определить размеры аневризмы, локализацию ее и взаимоотношение с почкой, ее сосудами и тем самым определить характер и масштаб оперативного пособия.
Нарушение гемодинамики почки вследствие артерио-венозного свища между почечной артерией и почечной веной может привести к тяжелой гипертонии (X. П. Блатной, 1964). Такие свищи бывают конгенитального происхождения, часто ангиоматозного типа или приобретенного характера. В последнем случае основную роль играет травма [операции на почке, почечная пункционная биопсия (Turner и Jacobson, 1965; Bennett и Wiener, 1965), паранефральная блокада и др.]. Важным диагностическим признаком является прослушивание в поясничной области постоянного отчетливого шума, а при пальпации соответствующей почечной области отмечается постоянное „вибрирующее" колебание. Аортография (почечная ангиография) позволяет установить наличие артерио-венозной аневризмы в почке. В литературе к 1964 г. было описано 34 случая посттравматического артерио-венозного свища почки; у 29 человек заболевание сопровождалось гипертонией, которая у половины исчезла после нефрэктомии.
Итак, почечная ангиография является весьма ценным методом распознавания локализации и размера стенозирующего или окклюзирующего заболевания почечной артерии, приводящего к артериальной гипертонии. Клинические и лабораторные, а также обычные рентгенодиагностические исследования позволяют чаще всего лишь заподозрить в большей или меньшей степени заболевание почечной артерии. Ангиография является наиболее ценным методом установления стенотического поражения почечной артерии и только она одна позволяет определить поражение добавочных артерий, обусловливающее гипертонию.
Однако в ряде случаев окончательный диагноз стенозирующего поражения возможен лишь во время самой операции путем установления значительной разницы в давлении в аорте, в до- и постстенотическом сегментах почечной артерии (Hocken, 1966).
ЛЕЧЕНИЕ
В зависимости от характера и локализации стенотического поражения почечной артерии производят различные оперативные вмешательства и чаще всего: эндартериэктомию — продольную, поперечную, чрез-аортальную с пересадкой в образовавшийся дефект сосуда аутогенной вены или заплатки из синтетического материала (дакрон, тефлон и др.); резекцию суженного сегмента артерии с наложением анастомоза конец в конец; резекцию суженного участка артериис применением сосудистого гомотрансплантата между концами артерии или наложением анастомоза между периферическим концом артерии и аортой; обходной сосудистый анастомоз между аортой и почечной артерией при помощи искусственного трансплантата—-by-pass; спленоренальный артериальный анастомоз конец в бок или конец в конец. Наряду с этим приходится производить резекцию почки в случае стеноза или окклюзии добавочной артерии или одной из главных ветвей a. renalis; геминефрэктомию подковообразной или удвоенной почки; и, наконец, нефрэктомию, когда невозможно выполнить реконструктивную операцию на артерии для восстановления нормального кровообращения в почке.
Эндартериэктомия resp. тромбинтимэктомия с лоскутной пластикой является преимущественным методом лечения относительно коротких, ограниченных поражений артерии. Через стенозирующий сегмент артерии производят разрез, распространяющийся проксимально и дистально в неизмененные части артерии. Стенозирующую бляшку удаляют и образовавшийся в артерии дефект закрывают лоскутом из аутогенной вены (v. saphena, v. spermatica interna seu v. ovarica) или пластмассовой заплатой (из дакрона, тефлона и др.) эллиптической формы. В некоторых случаях применяют лоскутную ангиопластику без эндартериэктомии; такая операция применяется тогда, когда бляшкообразное поражение стенки артерии имеет гладкую поверхность и мало приподнимает интиму, локализуясь лишь на ограниченном участке сосуда. При стенозе юкстааортальном применяют резекцию артерии и аортальную реимплантацию после бокового пережатия аорты несползающим зажимом De Bakey. Если прямая реимплантация невозможна, то производят промежуточное протезирование между пересеченной почечной артерией и аортой при помощи трубки из дакрона или сегмента консервированной артерии. By-pas s-пластика является весьма эффективным методом восстановления нормальной циркуляции в почке для лечения стенозирующих и окклюзирующих поражений почечной артерии. Во избежание необратимой гибели почечной паренхимы срок полного выключения почечной артерии из кровотока должен быть минимальным, не более 30 минут. Операцию by-pass применяют в различных вариантах в зависимости от характера и размеров стенози-рующего поражения артерии. Для создания аорторенального шунта применяют либо трубку из дакрона, либо консервированную артерию. Трансплантат имплантируют с одной стороны в абдоминальную аорту ниже почки, а с другой стороны — зону постстриктурной дилятации почечной артерии. Анастомоз между селезеночной и почечной артерией может быть наложен конец в бок, что выгоднее, или конец в конец. Эта операция считалась до недавнего времени выполнимой только при заболевании левой почки; однако Luke (1960) показал, что она может быть с успехом произведена и при заболевании правой почечной артерии. При данной операции нет необходимости удалять селезенку, так как она получает достаточно крови через короткие артерии желудка (аа. gastricae breves).
Двустороннее поражение артерий требует сложного оперативного пособия. В таких случаях показана резекция с сшиванием конец в конец сосуда с промежуточным трансплантатом или без него; может быть использован и двусторонний by-pass. Наряду с этим применяют реваскуляризацию при помощи аортального протеза, каковым может быть: а) сегмент консервированной аорты с двумя почечными артериями; б) протез из дакрона, заменяющий бифуркацию аорты с одним или двумя шунтами к почечным артериям.
У больных с тяжелым общим состоянием, которые не смогут перенести обширное и длительное оперативное вмешателсьтво, лучшим методом при одностороннем поражении является нефрэктомия. Последняя показана также в случае, когда восстановление нормального кровообращения в почке технически невыполнимо. Следует иметь в виду то обстоятельство, что почка на стороне поражения может оставаться гистологически нормальной, поскольку дистальнее стеноза в почечной артерии кровяное давление низкое, в то время как в противоположной почке вследствие существующей гипертонии может оказаться нефросклероз. При таких обстоятельствах удаление почки на стороне поражения явится „жертвоприношением" по существу нормального органа, и это может ускорить начало почечной недостаточности, возникновение которой будет зависеть от функции противоположной, склеротически измененной почки. Возможность этого следует всегда иметь в виду при установлении показаний к оперативному вмешательству, особенно нефрэктомии.
Рис. 238. Оперативный подход к почечным сосудам.
Чаще применяют трансперитонеальный оперативный подход, поскольку он позволяет: 1) легче и шире обнажить почечные сосуды с обеих сторон, 2) осмотреть надпочечники и на большем протяжении аорту и 3) произвести биопсию обеих почек. Большинство хирургов и урологов предпочитает производить лапаротомию поперечным разрезом в верхнем отделе живота, реже — срединным разрезом. Торакоабдоминальный разрез удобен для операции при односторонних поражениях. По нашему мнению, наилучшим подходом к почечным сосудам для выполнения на них реконструктивных, пластических операций является поперечное чревосечение над пупком от свободного конца одного XI ребра до свободного конца другого XI ребра (рис. 238).
Непосредственный доступ к почке и ее сосудам осуществляем путем рассечения заднего париетального листка брюшины над почкой и мобилизацией печеночной и селезеночной флексур ободочной кишки. Если операция производится на сосудах правой почки, то необходима мобилизация двенадцатиперстной кишки в медиальную сторону с тем, чтобы можно было выделить нижнюю полую вену и аорту.
Прежде чем предпринять надлежащий вид вмешательства на а. rеnаlis, необходимо произвести манометрическое определение давления в аорте и в почечной артерии дистальнее стеноза. При стенотических поражениях почечной артерии градиент давления менее 25 мм рт. ст. наблюдается в 26% случаев, между 25—75ммрт. ст. — в 41% и выше 75 мм рт. ст. — в 33%. Градиенты давления, вызываемого фибромускулярной гиперплазией, оказываются намного выше, чем у больных атеросклеротическим поражением.
Соединение сосудов осуществляют либо швом Карреля при помощи атравматических игл, либо при помощи сосудосшивающего аппарата танталовыми скрепками; большинство хирургов-урологов предпочитает ручной шов атравматическими иглами.
Диаметр применяемого дакронового трансплантата для создания аорто-ренального шунта обычно равен 8 мм.
В урологической клинике II Московского медицинского института 103 больным были произведены различные оперативные вмешательства по поводу нефрогенной гипертонии. Среди них у 46 больных имелись стено-тические или окклюзирующие поражения почечной артерии, притом у 19 стеноз был обусловлен нефроптозом. Возраст больных колебался от 8 до 62 лет. Среди больных было 11 детей.
У сравнительно большого числа наших больных —61 человека — пришлось прибегнуть к нефрэктомии. Объясняется это тем, что у 50 эта операция была произведена по поводу пиелонефритического поражения (так называемая сморщенная почка), приведшего к гипертонии (см. следующий раздел этой главы), а у 11 больных, имевших вазоренальную гипертонию, невозможно было выполнить пластические реконструктивные операции вследствие далеко зашедшего атеросклеротического поражения a. renalis и ее основных ветвей. Столь же большой процент вынужденной нефрэк-томии приводят и другие клиницисты: Kaufman (1965) — 40% нефрзкто-мий, De Camp (1963) — 48%, Smithwick с сотр. (1964) — 85%.
Среди операций, восстанавливающих в полной мере кровоснабжение почки при стенозе почечной артерии, идеальной является спленоренальный артериальный анастомоз. А. Я. Пытелем в 1960 г. успешно была выполнена у 26-летней больной реваскуляризация левой единственной почки путем создания анастомоза между селезеночной и почечной артерией. Спустя 6 лет после операции наложения артериального спленоренального анастомоза пациентка здорова и трудоспособна (рис. 239, 240).
Среди оперированных нами больных атеросклеротический стеноз и фибромускулярная гиперплазия почечной артерии имели место у 24 человек, резко выраженный нефроптоз, приведший к гипертонии, — у 19 человек. У 50 больных гипертония была обусловлена односторонним хроническим пиелонефритом и они подверглись нефрзктомии.
У одной больной была выполнена резекция почечной артерии с анастомозом по типу конец в конец. Артериальное давление нормализовалось и восстанавливалась трудоспособность; однако спустя 2 года после операции гипертония вновь рецидивировала. В последующем этой больной пришлось произвести новую операцию — обходного сосудистого анастомоза между дистальным концом пересеченной почечной артерии и аорты при помощи дакронового протеза, с хорошим результатом.
Пять раз мы произвели операцию аорто-ренального обходного шунтирования с помощью дакронового протеза диаметром 8 мм, вшитого между аортой и почечной артерией. Для наложения указанных анастомозов полностью выключался кровоток по дистальной части брюшной аорты в течение 28—36 минут.
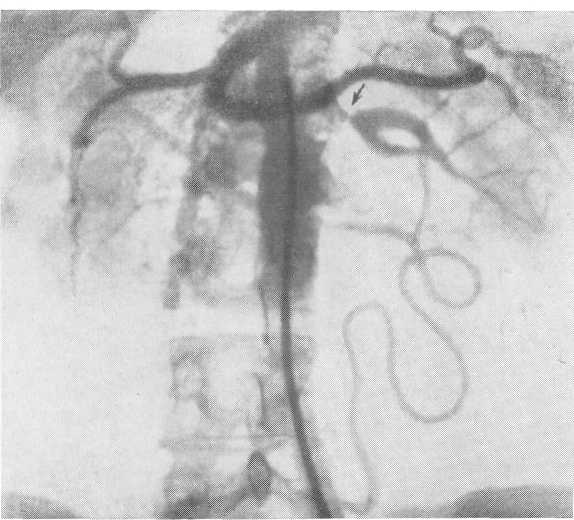
Рис. 239. Стеноз почечной артерии левой единственной почки. Постстенотическая дилятация. Почечная ангиограмма по Сельдингеру (ср. с рис. 240).
Резекция почки была произведена у 5 больных в связи с наличием стеноза и окклюзии добавочной артерии или одной из основных ветвей почечной артерир1. У девочки 15 лет произведена геминефр-зктомия подковообразной почки, половина которой была поражена пиелонефритом, приведшим к артериальной гипертонии; отдаленные результаты хорошие.
Рис. 240. Схема операции артериально-спленоренального анастомоза по поводу
