
- •Раздел 1. Строение вещества: атом, молекула, кристалл.
- •1.2. Молекула
- •1.2.1 Метод молекулярных орбиталей
- •1.2.2. Метод валентных связей
- •1.3. Кристалл
- •Раздел 2. Окислительно-восстановительные реакции
- •Раздел 3. Химия элементов
- •3.1. Химические превращения веществ
- •3.2. Стехиометрические расчеты.
- •3.2.1. Расчеты по уравнениям реакций.
- •Задача 426.
- •Задача 427.
- •Задача 446.
- •3.2.2. Расчеты по закону эквивалентов
- •Примеры решения задач
- •Раздел 1. Строение вещества: атом, молекула, кристалл.
- •Раздел 2. Окислительно-восстановительные реакции.
- •Раздел 3. Химия элементов.
- •3.1. Химические превращения веществ.
- •3.2. Стехиометрические расчеты.
- •3.2.1. Расчеты по уравнениям реакций.
- •1 Моль 1 моль 1 моль
- •58,5 Г 98 г 36,5 г
- •3.2.2. Расчеты по закону эквивалентов.
- •Рекомендуемая литература
3.2.2. Расчеты по закону эквивалентов.
Пример 1.
Определите молярную массу эквивалента трехвалентного металла, если при взаимодействии с соляной кислотой 1,47г этого металла вытеснили 2 л водорода, собранного над водой и измеренного при давлении р = 101,3 кПа и температуре T=291 К. Давление насыщенного пара воды при указанной температуре равно 2070,0 Па. Назовите металл.
Решение
Молярную массу эквивалента металла Мэкв можно выразить из уравнения, выражающего закон эквивалентов:
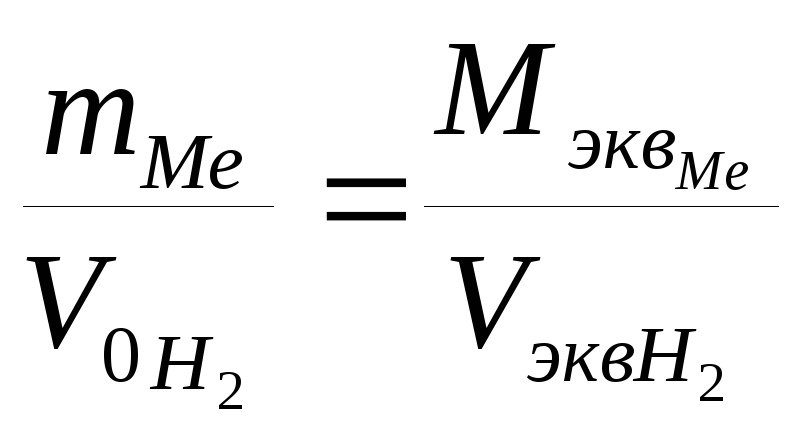
![]() ,
,
отсюда:
 ,
,
где
![]() -молярный
объем химического эквивалента водорода,
который равен частному от деления
молярного объема водорода при нормальных
условиях (VM)
на число эквивалентности Н2
(zэкв),
т.е.
-молярный
объем химического эквивалента водорода,
который равен частному от деления
молярного объема водорода при нормальных
условиях (VM)
на число эквивалентности Н2
(zэкв),
т.е.
![]() .
.
VM
при нормальных условиях в соответствии
с законом Авогадро равен 22,4 л/моль, число
эквивалентности zэкв,
показывающее сколько химических
эквивалентов содержится в одной
формульной единице вещества −
![]() .
Следовательно:
.
Следовательно:
![]() .
.
![]() -
объем собранного над водой водорода,
приведенного к нормальным условиям,
находим из уравнения объединенного
газового закона
-
объем собранного над водой водорода,
приведенного к нормальным условиям,
находим из уравнения объединенного
газового закона
![]() ,
,
где:
![]() -парциальное
давление водорода, собранного над водой,
равное разности общего давления (101,3
кПа) и парциального давления воды при
температуре 291 К
-парциальное
давление водорода, собранного над водой,
равное разности общего давления (101,3
кПа) и парциального давления воды при
температуре 291 К
![]()
Следовательно,
![]() .
.
Подставляем найденные величины в формулу для определения молярной массы металла и получаем:
![]()
Молярная масса металла ММе= zэкв∙МэквМе . Согласно условию zэкв = 3 (металл трехвалентный). Находим молярную массу эквивалента металла
ММе = 3∙8,99 = 26,98г/моль. В таблице Д.И. Менделеева находим искомый металл – это Al. Уравнение взаимодействия алюминия с соляной кислотой имеет следующий вид: 2Al + 6HCl = 2AlСl3 + 3H2.
Ответ: молярная масса эквивалента металла 8,99г/моль экв.
Искомый металл алюминий.
Рекомендуемая литература
Методические указания к выполнению домашнего задания по курсу общей химии. / Ф.З. Бадаев, А.М. Голубев, В.М. Горшкова и др. ; Под ред. В.И. Ермолаевой. - М.: Изд. МГТУ, 2003.
Ю.М. Коренев, А.Н. Григорьев, Н.Н. Желиговская, К.М. Дунаева. Задачи и вопросы по общей и неорганической химии с ответами и решениями. – М.: Мир, 2004.
Р.А. Лидин, В.А. Молочко, Л.Л. Андреева. Задачи по общей и неорганической химии.- М.: Владос, 2004.
Р.А. Лидин, Л.А. Андреева, В.А. Молочко. Справочник по неорганической химии.- М.: Химия, 1987.
А.А. Гуров, Ф.З. Бадаев, Л.П. Овчаренко, В.Н. Шаповал. Химия. Учебник для вузов. - М.: Изд. МГТУ, 2004.
