
- •Короткая форма Периодической системы элементов
- •Бериллий
- •Магний
- •13 В настоящее время установлено, что на других планетах солнечной системы существуют совершенно отличные от земных условия и потому формируются среды с иными химическими доминантами.
- •Теперь же к этим «старым объектам» добавились сотни новых планет у других звезд, большое разнообразие туманностей и других астрономических объектов.
- •Со всей очевидностью ясно, что химические миры столь же разнообразны, сколь разнообразны миры физические. Как выразил это М.В.Ломоносов – «Открылась бездна, звезд полна, звездам числа нет, бездне – дна!»
- •Важную роль играет литий в радиоуглеродном датировании.
Лебедев Ю.А. Лекция 4 |
16 |
В технике s-металлы IIА группы в чистом виде и, особенно, их соединения применяются достаточно широко.
Бериллий
В виде простого вещества бериллий впервые получил немецкий химик Фридрих Вёлер в 1828 году, восстанавливая хлорид бериллия калием. По внешнему виду бериллий – серебристо-серый твердый и хрупкий металл.
Мировое производство бериллия составляет несколько сот тонн в год. Бериллий потребляется атомной промышленностью как отражатель и замедлитель нейтронов и как конструкционный материал. Бериллий – легирующая добавка в медных, никелевых, железных и других сплавах.
Сплавы меди с 1–3% бериллия называются бериллиевыми бронзами.21
Магний
Открыт Г.Дэви в 1808 г. В 1828 французский химик А. Бюсси восстановлением расплавленного хлорида магния парами калия получил магний в виде небольших шариков с металлическим блеском.

Лебедев Ю.А. Лекция 4 |
17 |
Промышленное производство магния электролитическим способом было начато в Германии в конце 19 века.
Сегодня мировое производство магния составляет более 450 тыс. тонн и растет примерно на 8-10 % в год.
Магний является основой большого количества легких сплавов с алюминием, цинком, марганцем, цирконием, применяемых в автомобилесамолето- и ракетостроении.22
Щёлочно-земельные металлы
Щёлочно-земельные металлы имеют относительно небольшое по объему, но очень важное техническое применение. Кальций,23 стронций и барий24 используется как восстановители при получении некоторых металлов, в частности, урана и циркония. Металлический кальций является раскислителем при производстве специальных сталей.25 Стронций и барий26 применяются как геттеры (газопоглотители, вещества с высокой поглощающей способностью по отношению к кислороду, водороду, азоту, углекислому газу, окиси углерода и др. газам) в электровакуумной технике.
Мировое производство металлического кальция – десятки тысяч тонн в год (около 15% - экспорт из России), металлического стронция – 120 тыс. тонн в год,27 металлического бария (оценка, точных данных нет) – сотни тонн в год.
Огромное применение находят соединения кальция в качестве строительных материалов и связующих, кальций играет существенную роль в физиологических процессах и входит в состав костной и других тканей организма.28
Соединения бария используются в рентгенотехнике,29 пиротехнике30 и электротехнике.31
Подробнее со свойствами s-металлов можно познакомиться по учебнику [4] гл. 19.
Химические свойства соединений s – элементов с водородом, кислородом, азотом, серой, галогенами
Основные химические свойства щелочных металлов

Лебедев Ю.А. Лекция 4 |
18 |
В ряду Li – Сs химическая активность возрастает. ПОЧЕМУ? Взаимодействие с водой – образуется раствор щелочи и выделяется
водород:
2Ме + Н2О = 2Ме(ОН) + Н2 −
Взаимодействие с кислородом – при горении на воздухе образуются основные оксиды (Li), пероксиды (Na) и надпероксиды (K, Rb, Cs):
4Li + О2 = 2Li2О – оксид
2Na + О2 =Na2О2 – пероксид 32
К(Rb,Cs) + О2 = К(Rb,Cs)О2 – надпероксид ПОЧЕМУ ВОЗМОЖНО СУЩЕСТВОВАНИЕ АНИОНА O2− ?
Продуктами взаимодействия кислородных соединений с водой являются хорошо растворимые основания, называемые щелочами (типичнейшие – NaOH - едкий натр - и КОН - едкое кали).
В результате реакций нейтрализации щелочей элементов Iа-группы образуются нейтральные или кислые соли.
СОЛЕЙ?
Взаимодействие с водородом – образуются гидриды:
2Li + Н2 = 2LiH (наиболее легко – для лития)
Взаимодействие с галогенами – образуются галогениды (соли):
2Na + Cl2 = 2 NaCl
Щелочные металлы и их соединения можно обнаружить по характерной окраске пламени: литий окрашивает пламя в карминово-красный цвет; натрий – в желтый; калий – в фиолетовый; рубидий и цезий – в розовофиолетовый.

Лебедев Ю.А. Лекция 4 |
19 |
Основные химические свойства металлов 2 группы
В ряду Be – Ba химическая активность возрастает. ПОЧЕМУ? Взаимодействие с водой – образуется раствор гидроксида со
щелочной реакцией и выделяется водород:
Ме + 2Н2О = Ме(ОН)2 + Н2 −
Реакция бериллия и магния идет при нагревании, а щелочноземельные металлы реагируют и при комнатной температуре.
Взаимодействие с кислородом – образуются основные оксиды и пероксиды:
2Be + О2 = 2BeО – оксид (горение бериллия на воздухе) Ba + О2 =BaО2 – пероксид (горение в кислороде)
Образование пероксидов возможно только для щелочно-земельных металлов.
Продуктами взаимодействия кислородных соединений щелочноземельных металлов с водой являются растворимые основания.
В результате реакций нейтрализации этих оснований образуются нейтральные или основные соли.
Взаимодействие с водородом: Бериллий с водородом не взаимодействует,27 магний реагирует лишь при повышенном давлении, щелочно-земельные металлы при нагревании образуют ионные гидриды:
Sr + H2 = SrH2.
Взаимодействие с галогенами – образуются галогениды (соли):
Все s-металлы IIa-группы при нагревании реагируют с галогенами:
Bа + Cl2 = BаCl2,
Щелочно-земельные металлы и их соединения можно обнаружить по характерной окраске пламени: кальций окрашивает пламя в кирпичнокрасный цвет; стронций – в карминово-красный; барий – в желто-зеленый (яблочный).

Лебедев Ю.А. Лекция 4 |
20 |
Дополнительные материалы
1 Д.И.Менделеев
 См. о нем http://ru.wikipedia.org/wiki/%D0%9C %D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2%2C_ %D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_ %D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87
См. о нем http://ru.wikipedia.org/wiki/%D0%9C %D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2%2C_ %D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_ %D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87
2 Вот как представляли себе в средневековье связь космогонии и алхимии, а также внутреннее строение металлов, как соединений ртути и серы:
Семь металлов создал свет – по числу семи планет! Дал нам космос на добро медь, железо, серебро, Злато, олово, свинец, сера - им родной отец, И спешите все узнать: всем им ртуть – родная мать!
3Именно здесь уместно обсудить вопрос о металлической форме водорода. Дело в том, что водород, находясь в I Периоде и имея один электрон на s-орбитали, «заполняет» целый период. И, следовательно, должен обладать всем спектром свойств, которые в следующих периодах распределяются между 8, 18 и 32 элементами. Всякий Период открывается щелочным металлом. И ученые ищут условия, при которых водород становится металлическим.
Вот одна из трактовок этой проблемы, представленная на сайте (http://ntpo.com/physics/studies/7.shtml ).
Еще в 1935 году появилась классическая работа Е. Вигнера и Х. Хантингтона, в которой они впервые предположили, что водород при высоких давлениях из газа-диэлектрика превратится в проводящий металл. По их расчетам твердый металлический водород должен был иметь объемно-центрированную атомарную решетку (при 0 К и нулевом давлении), а его плотность при тех же условиях должна быть существенно выше плотности твердого молекулярного водорода (0,59 г/см3 вместо 0,089 г/см3).

Лебедев Ю.А. Лекция 4 |
21 |
Эта проблема интересна, в частности, астрофизикам. Тяжелые планеты (Юпитер, Сатурн) более чем на 90% состоят из водорода. Кроме того, ученые предполагают, что, поскольку на Юпитере довольно низкая температура (100-200К) и сильное магнитное поле, то, если водород там находится в металлической фазе и проявляет свои сверхпроводящие свойства, это должно привести к множеству интересных явлений. В последние годы открыты так называемые экзопланеты у других звезд. И многие из них, в соответствии с современными представлениями об их структуре, содержат слои металлического водорода. Вот как выглядят внутренние структуры открытой в 2005 году в созвездии Геркулеса планеты HD 149026b (http://yastro.narod.ru/a_news115.htm ), находящейся на расстоянии 260 световых лет от Земли, и нашего Юпитера:
Планета HD 149026 b в сравнении с Юпитером. Светло-серым цветом обозначена водородногелиевая атмосфера, серым — жидкий металлический водород, а темно-серым — ядро,
состоящее из тяжелых элементов (изображение с сайта www.physorg.com )
Но самое интересное то, что проблема сверхпроводящего металлического водорода, возможно, вовсе не теоретическая, а вполне прикладная.
В 1971 году появились работы наших теоретиков (группа Ю. Кагана), которые доказывали, что металлический водород может оказаться метастабильным. Это значит, что после снятия высокого давления водород не превратится снова в газ-диэлектрик, а останется металлом. Вопрос в том, будет ли время существования такой метастабильной фазы достаточным, чтобы измерить ее свойства и успеть ее применить.
Для получения сверхвысоких давлений используют обычно или алмазные наковальни (статическое сжатие), или взрывные методы (динамическое сжатие).
Алмазная наковальня приспособление довольно простое и небольшое (правда, стоит она 10 000 долл). Два алмаза ограняют специальным образом (а вот это очень непросто) и между их центральными плоскими поверхностями внутри полости располагают образец. В полости обязательно есть металлическая прокладка. После того как камни сдавливают, на образец действует давление, обратно пропорциональное площади нижней плоской части алмаза, диаметр которой 20600 мкм.
Работать с водородом очень трудно. Он не только физически проникает в металл прокладки и делает его хрупким, но и вступает с ним в химические реакции, образуя гидриды. Сжатый до определенного давления,
водород переходит в молекулярное кристаллическое состояние, превращаясь в довольно необычную субстанцию.
Первые сведения об открытии электропроводной аллотропной модификации водорода были получены более 30 лет назад в работе советских ученых Л.Ф.Верещагина, Е.Н.Яковлева и Ю.А.Тимофеева «Возможность перехода водорода в металлическое состояние» http://www.jetpletters.ac.ru/ps/542/article_8546.pdf . Раз проводник, значит – металл? Оказалось, что нет! Проблема металличности водорода является гораздо более сложной, чем представлялось вначале.
За последние четверть века после изобретения алмазных наковален исследователи системно изучили свойства твердого водорода вплоть до давления 2 млн. атм.(последний рекорд 3.75 млн. атм.) Теперь ученые знают, что даже при этих давлениях существуют, по крайней мере,

Лебедев Ю.А. Лекция 4 |
22 |
три фазы твердого водорода, причём каждая из них совершает переход диэлектрик - проводник при своём значении давления. Одна при 1.6 млн. атм., когда другие фазы ещё остаются диэлектриками. Последние теоретические данные позволяют надеяться, что весь водород перейдёт в проводящую фазу при 4 млн. атм. ( при нуле Кельвинов).
Измеряя сопротивление в динамических экспериментах, исследователи видели, что водород становится проводником с проводимостью почти как у жидких металлов. Но эта проводимость все-таки слабо зависит от температуры, что свидетельствует, что водород еще не металл. Ученые характеризуют состояние водорода, которое они наблюдают, как состояние «неупорядоченной проводящей среды» (неупорядоченной, так как температуры слишком высоки). Другими словами, это состояние является «плотной низкотемпературной неидеальной плазмой», а появляющийся эффект проводимости обусловлен «ионизацией давлением».
Даже при 15 млн. атмосфер в ударных динамических экспериментах при температурах несколько тысяч Кельвинов пока однозначных доказательств существования именно металлического водорода нет.
Более того, есть данные о том, что водород, подобно гелию (изотоп 3He) способен существовать в виде квантовой жидкости при давлениях до 4 млн. атмосфер.
Новое исследование специалистов американской Национальной лаборатории Лоуренса Ливермора показали, что диаграмма перехода между фазами "твердое тело" - "жидкость" у водорода выглядит необычно. С помощью компьютерного моделирования был проверен ход кривой температуры плавления кристаллического водорода в диапазоне давлений от 500 тыс. до 2 млн. атмосфер.
Выяснилось, что вначале эта кривая идет вверх, в районе 800 тыс. атмосфер имеет максимум, а после - падает. Это очень необычное поведение линии раздела фаз для тела с очень плотной "упаковкой" молекул. Дальнейшие расчеты показали, что при давлении порядка 4 млн. атмосфер водород не переходит в твердую фазу при низкой температуре, а остается в виде необычной квантовой жидкости - сверхжидкости (superfluid), как ее назвали в Ливерморе. http:// chemworld.narod.ru/chemworld/8.html
4 То, что выбранный для бинарной классификации «металл – неметалл» набор свойств не является ни исчерпывающим, ни однозначным, выявляется при изучении таких элементов как углерод, фосфор, мышьяк и теллур, называемых пограничными. По одним свойствам и при одних условиях они ведут себя как неметаллы, а по другим (в частности, по наличию металлической проводимости) могут быть отнесены и к металлам.
Здесь картина металличности более проста, чем в случае водорода, поскольку термодинамические параметры существования электропроводных фаз позволяют изучать их в лабораторных условиях.
Если принять за критерии металличности наличие электронной проводимости и кристаллической структуры твердой фазы, то придется признать, что все «пограничные элементы» (углерод, фосфор, мышьяк и теллур) способны образовывать фазы, которые должны быть причислены к металлам. Вместе с тем, они же образуют и диэлектрические фазы.
С философской и научно-методологической точки зрения это демонстрирует особые свойства всякого «пограничья» – именно наличие границы применимости понятия делает его определенным и практически важным.
5 Это можно видеть на примере образования кристалла лития:

Лебедев Ю.А. Лекция 4 |
23 |
Как видно из рисунка, при сближении атомов лития до расстояния r0, соответствующего расстоянию между атомами в кристалле, внешние 2s-обитали перекрываются и образуют энергетическую зону шириной в несколько электрон-вольт, которую занимают все 2sэлектроны атомов лития, составляющих кристалл. Поскольку эти электроны у лития являются валентными, образованная ими зона носит название валентной зоны.
Расщепление этой зоны на отдельные подуровни (чего требует принцип Паули) приводит к различию энергий этих подуровней только на величину Е ≈ E2S / N где E2S – это энергия
2s-орбитали, а N- число атомов в кристалле. Как мы уже говорили, это совершенно ничтожная величина порядка 10-40 Дж., что позволяет электронам под действием внешних сил легко перемещаться по всему объему кристалла.
Такими внешними силами на практике, прежде всего, являются силы внешних электромагнитных полей различной природы. Если электромагнитное поле приложено в виде разности потенциалов, то электроны приобретают направленное движение, которое фиксируется нами как электрический ток. И в данном случае валентная зона становится зоной проводимости.
Если внешняя энергия подводится в форме тепла, то она, в силу большой подвижности электронов и малой у атомов в узлах решетки, быстро передается по кристаллу против
градиента температуры.
6Этот вид электронной эмиссии называется также туннельной эмиссией, поскольку она связана с проявлением квантового эффекта туннелирования. (Туннелирование – прохождение частицы сквозь энергетический барьер с энергией, недостаточной для его преодоления).
Эмиссионные свойства металлов зависят от величины работы выхода ϕ э – энергии,
необходимой для «извлечения» электрона из металла при данном типе воздействия. Работа выхода всегда меньше энергии ионизации. Это видно из следующей таблицы:

Лебедев Ю.А. Лекция 4 |
24 |
На явлении электронной эмиссии основана работа многих радиотехнических и электронных устройств (радиолампы, фотоэлементы, иглы сканирующих туннельных микроскопов и т.п.). Это же свойство порождает и явление контактной разности потенциалов. Оно используется для измерения температуры с помощью термопар – спаянных металлов с разной работой выхода. Измерение основано на том, что зависимость термо-ЭДС, возникающей в месте спая, должно практически линейно зависеть от температуры. В качестве рабочих материалов термопар, отвечающих этому требованию, используют спаи платины с платино-родиевым сплавом, хромеля (сплав никеля с хромом) с алюмелем (сплав никеля с алюминием, марганцем и кремнием) и ряд других.
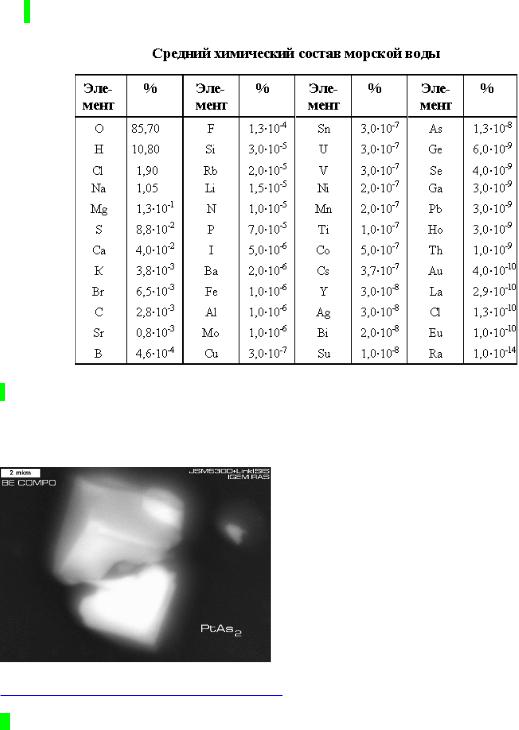
7 Более детальное представление о составе литосферы дает анализ кларков всех элементов. Термин "кларк" был введен в науку А.Е. Ферсманом в 1923 г. в честь американского геохимика Ф.У. Кларка, впервые определившего содержание в земной коре наиболее распространенных элементов. Интересна связь кларков и последовательности открытия химических элементов (она изложена здесь http://n-t.ru/ri/ps/pb3.htm )
В приведенной ниже таблице кларки даны по Дж.Грину в г/тонну вещества литосферы. В скобках – данные других авторов. (КХЭ, т.2, ст. 594)
Лебедев Ю.А. Лекция 4 |
25 |
8
9 Химический состав минерала сперрилит – арсенид платины PtAs2. Этот минерал был недавно обнаружен на месторождении Сухой Лог. Фотография кристалла сперрилита из образцов этого месторождения, полученная с помощью сканирующего электронного микроскопа представлена здесь:
http://www.igem.ru/igem/chem/pt/sukhlogr.htm
10 В вулканических газах, термальных водах и рудных образованиях вулканов Менделеева и Головина острова Кунашир и вулкана Толбачек на Камчатке установлены повышенные концентрации платиноидов (до 7,3 г/т) и золота (до 0,6 г/т). Они присущи, как правило, гидроксидно-марганцево-железистым илам донных осадков вулканогенно-термальных вод, в железо-марганцевых жидких рудах содержится сотни мкг/л платиновых металлов и золота. Для сернистых илов фумарольных озер характерны наибольшие содержания Os (до 0,47 г/т), Rh (0,16г/т), Ir(0,39 г/т). Наиболее высокие количества металлов платиновой группы (до 0,8 г/т Pd, 63 г/т Pt, 0,2 г/т Os, 0,13 г/т Ir) установлены в сульфидоносных осадках озера Кипящего кольдеры вулкана Головина.
http://www.scgis.ru/russian/cp1251/dgggms/3-98/chernyshev.htm
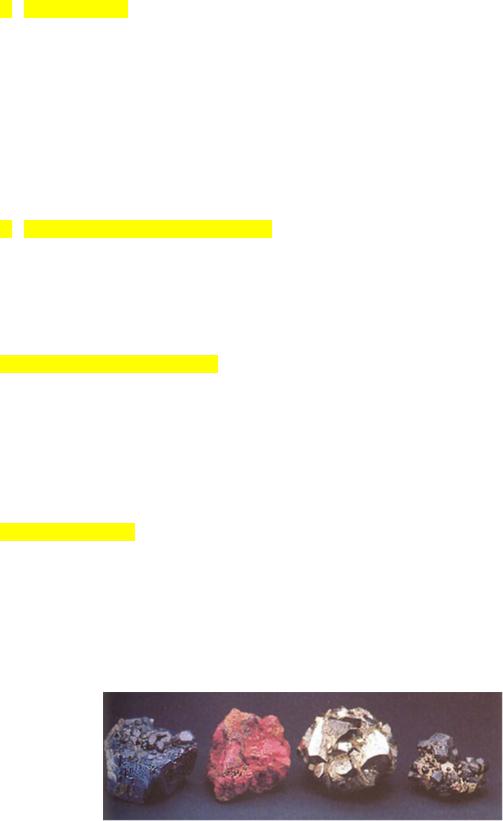
Лебедев Ю.А. Лекция 4 |
26 |
|
|
Виды руд. |
|
11 |
|
|
1. Оксидные руды.
Рассмотрение состава литосферы (49,4% кислорода) с очевидностью показывает, что большая часть металлов (за исключением золота, платиноидов и, частично, серебра) должна находиться в виде оксидных соединений, которые и являются их рудами. Это и наблюдается для алюминия, железа, хрома, марганца, олова, вольфрама и ряда других металлов.
Оксидные руды могут содержать как один металл, так и несколько. Примеры монометаллических руд: Fe2O3 – гематит, Al2O3 – боксит, TiO2 – рутил, MnO2 – пиролюзит, SnO2
– касситерит.
Примеры полиметаллических оксидных руд: FeO*Cr2O3 – хромистый железняк, MgO*Al2O3 – магнезиальная шпинель.
Образующие полиметаллические руды оксиды металлов состоят из кислотных и основных (или амфотерных) оксидов и могут рассматриваться как соответствующие соли. Например, хромистый железняк можно считать хромитом железа (II) Fe(CrO2)2.
2. Силикатные и алюмосиликатные руды.
Большое количество кремния (25,8%), алюминия (7,5%), натрия (2,6%) и калия (2,4%) в земной коре приводит к образованию большого числа силикатных и алюмосиликатных минералов – полевых шпатов. Например, K2O*Al2O3*6SiO2 – ортоклаз, Na2O*Al2O3*6SiO2 – альбит. Полевые шпаты – наиболее распространенные породообразующие минералы, они составляют около 50 % от массы литосферы. Вследствие их большой устойчивости рудами являются только те из них, металлы которых не образуют других, более технологически удобных минералов. Например – берилл 3BeO*Al2O3*6SiO2.
3. Сульфатные и фосфатные руды.
Относительно большие кларки фосфора (1180 г/тн) и серы (750 г/тн) объясняют наличие значительного количества сульфатных и фосфатных минералов. Большинство из них не являются рудами, поскольку при их переработке очень трудно получить металлы без примесей этих вредных элементов. Сера и фосфор ухудшают и механические, и электрофизические свойства металлов. Однако по тем же причинам, что и для алюмосиликатных минералов, в некоторых случаях и фосфатные минералы становятся рудами. Так, наиболее практически важной рудой редкоземельных f-металлов является монацит – смешанный фосфат (Ce,La, Nd)PO4. Монацит содержит (в пересчете на оксиды) более 50% редкоземельных элементов, 5 – 10 % ThO2, иногда до 1% U3O8 и апатит.
4. Сульфидные руды.
Большое количество серы в окружающей среде, ее окислительная активность, способность входить в состав таких живых организмов, как сульфатредуцирующие и тионовые бактерии, приводит к образованию ее собственных минералов. Это и чистая сера, являющаяся продуктом жизнедеятельности сульфатредуцирующих бактерий, и многочисленные сульфиды, некоторые из которых также имеют биогенное происхождение. Главными сульфидными рудами являются: пирит (железный колчедан) FeS2, сфалерит (цинковая обманка) ZnS, галенит (свинцовый блеск) PbS, молибденит MoS2, халькопирит (медный колчедан) CuFeS2, халькозин Cu2S и др.
Вот как выглядят некоторые из них:
Сульфиды свинца (галенит или свинцовый блеск), ртути (киноварь), железа (пирит или железный колчедан), цинка (бленда). http://www.college.ru/chemistry/course/content/chapter8/section/paragraph3/theory.html
