
- •Короткая форма Периодической системы элементов
- •Бериллий
- •Магний
- •13 В настоящее время установлено, что на других планетах солнечной системы существуют совершенно отличные от земных условия и потому формируются среды с иными химическими доминантами.
- •Теперь же к этим «старым объектам» добавились сотни новых планет у других звезд, большое разнообразие туманностей и других астрономических объектов.
- •Со всей очевидностью ясно, что химические миры столь же разнообразны, сколь разнообразны миры физические. Как выразил это М.В.Ломоносов – «Открылась бездна, звезд полна, звездам числа нет, бездне – дна!»
- •Важную роль играет литий в радиоуглеродном датировании.

Лебедев Ю.А. Лекция 4 |
1 |
Лекция №4
Периодический закон Д.И. Менделеева и периодическая система элементов. Периодические свойства элементов и их соединений. s -, p -, d -, f – элементы. Расположение металлов в периодической системе элементов. Особенности электронного строения атомов металлов. Общие физические и химические свойства металлов, нахождение в природе. Методы получения.
Физико - химические свойства s – элементов, взаимодействие с простыми и сложными веществами. Щелочные и щелочноземельные металлы. Химические свойства соединений s
– элементов с водородом, кислородом, азотом, серой, галогенами
Периодический закон Д.И. Менделеева и периодическая система элементов.
В 1869 году Д.И.Менделеев1, предвосхитив открытия в области квантовой механики, на основании изучения химических свойств только 63 известных в то время химических элементов, установил Периодический закон, связывающий все их химические свойства в стройную систему и создал Периодическую таблицу химических элементов.
Более того, на основании этого закона Менделеев весьма точно предсказал свойства ещё не открытых элементов – галлия, скандия, германия.
В современной формулировке этот закон гласит:
Свойства химических элементов, а также форма и свойства образуемых ими соединений, находятся в периодической зависимости от порядкового номера элемента.
Как оказалось впоследствии, Периодический закон основан на периодичности структур внешних электронных оболочек и может быть математически сформулирован через понятия квантовых чисел. Подробности – в учебнике [2] на стр. 79 – 85.
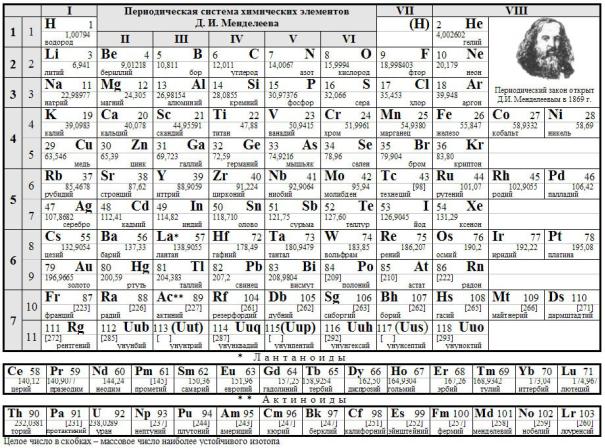
Известно несколько сот вариантов графического отображения Периодического закона. Приведем самые распространенные.
Короткая форма, наиболее близкая к оригинальной Таблице Менделеева, полудлинная форма, рекомендованная ИЮПАК, и длинная форма:
Лебедев Ю.А. Лекция 4 |
2 |
Короткая форма Периодической системы элементов
Полудлинная форма Периодической система элементов
(Активная форма – на сайте http://www.chemistry.narod.ru/tablici/Tablica.htm)
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
3 |
4 |
|
|
|
|
|
|
|
|
|
|
5 |
6 |
7 |
8 |
9 |
10 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
Ar |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
31 |
32 |
33 |
34 |
35 |
36 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
||||||||
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Ti |
Pb |
Bi |
Po |
At |
Rn |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
|
|
|
|
|
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Лебедев Ю.А. Лекция 4 |
3 |
58 59 60 61 62 63 64 65 66 67 68 69 70 71
Ce |
Pr |
Nd Pm Sm Eu Gd Tb Dy Ho |
Er Tm Yb |
Lu |
|||||||||
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
Th |
Pa |
U |
Np Pu Am Cm Bk |
Cf |
Es Fm |
Md No |
Lr |
||||||
Длинная форма Периодической системы элементов:
Во всех вариантах Периодической системы она состоит из 7 периодов, причем номер периода соответствует главному квантовому числу внешнего энергетического уровня. Во всех вариантах выделены отдельные столбцы s-, p-, d-, f- элементов, т.е. элементов, у которых идет заполнение соответствующего энергетического подуровня. Эти блоки элементов имеют и сходные химические свойства. Во всех вариантах (а в
Лебедев Ю.А. Лекция 4 |
4 |
полудлинном и длинном особенно явно) действует «диагональное правило» - все элементы ниже условной диагонали являются металлами, а выше – неметаллами, причем справа налево и сверху вниз усиливаются металлические свойства.
Более подробно со структурой Периодической системы следует познакомиться по учебникам [1] и [2], а также по дополнительной литературе – монографии под редакцией К.Сайто «Химия и периодическая таблица».
Периодические свойства элементов и их соединений.
При внимательном рассмотрении электронных формул химических элементов (это вы сделаете самостоятельно, используя материал этой лекции при самоподготовке и на специальном семинаре) можно увидеть, что структуры внешних электронных оболочек атомов периодически повторяются: при увеличении главного квантового числа n возникают одинаковые конфигурации энергетических подуровней с одинаковым числом электронов на них.
Это находит отражение в периодичности большинства свойств атомов различных элементов и свойств состоящих из них простых веществ. Эта периодичность может быть выражена более или менее ярко, в зависимости от того, насколько данное свойство зависит от электронной структуры, но прослеживается практически всегда.
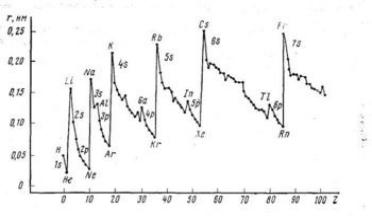
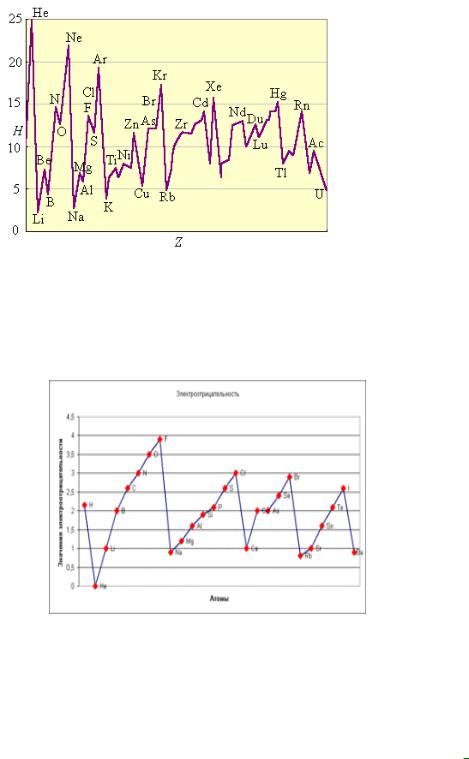
Покажем это на примерах зависимости атомного радиуса, потенциала ионизации, и электроотрицательности от порядкового номера элемента:
Атомный радиус:
Лебедев Ю.А. Лекция 4 |
5 |
Потенциал ионизации:
Электроотрицательность:
Непериодических свойств известно совсем немного. Это радиоактивные свойства (они зависят от свойств атомных ядер), частоты характеристических рентгеновских спектров (они зависят от заряда ядра), ядерные свойства изотопов.
s -, p -, d -, f – элементы. Расположение металлов в периодической системе элементов. Особенности электронного
строения атомов металлов.
Мы приступаем к обзору свойств химических элементов и их соединений. В соответствии с современными представлениями о структуре атомов все элементы подразделяются на 4 группы, исходя из того, какие их орбитали в основном состоянии имеют наибольшую энергию. Таким образом выделяются s -, p -, d -, f- элементы.

Лебедев Ю.А. Лекция 4 |
6 |
Металлы и неметаллы.
Исторически первым разделением химических элементов по их свойствам было деление на металлы и неметаллы. Такое разделение опирается на свойства простых веществ. С глубокой древности были известны 7 особых веществ – медь, золото, серебро, железо, олово, свинец
иртуть.2 Все они обладали такими общими свойствами, как специфический «металлический блеск», пластичность, ковкость, хорошая теплопроводность. За исключением ртути они также проявляли значительную твердость.
По этим признакам они и были при классификации выделены в особую группу – металлы. Остальные элементы в виде простых веществ, как правило, газы или хрупкие твердые вещества, плохо проводящие тепло
ине обладающие электропроводностью. Они были отнесены к неметаллам. Позже, с химической точки зрения, было установлено, что свободные
металлы существуют в виде кристаллических тел, являются хорошими восстановителями и образуют основные оксиды.
Сегодня к этому можно добавить, что общими химическими свойствами металлов являются:
1.Малая электроотрицательность как следствие низких потенциалов ионизации и малого (а чаще отрицательного) сродства к электрону.
2. Способность |
образовывать |
только |
положительные |
||
элементарные |
ионы, |
отдавая |
электроны |
(хорошие |
|
восстановительные свойства). |
|
|
|
||
3.Способность в сложных ионах или полярных молекулах являться положительными центрами при образовании химических связей.
Следствием пп. 2 и 3 является то, что металлы ни в каких своих соединениях не проявляют отрицательных степеней окисления.
Эти свойства и признаки получили свое объяснение после создания теории электронного строения атомов. В частности оказалось, что неметаллами могут быть только некоторые p- и два s-элемента (Н и He). Более того, вопрос о металличности водорода является одним из актуальных в современной химии. 3
В нашем курсе мы в основном будем рассматривать свойства металлов. Это связано с тем фактом, что металлы являются материальнотехнологической основой современной цивилизации.
То, что мы живем в «атомном веке», «космическом веке», «компьютерном мире» совершенно не исключает того, что «железный век» все ещё продолжается – металлическое железо остается основным конструкционным материалом и сегодня. Мировое промышленное производство железа в 2010 году достигло рекордного уровня 1 млрд. 414 млн. тонн! Из них почти половина была произведена в Китае и вдесятеро

Лебедев Ю.А. Лекция 4 |
7 |
меньше в России… Почти 1,5 миллиарда тонн - это очень много. Из этого количества железа можно было бы сковать обруч на экватор и получилась бы стальная магистраль длиной 40000 километров с шириной 30 метров и толщиной 15 сантиметров! Или соединить Землю с Луной железным прутом диаметром 77 мм!
Но, кроме железа, современные технологии используют ещё почти 90 металлов, входящих в Периодическую Таблицу Д.И.Менделеева. Металлические материалы обычно делятся на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы — цветными.
А если учесть тот факт, что потребности современных технологий порождают все новые и новые сплавы, то название «металлическая цивилизация» вряд ли покажется неправомерным для современной земной цивилизации!
Из рассмотрения положения металлов в Периодической Системе (металлами будут являться элементы, расположенные главным образом «влево и вниз» от диагонали, мысленно проведенной от водорода (H) к радону (Rn), очевидно, что металлы могут иметь все известные конфигурации заполнения электронов внешнего энергетического уровня. По этому признаку различают s-, p-, d- и f-металлы (соответственно красные, желтые, синие и зеленые клеточки полудлиной Таблицы Менделеева). Интересна граница металличности, проходящая по желтому полю p-элементов по линии углерод – фосфор - селен.4
Общие физические и химические свойства металлов, нахождение в природе.
Общие физические свойства металлов
Физические свойства металлов обусловлены тем, что составляющие их атомы связаны металлической связью. «Рыхлость» внешних электронных оболочек металлов при построении кристаллической решетки приводит к тому, что эти оболочки в достаточной степени перекрываются.
5
Отличительным признаком металличности является зависимость сопротивления от температуры. У металлов с повышением температуры сопротивление растет, у полупроводников (неметаллов) – падает.
Важной характеристикой металлов является их эмиссионная способность, т.е. способность испускать электроны под воздействием внешнего источника энергии. В зависимости от типа этой энергии различают различные типы эмиссии: термоэлектронную (под действием нагрева), фотоэлектронную (под действием электромагнитного излучения видимого и близких к нему участков спектра), экзоэлектронную (при механическом воздействии на металл в вакууме), вторичную электронную
Лебедев Ю.А. Лекция 4 |
8 |
(под воздействием первичного пучка электронов) и автоэлектронную (под действием внешнего электростатического поля напряженностью 106 – 107 В/см).6
И, наконец, из общих свойств металлов отметим, что все они имеют только три типа кристаллической решетки: а) гранецентрированная кубическая (ГЦК); б) объемноцентрированная кубическая (ОЦК); в) гексагональная плотноупакованная (ГПУ) решетка.
Другие общие свойства металлов, связанные с их механической прочностью и деформациями, вы будете изучать в курсах физики и материаловедения.
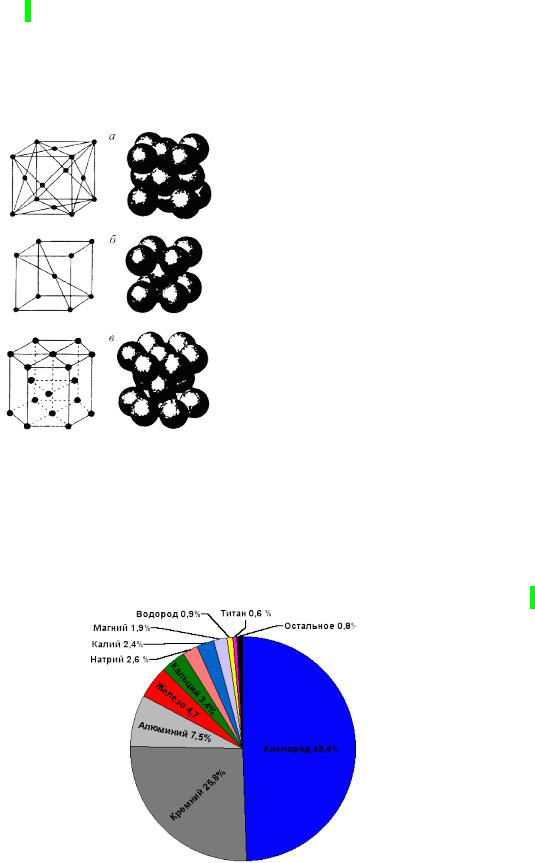
Распространенность металлов в природе.
Мы живем на внешней оболочке Земного шара – литосфере. Среднее содержание химического элемента в литосфере называется его кларком. Кларки основных компонентов литосферы представлены на рисунке:7
Как видим, основное количество вещества в ней приходится на два неметалла – кислород и кремний. Они составляют (в виде силикатов)

Лебедев Ю.А. Лекция 4 |
9 |
|
около 75% |
массы |
доступного нам вещества Земли. На металлы |
приходится всего около 25%.
Литосфера погружена в атмосферу, состав которой (в объемных процентах) выглядит так:
В ней, как мы видим, вообще нет металлов.
И, наконец, на поверхности литосферы огромную площадь занимает Мировой Океан, в состав которого входят растворенные соли практически всех элементов Таблицы Менделеева 8. Но металлы по массе составляют только около 1% вод Мирового Океана.
Относительная малость количества металлов в окружающей среде совершенно не отражает их роли в нашей жизни. Высокая реакционная способность, огромное число образуемых соединений, которые включены в биохимические системы, а также огромная технологическая важность металлов делают их предметом пристального внимания химии.
Руды
То, что металлы получают из руд, известно почти также хорошо, как и то, что Волга впадает в Каспийское море. А что такое руда? Что общего у минерала сперрилита9 из золотоносного месторождения Сухой Лог, термальных вод вулканов Менделеева и Головина острова Кунашир10 и сырой уральской платины? Оказывается, все они содержат платину. Но из всех перечисленных платиносодержащих материалов только сырая платина сегодня является платиновой рудой!
Руда – это такой вид полезных ископаемых, который содержит соединения полезных компонентов (минералов, металлов) в химических формах и концентрациях, делающих извлечение этих компонентов экономически целесообразным. 11
Из данного определения очевидно, что минеральный ресурс, который сегодня не разрабатывается или идет «в отвал» при разработке какой-то другой руды, может стать рудой завтра, когда изменятся экономические и технологические условия. Яркий пример тому – отвалы фабрики

Лебедев Ю.А. Лекция 4 |
10 |
обогащения никеля в Норильске, которые сегодня стали рудой для извлечения платины и палладия.
Методы получения.
С химической точки зрения, все методы получения металлов сводятся к их восстановлению из окисленного состояния:
Mez+ + ze- Þ Me
Процессы получения металлов из руд классифицируются по виду восстановителя и по условиям их проведения.
По первому критерию различают:
А) |
Вытеснение металла более активным металлом |
Б) |
Восстановление металлов неметаллами |
В) |
Восстановление металлов электролизом |
По второму критерию различают:
I)Гидрометаллургию (процессы в водных растворах)
II)Пирометаллургию (процессы при высоких температурах)
Для процессов вытеснения металлов из оксидов и солей более активными чистыми металлами при высоких температурах используется также термин металлотермия.
Примером проведения процесса А) гидрометаллургическим способом является cтандартный метод осаждения золота из растворов12 – цементация металлическим цинком:
Zn + 2Na[Au(CN)2] Þ 2Au + Zn(CN)2 +2NaCN
Примером промышленного применения металлотермии (высокотемпературный А)-процесс) является современный способ получения скандия восстановлением его оксида металлическим кальцием:
Sc2O3 + 3Ca Þ 2Sc + 3CaO
В Б)-процессах в качестве восстановителей используются углерод в виде кокса, газообразный водород, и, реже, кремний. Как правило, эти процессы являются пирометаллургическими. Восстановление углеродом – основной способ получения наиболее важных металлов и, прежде всего, железа (доменный процесс).
Примером промышленного использования водорода для получения металла является производство вольфрама:
WO3 + 3H2 Þ W +3H2O

Лебедев Ю.А. Лекция 4 |
11 |
Современные промышленные В)-процессы, как правило, протекают в расплавах солей и оксидов. Примером является промышленное получение магния. Уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2, имеет вид:
Mg2+ + 2Cl- Þ Mg + Cl2
Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока.
Некоторые другие примеры промышленного получения металлов мы рассмотрим при более подробном их описании.
Систематически вопросы химического поведения d-металлов в соответствии с программой нашего курса изложены в учебном пособии В.И.Ермолаевой, В.М.Горшковой, Л.Е.Слынько «Химия элементов» (Издво МГТУ им.Н.Э.Баумана, 2007 г).
Общие химические свойства металлов.
Химия как наука отражает поведение и свойства химических элементов в условиях их существования во влажной окислительной среде планеты Земля.13 Очевидно, что наличие большого количества жидкой и парообразной воды и свободного кислорода в атмосфере определяет качественную структуру реакционной способности веществ и их химическую классификацию. Осознание того факта, что в нашем курсе мы имеем дело прежде всего с «Земной химией», помогает понять логику описания химических свойств и превращений веществ.
В соответствии с указанными общими свойствами металлов рассмотрим их химическое поведение по отношению к воде, элементарным окислителям, кислотам и щелочам.
Взаимодействие металлов с водой
Непосредственно с водой реагируют самые активные металлы – щелочные и щелочноземельные с образованием водорода и соответствующего гидроксида (щелочи). Менее активные металлы взаимодействуют с водой при нагревании, образуя оксиды или плохо растворимые гидроксиды.
Взаимодействие с элементарными окислителями
К типичным элементарным окислителям относятся кислород, сера и галогены. Со всеми ними металлы образуют обширные классы химических

Лебедев Ю.А. Лекция 4 |
12 |
соединений – оксиды, сульфиды и галогениды. В зависимости от активности металла и проявляемой ими степени окисления процессы образования этих соединений могут идти с разной степенью интенсивности – от взрывного взаимодействия цезия с серой до медленного окисления на воздухе тонкоизмельченного осмия, образующего при этом пахучий и летучий тетроксид OsO4. И характер связей при этом может меняться от почти чисто ионного (NaCl) до ковалентно-полярного, например, CaO.
Оксиды, сульфиды и галогениды металлов в природе образуют их рудные залежи.
Взаимодействие металлов с кислотами
Все активные металлы при взаимодействии с кислотами выделяют водород:
Ме + nН+ = Ме+n + n/2 Н2 −
Кроме этой, самой типичной реакции, не только активные, но и большинство других металлов, могут взаимодействовать с кислотамиокислителями (азотная и концентрированные серная кислоты) по реакциям, в которых образуется не водород, а продукты восстановления анионов кислот-окислителей.
Взаимодействие металлов со щелочами
Со щелочами могут реагировать металлы, имеющие амфотерные оксиды, или металлы, могущие проявлять высокие степени окисления при взаимодействии с сильными окислителями. В первом случае реакции идут непосредственно со щелочами с образованием солей кислородсодержащих кислот металлов. Типичными металлами этой группы являются Al и Zn. Во втором – при взаимодействии с пероксидами щелочных металлов с образованием солей кислородсодержащих кислот металлов в высших степенях окисления. Это характерно для Cr, V, W, Mn и некоторых других металлов.
Физико - химические свойства s – элементов, взаимодействие с простыми и сложными веществами. Щелочные и щелочноземельные металлы.
В Периодической таблице 14 s-элементов. И только один из них – гелий – безусловно, не является металлом. О «физической металличности» водорода мы говорили ранее, а свойства этого элемента с химической точки зрения близки к свойствам металлов. Остальные 12 элементов –

Лебедев Ю.А. Лекция 4 |
13 |
типичные металлы. Они образуют две ярко выраженные группы с чёткими химическими особенностями – щелочные металлы (1 группа Периодической системы) и щелочно-земельные металлы (2 группа периодической системы).
Физические свойства s – металлов 1(IA) и 2(IIA) групп, Применение s – металлов в технике.
s-металлы 1 группы.
К s-металлам 1 группы (щелочные металлы) относятся Li, Na, K, Rb, Cs и Fr. Последний, в силу отсутствия у него стабильных изотопов и малого периода полураспада (21,8 мин) не имеет практического применения и в нашем курсе не рассматривается.
Структура внешнего электронного уровня – ns1.
Все указанные элементы являются металлами, с химической точки зрения проявляющими металлические свойства с особой яркостью.
Все они являются только восстановителями и проявляют степень окисления только +I.
По физическим свойствам в виде простых веществ они являются мягкими легкоплавкими металлами с малой плотностью.14
Применение в технике s-металлов 1 группы и их соединений.
В технике щелочные металлы в чистом виде и, особенно, их соединения применяются достаточно широко.
Литий
*
Этот, а также все последующие в курсе лекций рисунки, представляющие химические элементы Таблицы Менделеева и изображения монет из различных металлов, взяты с сайта The Wooden Periodic Table Table http://www.theodoregray.com/PeriodicTable/index.html

Лебедев Ю.А. Лекция 4 |
14 |
Мировое производство лития по грубой оценке составляет около тысячи тонн в год. Из них примерно 20% производится в России на ОАО НЗХК (Новосибирский завод химических концентратов).15
Натрий
Металлический натрий впервые получен в 1807 г. Г. Дэви электролизом расплава его гидроксида.
Металлический натрий – самый объемный и востребованный продукт из всех щелочных металлов. Мировое производство металлического натрия составляет несколько сот тысяч тонн в год.
Главная область применения металлического натрия – производство титана, циркония и других металлов восстановлением их хлоридов. Меньшие количества натрия используются для получения соединений, таких как гидрид, пероксид и алкоголяты. 16
Калий
Металлический калий был получен электролизом расплавленного едкого кали (KOH) в 1807 английским химиком и физиком Г.Дэви.

Лебедев Ю.А. Лекция 4 |
15 |
Название «potassium», выбранное Дэви, отражает происхождение этого элемента из поташа K2CO3.
Сегодня мировое производство металлического калия составляет около 500 т/год.
Одна из важнейших областей применения – получение надпероксида KO2 (эффективный реагент в системах регененации воздуха) прямым сжиганием металла. 17
Рубидий и цезий
Мировое производство рубидия – до 1000 килограммов в год, цезия – до 60 тонн в год. В металлическом виде применяются в фотоэлементах, в виде солей – в научных исследованиях.18
s-металлы 2 группы.
К s-металлам 2 группы относятся Be, Mg и щелочно-земельные металлы Ca, Sr, Ba, Ra. Последний, в силу отсутствия у него стабильных изотопов (cамым долгоживущим является α -радиоактивный 226Ra с периодом полураспада около 1600 лет) весьма редок и в настоящее время не имеет важных практических применений.
Структура внешнего электронного уровня – ns2. Проявления химической активности обусловлены возбуждением и гибридизацией электронов внешнего энергетического уровня.19
Все указанные элементы являются металлами, с химической точки зрения ярко проявляющими металлические свойства, однако Be и Mg менее активны, чем щёлочно-земельные металлы.
Все они являются только восстановителями и проявляют степень окисления +II.
По физическим свойствам в виде простых веществ они являются относительно мягкими металлами с малой плотностью.20
Применение в технике s-металлов 2 группы и их соединений.
