
- •Кафедра физической химии СПбГЭТУ «ЛЭТИ»
- •Основные определения
- •Почему?
- •Химическая связь…
- •Химическая связь
- •Химическая связь
- •Химическая связь
- •Типы химической связи
- •Теории химической связи
- •Метод валентных связей
- •Метод валентных связей
- •Метод валентных связей
- •Метод валентных связей
- •Метод валентных связей
- •Свойства ковалентной
- •Свойства ковалентной
- •Свойства ковалентной
- •Свойства ковалентной связи
- •Свойства ковалентной связи
- •Свойства ковалентной связи
- •Свойства ковалентной связи
Кафедра физической химии СПбГЭТУ «ЛЭТИ»
|
|
F2
ХИМИЧЕСКАЯ СВЯЗЬ
|
|
|
|
|
|
|
||
|
|
|
H2O |
sp |
|
С2H2
ОСЕННИЙ СЕМЕСТР 2017-2018 учебный год

Основные определения
Вещество – одна из форм материи, обладающая массой
Атом – мельчайшаяпокояхимически неделимая частица вещества
Индивидуальн |
Молекул |
Кристалл |
ый атом |
а |
(Fe, NaCl, …) |
(He, Ne, …) |
(H2, HCl, |
|
Молекула – мельчайшая…) частица вещества, сохраняющая его химические свойства
Почему?
минимуму энергии системы соответствует
максимум устойчивости и, наоборот, минимуму устойчивости отвечает максимум энергии»
Процесс самопроизвольный, т.е.
ΔG<0 ΔG= ΔH - TΔS
Энтальпийны |
Энтропийный |
+й фактор |
фактор |
Молекула - устойчивая электронейтральная частица, представляющая собой мельчайшую частицу вещества, обладающую его химическими свойствами
Атом 1 Атом 2 |
Молекула |
Не способствует |
||
|
|
|
|
|
S1 |
> |
S2 ΔS< химическойобразованию |
||
|
ΔG<0 |
только если 0 |
связи |
|
|
|
|||
|
+ |
|
+Энергия |
|
|
|
|
ΔH<0 |
|
Атом 1 |
Атом 2 |
Молекула |
Химическая связь… |
|
ХИМИЧЕСКАЯ СВЯЗЬ это |
|
взаимодействие атомов, обусловленное |
|
|
перекрыванием |
их электронных облаков и |
|
сопровождающееся уменьшением полной |
|
Химическая связь |
энергии системы |
осуществляется валентнымиУs- p- элементовэлектронамиэто внешние электроны
…ns1-2 или …ns2 np1-6
ns-
…(n-1)d1-10 ns2
У f-элементов – ns-, (n-1)d- и (n-2)f
электроны
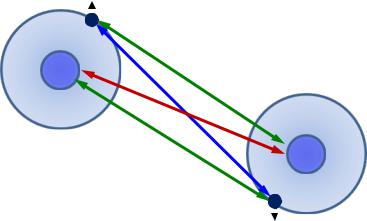
Химическая связь
|
Ядерно-электронные |
|||
|
взаимодействия |
|||
|
связи способствуют образованию химической |
|||
|
|
|
Межэлектронные |
|
+ |
|
|
взаимодействия |
|
|
|
|||
|
|
а) притяжение электронов |
||
|
|
|
с антипараллельными |
|
+ |
спинами |
|||
(положительный |
||||
|
|
|
||
|
|
|
фактор |
|
|
|
|
||
|
|
|
в образовании связи); |
|
|
|
|
||
Межъядерное |
б) отталкивание электронов |
|||
с параллельными спинами |
||||
отталкивание |
не способствует (отрицательный |
|||
химической связи |
фактор) образованию |
|||
|
||||
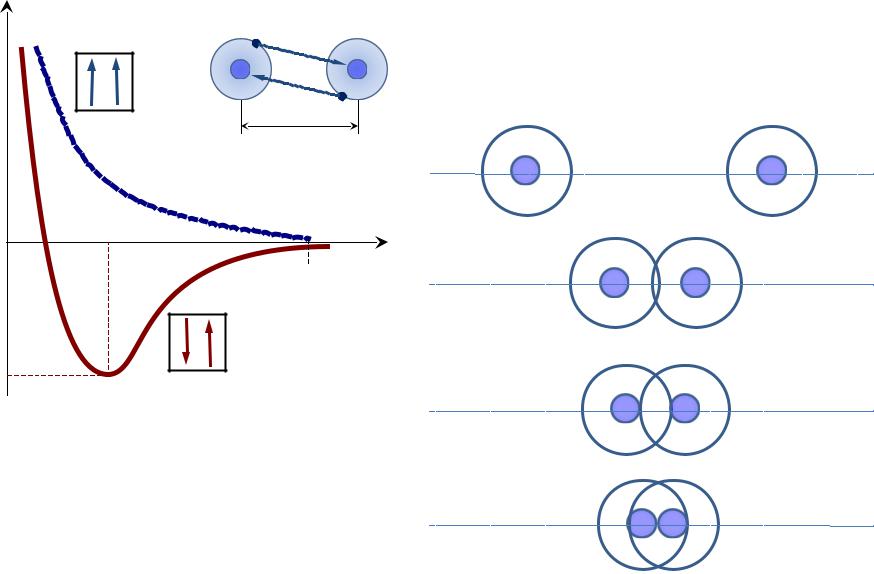
Химическая связь
E |
|
|
|
|
В 1927 году В. Гайтлер и Ф. |
|
ē1 |
|
|
Лондон |
|
|
|
|
|
||
|
|
|
|
|
исследовали зависимость |
|
|
+ |
|
+ |
потенциальной энергии системы |
|
|
|
r1 ē2 |
|
(E) |
|
|
|
|
|
из двух атомов водорода |
|
|
|
|
|
от расстояния между их ядрами |
|
|
r0 |
r1 |
|
(r) |
|
|
r |
|
||
|
от |
Fпр > Fот |
Fпр > Fот |
||
|
F |
|
|
||
|
< |
|
|
|
|
|
пр |
|
|
|
|
E0 |
F |
|
|
|
|
|
Fпр = Fот |
|
|
Fпр = Fот |
|
|
|
|
|
||
r0 – расстояние между атомами в молекуле |
|||||
E0 – энергия связи |
|
|
Fпр < Fот |
||
Химическая связь
Длина связи (r)
атомов
Зависит от размеров электронных оболочек и степени их перекрывания
С уменьшением длины связи обычно увеличивается энергия связи
и, соответственно, устойчивость
Энергиямолекул химической связи
(Есв) – количество энергии,
выделяющееся при образовании химической
связи
Чем больше энергия химической связи, тем устойчивее молекулы

Типы химической связи
Тип химической связи определяется характером распределения электронной плотности между взаимодействующими атомами
Электронная Электронная плотность Электронная плотность
плотность смещена сосредоточена рассредоточена
к одному из атомов в межатомном пространствепо всему кристаллу
ИОННАЯ |
КОВАЛЕНТНАЯ |
МЕТАЛЛИЧЕСКА |
|
СВЯЗЬ |
|
СВЯЗЬ |
Я СВЯЗЬ |
ПОЛЯРНАЯ |
ДЕЛОКАЛИЗОВАННА |
||
|
СВЯЗЬ |
|
Я СВЯЗЬ |
При сближении молекул также возникает ХИМИЧЕСКАЯ СВЯЗЬ
Водородная химическая связь
Ван-дер-Ваальсовы
Межмолекулярные связи взаимодействияотл чаются значительно меньшей прочностью
Теории химической связи
Метод |
Метод |
|
валентных |
молекулярных |
|
связей (МВС) |
орбиталей |
|
Представления о |
(ММО) |
|
Представления о многоцентровых |
||
двухцентровых |
делокализованных связях |
|
локализованных связях |
(Р. Малликен, Ф. Хунд, Э. Хюккель и |
|
(Ф. Лондон, В. Гайтлер, Л. |
др.) |
|
|
Полинг) |
40-е годы ХХ века |
е |
века |
|
Обе теории дополняют друг
друга
Метод валентных связей
Основные положения
1.Химическая связь между атомами образуется в результате обобществления валентных электронов, т.е. образования общих электронных пар
2.Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами
3.При образовании химической связи происходит частичное перекрывание атомных орбиталей (АО), что приводит к увеличению электронной плотности в межъядерном пространстве
4.Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО
5.В пространстве химическая связь располагается в том направлении, в котором возможность перекрывания АО наибольшая
6.Связь, образованная перекрыванием АО по линии, соединяющей центры атомов, называется – σ-связью, а по обе стороны от линии π-связью.
Еσ > Еπ
7.Если молекула образуется путём перекрывания двух АО, связь
называется одинарной, если более двух АО – кратной.
