
- •Модуль №2 по Химии Вопрос №1 Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, нормальная концентрация, титр.
- •Вопрос № 2 Способы приготовления растворов (метод навески, метод разбавления, приготовление из фиксанала, метод смешивания).
- •Вопрос №8 Состав и механизм действия ацетатного буфера.
- •Вопрос № 11. Состав и механизм действия гемоглобинового буфера.
- •Вопрос №12 Состав и механизм действия фосфатного буфера.
- •Вопрос №13 Состав и механизм действия белкового буфера.
- •Вопрос №14 кор (кислотно-основное равновесие организма). Основные показатели кор.
- •Вопрос №15 Диффузия (определение и примеры).
- •Вопрос №16 Осмос (определение и примеры). Эндо- и экзосмос (определение и примеры).
- •Вопрос №17 Осмотическое давление (закон Вант – Гоффа) – формулировка и математическое выражение.
- •Вопрос №18 Роль осмоса в биосистемах (тургор, плазмолиз, гемолиз, изотонические растворы, гипертонические растворы).
Модуль №2 по Химии Вопрос №1 Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, нормальная концентрация, титр.
Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах. Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
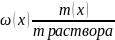
Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
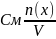
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
Нормальная концентрация (молярная концентрация эквивалента, СN)- количество мольэквивалентов вещества, содержащегося в 1 л раствора. Единица измерения моль-экв/л, сокращенно обозначается буквой N.
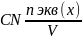
Титр- титрованная концентрация (Т). Показывает сколько грамм растворенного вещества содержится в 1 мл раствора (выражается в г\мл)

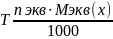
V-объем в мл
N-нормальная концентрация nэкв/V;
Mэкв(х)- моль-экв масса вещества
Вопрос № 2 Способы приготовления растворов (метод навески, метод разбавления, приготовление из фиксанала, метод смешивания).
Стандартные - растворы с известной концентрацией, которые служат для определения концентрации других растворов
Способы приготовления стандартных растворов:
• Метод точной навески
Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
- вещество должно быть чистым (без примесей)
- иметь постоянный состав (соответствовать определённой химической формуле)
- быть устойчивым как на воздухе, так и в растворе
- иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными.
• Метод неточной или приблизительной навески
Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
• Метод разбавления
Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
• Фиксанальный метод
Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным. Первичный стандарт - стандартный раствор, приготовленный по точной навеске Вторичный стандарт - стандартный раствор, характеристики которого установлены по первичному стандарту
Вопрос № 3.
Какие растворы называются буферными растворами?
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Вопрос №4
Классификация буферных растворов. Примеры.
Различают в основном протолитические буферные растворы двух типов:
Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного основания
СН3СООNa → Na+ + CH3COO-
Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток сопряженной кислоты
NH4Cl → Cl- + NH4+
Амфотерные- Аминокислотные и белковые буферные системы. Буферное действие этих буферных систем начинает проявляться при добавлении к ним некоторого количества кислоты или щелочи. Образуется смесь двух форм белка: а) слабая «белок-кислота»+соль этой слабой кислоты б) слабое «белок-основание»+соль этого слабого основания– аминокислотные белковые р-ры (-NH2) – основания
(-СООН)
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
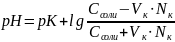
При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
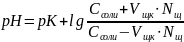
При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Вопрос №5
Уравнение для расчета рН буферных систем кислотного и основного типа (Гендерсона – Гассельбаха). Факторы, влияющие на значение рН буферных систем.
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
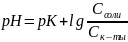
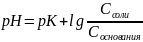
где рК = -ℓg КД.
С – молярная или эквивалентная концентрация электролита (C = V N)
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Вопрос №6
Интервал буферного действия (определение и формула для расчета).
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
Вопрос №7
Буферная емкость (определение; формула для расчета; факторы, влияющие на значение буферной емкости).
Буферная ёмкость — это способность буферной системы противодействовать изменению рН среды. Факторы, влияющие на значение буферной емкости: концентрация электролитов и соотношение кол-ва сильной кислоты.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
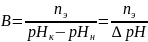
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН ( до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
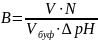
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.- объём буферного раствора,
Δ рН – изменение рН.
