
Химическим равновесием называется такое состояние обратимой химической реакции
aA + bB = cC + dD,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
![]() ,
(1)
,
(1)
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
![]() .
(2)
.
(2)
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
![]() .
(3)
.
(3)
Для идеальных газов Pi = CiRT и Pi = XiP, где P – общее давление, поэтому KP, KC и KX связаны следующим соотношением:
KP = KC (RT) c+d–a–b = KXP c+d–a–b. (4)
Константа
равновесия связана с ![]() rGo химической
реакции:
rGo химической
реакции:
![]() (5)
(5)
![]() (6)
(6)
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
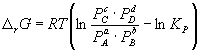 .
(7)
.
(7)
 .
(8)
.
(8)
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
![]() (9)
(9)
и изохоры химической реакции (изохоры Вант-Гоффа)
![]() .
(10)
.
(10)
Интегрирование уравнения (9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (11)
(11)
![]() (12)
(12)
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
Интегрирование в пределах K1, K2, и T1, T2 дает:
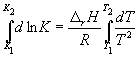 (13)
(13)
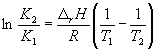 (14)
(14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
