
3118
.pdf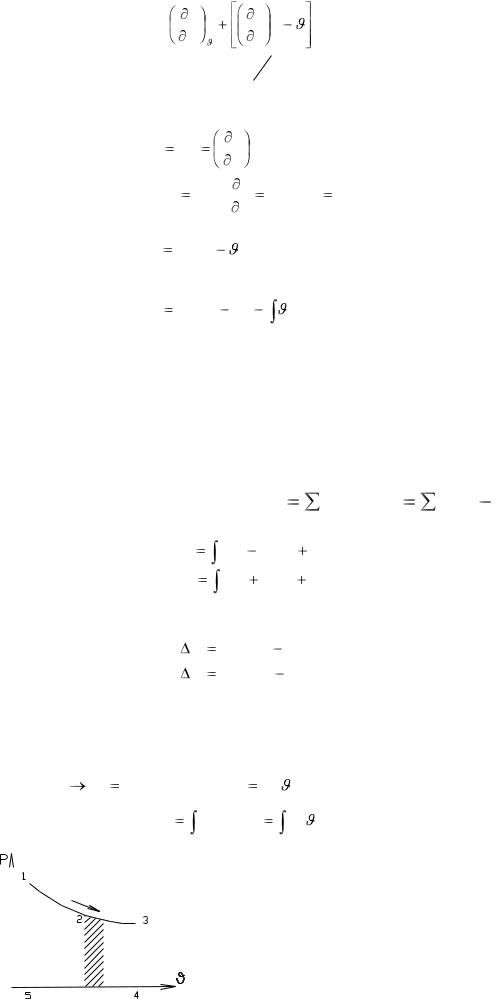
28
откуда
C x = |
h |
|
h |
|
|
|
|
|
|
T |
|
p |
T |
|
|
|
dP |
(40) |
|
|
||
dT |
||
|
В уравнении (40) производная dP dT определяет процесс изменения состояния
тела.
В процессе р=const, dP=0 удельная теплоемкость:
Cx |
C p |
|
h |
|
|
|
|
(41) |
||
|
|
|
|
|
|
|
||||
|
T |
p |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Для идеального газа, h |
h(T ), |
h |
|
dh |
иС |
|
dh |
. |
||
|
|
|
|
p |
|
|||||
|
|
|
T |
|
dT |
dT |
||||
|
|
|
|
|
||||||
Уравнение (37) перепишется в виде: |
|
|
|
|||||||
dq Cp dT |
dP |
|
|
|
(42) |
|||||
В интегральной форме (Ср=const, полагаем)
|
р2 |
|
q C р (T2 T1 ) |
dР. |
(43) |
р1
Уравнения (28), (34), (37), (42) являются основными для изучения термодинамических процессов.
Величины U и Н определяют запас энергии в рабочем теле и в каждом состоянии имеют вполне определенное значение. Обе величины являются функциями состояния. dU и dH-полные дифференциалы этих функций. Изменение этих величин в процессе равно разности их значений в конечном и в начальном состояниях;
U и Н аддитивные величины, т.е. Н |
Hi ; |
U |
Ui (i часть) |
Из уравнений (27) и (36): |
|
|
|
U |
(dQ |
pdV) |
U |
H |
(dQ |
VdP) |
H |
0
0
т.е. U и Н определяются до постоянной (U0 и Н0) Для идеального газа с постоянной теплоемкостью:
U |
mCv (T2 |
T1 ), |
(44) |
|
H |
mC p (T2 |
T1 ). |
||
|
Если рабочее тело увеличивает свой объем, то оно совершает работу расширения по преодолению внешних сил.
Если газ уменьшает свой объем под воздействием внешнего давления, то ра-
бота совершения над газом – работа сжатия. |
|
|||||||
Для m кг dL pdV ; для 1 кг dl |
pd |
. После интегрирования: |
|
|||||
2 |
|
|
|
|||||
|
|
|
|
|
L pdV; |
l |
pd . |
(45) |
1 |
|
|
|
|||||
|
|
|
|
|
|
Поскольку Р>0 (всегда), то dV>0, dL>0- |
||
|
|
|
|
|
|
|||
|
|
|
|
|
работа расширения; при dV<0, dL<0-работа |
|||
|
|
|||||||
|
|
|
|
|
сжатия отрицательная. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

29
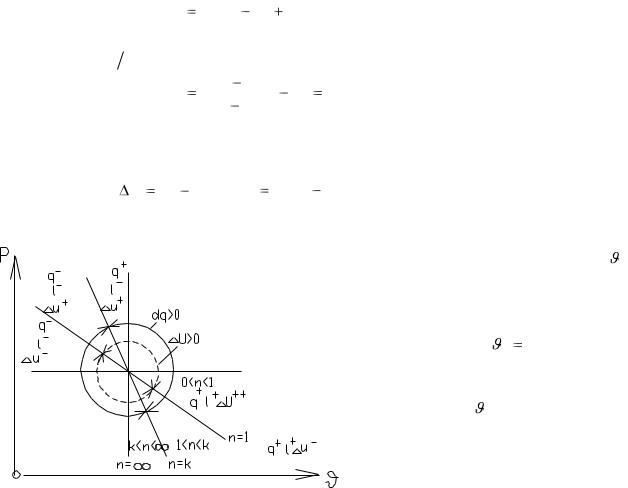
Так как Р в процессе изменяется, то работа l будет зависеть от вида процесса. В координатах Р , dl пропорциональна заштрихованному участку на графике. l - пропорциональна площади 123451. Поскольку P 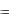 f (V ) , то
f (V ) , то
2
L  f (V )dV - работа есть функция
f (V )dV - работа есть функция
1
Рис. 4. процесса, а не функция состояния, а поэтому dL - не полный дифференциал.
Формула приведенная для работы справедлива для обратимых процессов. (в этих процессах может быть неизменно направление процесса на обратное). Разница между действительной работой и работой в обратимых процессах называется работой диссипации.
Всякий перенос и превращения энергии связаны с явлением диссипации, которое заключается в том, что все виды энергии при переносах и взаимных превращениях частично или полностью переходят в теплоту.
Единая мера диссипации для любого движения – обобщенная работа диссипативных сил, которая всегда отрицательна, т.к. переходит в теплоту
диссипации dQдис 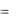 dLдис .Теплота диссипации идет на повышение внутренней
dLдис .Теплота диссипации идет на повышение внутренней
энергии тела.
Так как алгебраическая сумма внутренней энергии и работы зависит от характера процесса, то теплота не является параметром состояния, а dQ не является полным дифференциалом.
2.2.Термодинамические процессы в газах
Основное уравнение для термодинамических процессов представляет собой математическую зависимость между тремя величинами: внешняя теплота (подводимая извне или отводимая от рабочего тела), изменение внутренней энергии и внешняя работа газа dq=du+dl.
Рассмотрим случай : 1 кг идеального газа, для которого внутренняя энергия является функцией только Т, а теплоемкость не зависит от Т и является посто-
янной. |
|
|
|
Пусть в процессе на изменение внутренней энергии расходуется |
-ая часть |
||
всего подводимого количества теплоты: |
|
||
|
dU |
dq , |
(46) |
тогда |
dq dq dl или |
dl (1 )dq |
(47) |
В термодинамике процессы, подчиненные закономерности, выражаемой  const , называются политропными (греч. многообразный).
const , называются политропными (греч. многообразный).
В политропных процессах 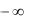
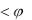
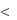 .
.
Количество теплоты для любого политропного процесса:

|
|
|
|
|
|
|
|
|
|
30 |
|
||
|
|
|
|
|
|
|
|
|
dq |
C dT , |
(48) |
||
где С -теплоемкость политропного процесса (индекс |
указывает на условие |
||||||||||||
const ). |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
dq |
|
1 du |
|
1 Cv dT |
|
Cv |
. |
(49) |
||||
dT |
|
|
|
dT |
|
|
|
dT |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
Определим зависимость между параметрами газа в политропном процессе. Для этого запишем уравнение первого закона термодинамики:
dq Cv dT pd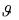
и уравнение элементарного количества теплоты в политропном процессе:
dq C dT
таким образом, C dT Cv dT pd |
(50) |
Исключим из (50) dT, записав дифференциальное уравнение состояния идеального газа:
|
|
|
|
dT |
|
Pd |
dP |
. |
|
|
|
|
|
|
|
|
(51) |
|||||||||
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Получим |
C |
(Pd |
dP) |
C |
|
(Pd |
|
dP) |
|
Pd . |
|
|
|
|||||||||||||
R |
R |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(C Cv |
R)Pd (Cv |
C ) dP. |
|
|
|
|||||||||||||||||||
(C C p )Pd (C Cv ) dP 0 |
|
|
|
|
|
|
|
1 |
|
|
|
. |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
(C |
Cv ) p |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Получим: |
|
|
C |
C p d |
|
|
|
|
|
dP |
0 . |
|
|
|
|
|
|
|
|
|
|
(52) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C |
Cv |
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Введем обозначение: |
|
n |
|
|
C |
C p |
|
|
C p |
|
C |
|
. |
(53) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
C |
Cv |
|
|
Cv |
|
C |
|
||||||||||||||||
Получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
d |
|
|
dP |
0 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Интегрируя в пределах от начала до конца процесса и потенцируя, находим:
|
|
|
|
|
|
|
P1 |
n |
|
|
P2 |
n |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
(54) |
|||
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
const |
|
|
|
||||
Так как |
P |
|
RT |
, то |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
RT1 |
n |
|
|
RT2 |
n |
|
|
|
||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
||
отсюда |
|
T |
n 1 |
T |
n 1 |
|
или |
T n 1 const |
(55) |
|||||||
|
|
1 |
1 |
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
Так как |
RT |
, то |
|
|
|
|
|
|
|
|
|
|
|
|||
P |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
n |
|
|
|
|
|
|
|
|
|
P1 |
RT1 |
|
P2 |
RT2 |
|
|
|||
|
|
|
|
|
|
|
P1 |
P2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
отсюда:
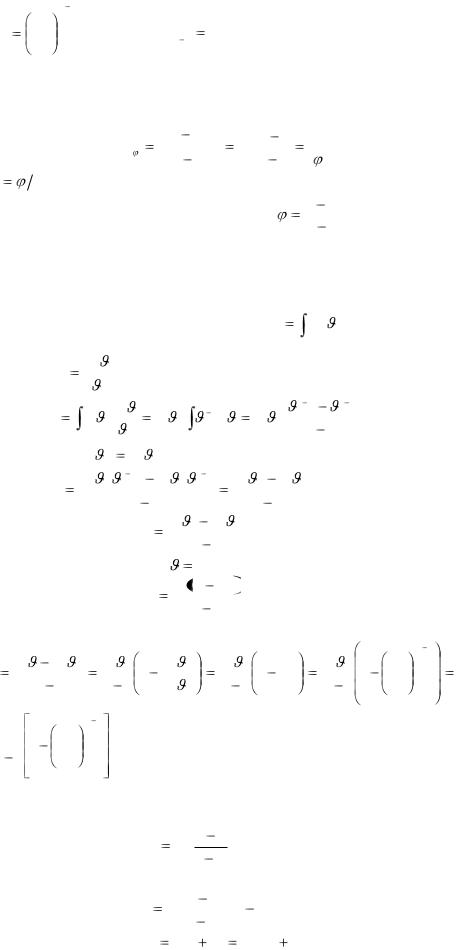
|
|
|
|
|
|
|
|
|
|
31 |
|
|
|
|
n 1 |
|
|
|
|
|
|
T2 |
|
P2 |
|
n |
|
|
T |
n |
|
|
|
|
|
|
или |
|
|
|
(56) |
||
|
|
|
|
|
|
|
|
const |
||
T |
|
P |
|
|
|
Pn 1 |
||||
|
|
|
|
|
|
|
||||
1 |
1 |
|
|
|
|
|
|
|
|
|
Величина n-показатель политропы, постоянный для каждого процесса (в идеальном газе Ср и Сv есть const).
Из (53) имеем :
|
С |
С |
р |
nСv |
Cv |
k |
n C |
v |
, |
(57) |
|||
|
|
1 |
n |
1 |
n |
|
|
|
|||||
|
|
|
|
|
|
|
|||||||
k |
Cv |
|
|
|
|
|
|
|
|
|
|
|
|
отсюда |
|
|
|
|
1 |
n |
(58) |
||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
k |
|
n |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
Из (58) следует, что доля теплоты, пошедшая на изменение внутренней энергии определяется видом термодинамического процесса (n).
Работа 1 кг газа в политропном процессе:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
Pd |
(59) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р1 |
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Так как Р |
|
|
1 |
|
, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
d |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
п |
|
1 n |
|
|
|
|
|||||||
|
|
|
|
|
l |
|
P |
n |
P |
|
n |
|
|
n d |
P |
n |
|
2 |
|
|
1 |
|
. |
(60) |
|||||||||||||||||||||
|
|
|
|
|
1 |
|
n |
1 |
|
|
1 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
n |
|
|
|
|
|||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Поскольку |
P |
n |
|
P |
n ,то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
P |
n 1 п1 |
P |
|
n 1 п |
|
|
|
P |
2 |
P |
1 |
|
|
или |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
l |
|
2 |
2 |
2 |
|
|
1 |
1 |
1 |
2 |
|
1 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
n |
|
|
|
|
|
|
|
|
|
|
|
1 |
n |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
|
P1 |
1 |
P2 2 |
. |
|
|
|
|
|
|
|
|
|
|
|
(61) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для идеального газа P |
|
|
|
RT тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
R T1 |
|
T2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
(62) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Уравнение (61) запишем в другом виде: |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|
l |
P1 |
|
P2 2 |
|
|
|
P1 1 1 |
|
P2 2 |
|
|
P1 1 1 |
|
T2 |
|
|
|
|
P1 1 1 |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
n 1 |
|
|
|
n 1 |
|
P1 1 |
|
|
n 1 |
|
|
T1 |
|
|
|
|
n 1 |
P1 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT1 |
1 |
|
P2 |
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(63) |
|||||||
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
|
P1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Уравнение (63) широко используется в теории турбин и в газодинамике. Количество теплоты подводимой к газу находим по формуле:
k n dq Cv 1 n dT
q C |
|
k |
n |
(T |
T ) |
(64) |
v 1 |
|
|||||
|
n |
2 |
1 |
|
||
С другой стороны dq dU dl Cv dT dl или:
32
q Cv (T2 |
|
T1 ) |
l |
|
||
где l может вычисляться по любой форме соотношений (63,62). |
|
|||||
При n=k= С p Cv имеем: |
|
|
|
|
|
|
q C |
|
k |
k |
(T |
T ) 0 |
(65) |
|
|
|
||||
|
v |
1 |
n |
2 |
1 |
|
т.е. подводимое количество теплоты в процессе равно нулю. Процесс без обмена теплотой с окружающей средой называют адиабатным.
Из уравнения 1-го закона термодинамики 0=du+dl, dl= - du Откуда: l  U U1 U 2 или l Cv (T1 T2 )
U U1 U 2 или l Cv (T1 T2 )
Вся совершаемая работа получается за счет уменьшения внутренней энергии
газа. |
|
|
|
Формулы связи между Р, Т, и |
|
|
формула l в адиабатном процессе |
|
|
получается из формул политропно- |
|
|
го процесса заменой в них n на к. |
|
|
Соотношение |
P k const называют |
|
уравнением Пуассона. |
|
|
Все политропные процессы изо- |
|
|
бражаются на P |
диаграмме: |
|
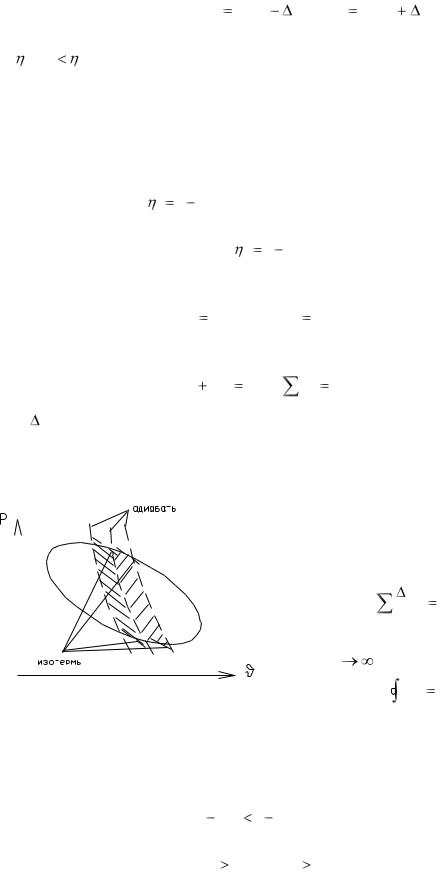
1. Все политропные процессы, кри- |
|
|
вые изменения, которые распола- |
|
|
гаются выше изотермы (n=1) проте- |
|
|
кают с увеличением внутренней |
|
Рис 5 |
энергии (температуры), а политроп- |
|
ные процессы, лежащие ниже изотермы с уменьшением внутренней энергии (температуры).
2. Все политропные процессы, лежащие выше адиабаты (n=k) протекают с подводом теплоты, а политропные процессы, лежащие ниже адиабаты – с отводом тепла.
Для камер ЖРД характерно расширение газа с 1<n<k. Эти процессы располагаются между изотермой и адиабатой. При изотермическом расширении работа совершается за счет теплоты, подводимой из вне. При адиабатическом расширении работа совершается только за счет внутренней энергии газа.
В процессах, расположенных между изотермой и адиабатой, работа газа совершается частично за счет теплоты, подведенной извне; частично за счет внутренней энергии газа. Чем ближе n к k, тем большая доля работы совершается за счет убыли внутренней энергии, тем сильнее охлаждается газ. Величина k определяется родом ПС. В смеси реагирующих газов k тем больше чем больше в этой смеси одно и малоатомных газов. Целесообразно использовать то топливо, в составе ПС которого содержится больше малоатомных газов.

33
2.3.Второй закон термодинамики
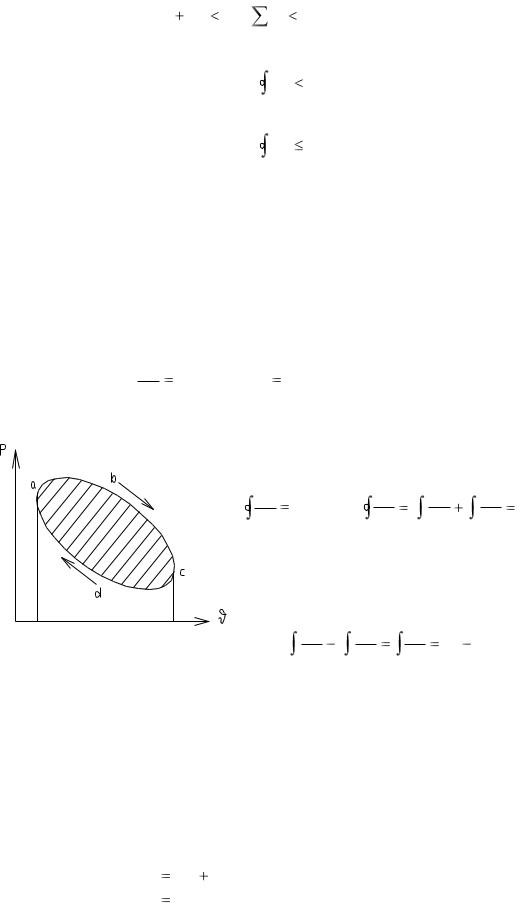
В процессе расширения от Р1 до Р2 газ производит работу l1 2 . Для повторения того же процесса расширения и вновь получать работу необходимо возвратить газ в исходное положение (из точки 2 в точку 1), при этом газ совершит.
Рис. 6 Прямой цикл Рис.7 Обратный цикл
круговой процесс – цикл.
Процесс сжатия должен выполнять по пути отличному от пути расширения, иначе LЦ L1 2 L2 1 будет равна нулю.
Цикл, которого LЦ >0 – называют прямым циклом или циклом теплового дви-
гателя (работа расширения больше работы сжатия).
Цикл, которого LЦ <0 (расходуется работа) – называют обратным (работа
сжатия больше работы расширения). По обратным циклам работают холодильные установки.
Циклы бывают обратимые и необратимые.
Цикл, состоящий из обратимых равновесных процессов, называют обратимым. В результате их совершения термодинамическая система возвращается в исходное положение, не вызывая в окружающей среде ни каких изменений.
Если хотя бы один из процессов, входящий в состав цикла, является необратимым, то и весь цикл будет необратимым. В необратимых циклах система не возвращается в исходное состояние. Все естественные самопроизвольные процессы необратимы. Обратимых процессов в природе не существует.
Пример необратимого процесса – процесс трения, работа затрачиваемая на его преодоление необратимо превращается в теплоту, выделяющуюся при трении.
Степень необратимости процессов различна (трение скольжения больше трения качения). Для возвращения система при необратимых процессах в исходное состояние нужно совершить компенсирующий процесс (затратить теплоту или работу).
Реальные процессы идут в направлениях установления равновесия в любой системе, т.е. выравнивания Р, Т, С (концентрации) и д.р.
34
Утверждение о невозможности получения работы за счет энергии тел, находящихся в термодинамическом равновесии, составляет основное положение основного закона термодинамики.
Существует несколько формулировок второго закона термодинамики: «Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому телу» Р. Клаузиус.
«Невозможен процесс, единственный результат которого состоял бы в поглощении теплоты от нагревателя и полном преобразовании этой теплоты в работу». У. Томсон.
В круговом процессе подведенная теплота Q1 не может быть полностью превращена в работу. Часть теплоты Q2 должна быть отведена в холодильник.
Совершенство цикла (оценка превращения теплоты в полезную работу) характеризуется термическим коэффициентом полезного действия.
Полученная полезная работа за цикл равна:
LЦ Lp Lсж
C другой стороны в работу превращается количество теплоты (Q1-Q2),
т.е.:
LЦ Q1-Q2.
Термический КПД – отношение работы совершаемой в прямом и обратном цикле, к теплоте, сообщенной рабочему телу от внешних источников:
t |
LЦ |
Q |
Q |
|
(66) |
|||
|
|
1 |
|
|
2 |
|||
|
|
|
|
|
|
|
||
|
Q1 |
|
Q1 |
|
|
|
|
|
|
|
Так |
как отводимое от рабочего тела |
|||||
|
Q2 |
0,то |
|
|
t <1 всегда. |
|||
|
|
Цикл, |
дающий максимальное значение t |
|||||
(при определенных температурах нагревается и охлаждается) носит название цикла Карно.
Предложен он был Сади Карно в 1824г. для цикла Карно характерно – подвод и отвод теплоты осуществляется при Т=const, а процессы сжатия и расширения протекают
|
|
Рис. 8 |
|
|
|
|
|
|
|
адиабатически: Р к |
const . |
|
|
|
|
|
|||
|
1 – 2 изотермическое расширение. Газ совершает работу, определяемую |
||||||||
площадью 12681 и равную L |
|
mRT ln |
2 |
. |
(67) |
||||
2 |
|
||||||||
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
Из нагревателя |
подводится теплота, эквивалентная |
этой работе |
||||||
Q1 |
mRT1 ln |
2 |
|
|
|
|
|
|
(68) |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
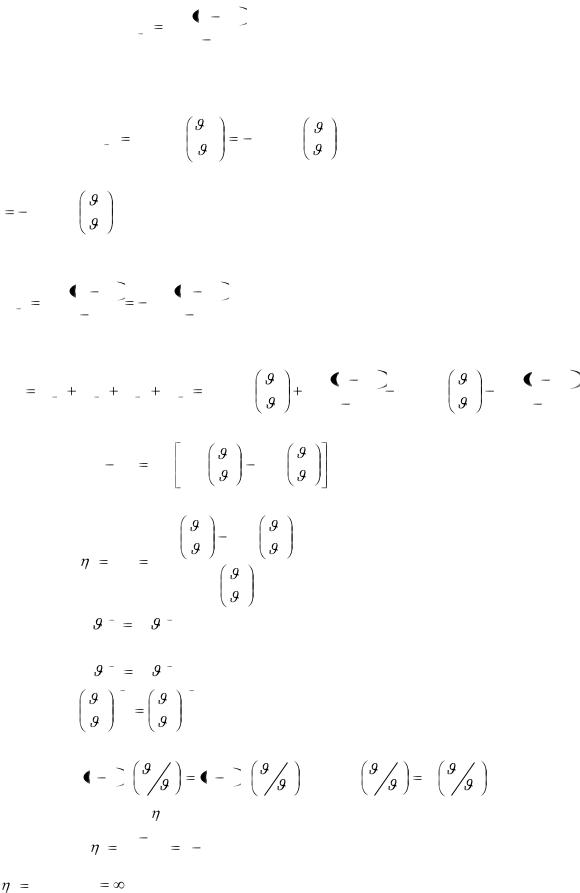
35
2-3. Адиабатное расширение. Газ совершает работу, определяемую площа-
дью 2 3 5 6 2 и равную |
|
|
|
|
|
|
||
L |
|
|
mR T1 |
T2 |
; |
Q |
=0. |
(69) |
2 |
3 |
|
|
|||||
|
k |
1 |
|
2-3 |
|
|
||
|
|
|
|
|
|
|
||
Температура газа снижается до Т2.
3-4. Изотермическое сжатие. На сжатие затрачивается работа, определяемая площадью 4 3 5 7 4 и равная
|
|
|
|
L |
|
mRT |
|
ln |
4 |
mRT |
|
ln |
1 |
. |
(70) |
|
|
|
|
|
|
|
|
||||||||
|
|
|
4 |
2 |
|
2 |
|
||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
3 |
|
|
4 |
|
|
|
В |
охладитель |
отводится |
теплота (при Т=Т2) эквивалентная |
этой работе |
|||||||||||
Q |
mRT |
|
ln |
3 |
. |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
4-1. Адиабатное сжатие. На сжатие затрачивается работа, определенная площадью 1 4 7 8 1 равная
L |
|
|
mR T2 |
T1 |
|
mR T1 |
|
T2 |
|
; |
|
|
|
|
|
|
Q |
4-1 |
=0. |
|
|
|
|
|
|
|
|
|
|
|
|
(71) |
|||||||||||||||||||||
4 1 |
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Газ нагревается до температуры Т2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Полученная работа цикла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
L |
|
L |
L |
|
|
|
|
L |
|
|
|
L |
|
mRT ln |
|
2 |
|
|
|
|
mR T1 |
T2 |
|
|
mRT |
|
ln |
|
|
3 mR T1 |
T2 |
. Ко- |
|||||||||||||||||||||
Ц |
3 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
1 2 |
2 |
|
3 |
|
|
|
|
4 1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
k |
1 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
личество теплоты, превращенное в работу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
Q1 |
Q2 |
|
|
mR T1 ln |
2 |
|
|
T2 ln |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(72) |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Термический кпд цикла Карно: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 ln |
|
2 |
|
|
|
|
|
|
T2 ln |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
LЦ |
|
|
|
1 |
|
|
|
|
|
|
4 |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(73) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Q1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 ln |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Так как |
T1 |
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2 |
|
|
|
|
3 |
|
|
|
|
адиабата 2-3, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
T1 |
1 |
|
|
|
|
T2 |
4 |
|
|
|
|
адиабата 4-1, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
то |
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Прологарифмируем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
k |
|
1 ln |
|
2 |
|
|
|
|
|
k |
|
1 ln |
|
3 |
|
|
|
|
или |
ln |
2 |
ln |
3 |
|
. |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
4 |
|
|
|
|||||
Окончательно для |
|
|
t |
имеем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
T1 |
|
T2 |
|
1 |
|
T2 |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(74) |
|||||||||||
|
|
|
|
|
|
t |
|
|
|
|
T1 |
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
t |
1 при T1 |
|
|
|
|
, Т2=0; реальная тепловая машина не может работать по цик- |
|||||||||||||||||||||||||||||||||||||||||||||||
лу Карно, т.к. температура рабочего тела не равна температуре горячего источ-
36
ника Т1; это возможно при бесконечно медленном протекании процесса и конечная работа будет получаться за бесконечно большое время. Мощность дви-
гателя, работающего по циклу Карно равна нулю. |
|
||||||
В необратимом цикле T1 |
T1 |
T1 ; T2 |
|
T2 |
|
T2 - интервал температур, в |
|
|
PT |
НАГР |
|
PT |
|
НАГР |
|
котором реализуется цикл, уменьшается и |
|
|
|
||||
tНЕОБР |
-в этом заключается теорема Карно. |
|
|||||
tОБР |
|
|
|
|
|
|
|
2.4.Интегральное уравнение второго закона термодинамики (Интеграл Клаузиса)
Полученные результаты справедливы для кругового равновесного процесса.
Для любого цикла t 1 |
|
Q2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
Q1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для обратимого цикла Карно |
|
|
|
|
1 |
|
|
T2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
||||||
Приравнивая эти выражения, получим |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
Q2 |
|
|
|
T2 |
|
|
|
или |
|
Q2 |
|
Q1 |
. |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
Q1 |
|
|
|
T1 |
|
|
|
|
|
|
|
T2 |
|
T1 |
|
|
|
|
|
|
|||||||||||||
Так как Q2<0, то: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
Q2 |
|
|
Q1 |
|
|
|
|
0; |
|
|
|
|
|
|
Q |
0 , |
|
|
|
|
|
|
(75) |
||||||||||
|
|
|
|
|
|
|
T2 |
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
где |
Q |
|
- приведенная теплота. В обратимом цикле Карно сумма приведенных |
|||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
теплот равна нулю. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Равенство (75) справедливо для любого |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обратимого цикла. |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Имеем произвольный обратимый цикл и |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разобьем его на большое количество элемен- |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тарных циклов Карно, тогда: |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
Qi |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 , |
(76) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
Ti |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где n- число элементарных циклов Карно. |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При n |
dQ |
0 , |
(77) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Рис 9. |
|
|
|
|
|
|
|
|
|
|
|
|
|
т.е. интеграл от |
|
dQ |
взятый по контуру цикла |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
равен нулю. Это интеграл Клаузиуса. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
Для необратимых циклов из-за механических и тепловых потерь: |
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
Q2 |
1 |
T2 |
. |
|
|
|
|
|
|
|
|
|
|
|
(78) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q |
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Отсюда: |
Q2 |
|
|
|
|
|
|
T2 |
|
или |
Q2 |
|
|
Q1 |
. |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
Q |
|
|
|
|
|
|
T |
|
|
|
T |
|
T |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||
37
Учитывая знак при Q2, получим неравенство:
Q2 |
|
Q1 |
0; |
Q |
0 |
T2 |
|
T1 |
T |
||
|
|
|
В пределе для всех необратимых процессов:
dQ |
0 |
(79) |
|
|
|||
T |
|||
|
|
Объединяя (77) и (79) получим интеграл Клаузиуса для любых циклов:
dQ |
0 |
, |
(80) |
|
|
||||
T |
||||
|
|
|
где
= - обратимые циклы.
 - необратимые циклы.
- необратимые циклы.
3.Энтропия
Если криволинейный интеграл взятый по контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции. В силу
(77):
dQ |
dS или dQ |
TdS , |
|
|
|
|
|
|
(81) |
T |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
где S – подобно внутренней энергии U и энтальпии Н есть функция состоя- |
|||||||||
|
ния, и называется энтропией. Размерность эн- |
||||||||
|
тропии (Дж/кгК). |
|
|
|
|
|
|
||
|
Действительно, |
|
для |
|
обратимого |
цикла |
|||
|
dQ |
0 , тогда: dQ |
|
dQ` |
dQ |
0 . |
|
||
|
T |
|
T |
|
abc T |
|
cda T |
|
|
|
Из этого выражения получаем, меняя пределы |
||||||||
|
интегрирования у второго интеграла: |
|
|||||||
|
|
dQ |
dQ |
c |
dQ |
Sc |
Sa . |
|
(82) |
|
|
abc T |
adc T |
|
T |
|
|||
|
|
a |
|
|
|
|
|||
Рис.10
Изменение энтропии газа не зависит от пути перехода из состояния а в состояние с. Это изменение одинаково и для обратимых и для необратимых процессов, но для обратимых процессов это изменение энтропии может быть оценено интегралом (81), а для необратимых это изменение энтропии всегда больше чем значение интеграла.
Можно объединить математические выражения первого и второго законов термодинамики в одном уравнении (для обратимых процессов, циклов):
1-й закон: |
dQ |
dU dL |
2-й закон: |
dQ |
TdS , |
откуда |
|
|
