
482
.pdf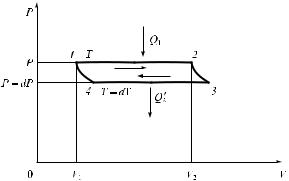
2.2.3. Фазовые переходы
Входы: температура, давление. Выходы: объем, сила, давление.
Графическая иллюстрация приведена на рис. 2.8.
Рис. 2.8. Фазовый переход первого рода
Сущность
Фазовые переходы в широком смысле — переход вещества из одной фазы в другую при изменении внешних условий — температуры, давления, магнитного и электрических полей и т. д.; в узком смысле — скачкообразное изменение физических свойств при непрерывном изменении внешних параметров.
При фазовых переходах первого рода скачком изменяются плотность веществ и энергия тела (см. рис. 2.8). При фазовых переходах второго рода плотность и энергия меняются непрерывно, а скачок испытывают такие величины, как теплоемкость, теплопроводность и др. Фазовые переходы второго рода не сопровождаются поглощением или выделением энергии.
К фазовым переходам первого рода относятся испарение и конденсация из газовой в жидкую фазу, плавление и затвердевание, сублимация и конденсация (десублимация) из газовой в твердую фазу, большинство полиморфных превращений, некоторые структурные переходы в твердых телах, например, образование мартенсита в сплаве железо — углерод. В чистых сверхпроводниках достаточно сильное магнитное поле вызывает фазовый переход первого рода из сверхпроводящего в нормальное
31
состояние. Характерным примером фазового перехода первого рода также может служить переход вещества из одного агрегатного состояния в другое.
В физике рассматривают четыре агрегатных состояния: твердое, жидкое, газообразное и плазменное. При переходах из одного агрегатного состояния в другое, как уже отмечено выше, обязательно выделяется или поглощается тепло. Переход от более упорядоченных структур к менее упорядоченным требует притока тепла извне, при обратных переходах выделяется такое же количество тепла, которое поглощается при прямом переходе. Отметим, что, как правило, переход из одного агрегатного состояния в другое обычно имеет место при постоянной температурах. Таким образом, фазовый переход является источником энергии или поглотителем тепла, работающим практически при постоянной температуре. При изменениях агрегатного состояния резко изменяются электри- ческие характеристики вещества. Так, если металл в твердом или жидком виде — проводник, то пары металла — типичный диэлектрик. Примером фазового перехода второго рода может служить переход жидкого гелия в сверхтекучее состояние, переход ферромагнетика в парамагнетик при точке Кюри и др. Перекристаллизация металла также является фазовым переходом второго рода. В момент перекристаллизации возникает эффект сверхпластичности металла. В этот момент металл, ранее имевший прочную и сверхпрочную структуру, становится пластичным, как глина. Но длится это явление считанные мгновения и протекает в очень узком, причем непостоянном интервале температур. Непосредственно подстеречь момент, когда начинается фазовое превращение, невозможно, но известно, что при перестройке кристаллической решетки металл начинает переходить из парамагнитного состояния в ферромагнитное, что сопровождается резким изменением его магнитной проницаемости.
Математическое описание
Примером математического описания фазового перехода первого рода может служить уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно данному уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесно протекающем процессе определяется выражением
32

dp Q dV , dT T
ãäå Q — теплота перехода; dV — скачок объема;
dp — производная от давления по температуре. dT
Графическая интерпретация уравнения приведена на рис. 2.8.
Применение
1.Изменение плотности при фазовых переходах у некоторых веществ (например, у воды и олова) позволяет использовать их для получе- ния высоких давлений.
2.При фазовых переходах второго рода наблюдаются интересные изменения макроскопических свойств объектов. У хрома есть температурная точка 37 °С, в которой он претерпевает фазовый переход, при этом у него скачком изменяется модуль упругости. На этом свойстве основан ряд изобретений.
3.Нередко изменения агрегатного состояния вещества позволяет очень просто решать до этого почти неразрешимые технические задачи. Например, как заполнить послойно емкость смешивающимися между собой жидкостями?
А. с. 509275. Способ послойного заполнения емкости смешивающимися жидкостями путем последовательного анализа их, отличающийся тем, что с целью упрощения процесса, первую жидкость, налитую в емкость, замораживают, следующую жидкость наливают на верхний слой замороженной жидкости, а затем последнюю размораживают.
4.При изменениях агрегатного состояния резко изменяются электрические характеристики вещества. Так, если металл в твердом или жидком виде проводник, то пары металла — типичный диэлектрик. Это свойство использовано в патенте США. Прибор для измерения давления жидкого металла содержит пробоотборную трубку типа трубки Вентури. Через участок этой пробоотборной трубки пропускается регулируемый электрический ток. При определенной величине тока температура взятой пробы жидкого металла возрастает до тех пор, пока жидкий металл не перейдет в парообразное состояние, в результате чего ток прерывается. Период времени, в течение которого через участок пробоотборной трубки протекает ток, является функцией давления жидкого металла
33
в системе. Таким образом, период времени при отборе пробы и подсчете импульсов тока вплоть до момента испарения определяется давлением жидкого металла в системе.
5. А. с. 207678. Пусковое устройство пресса связано с прибором, улавливающим момент фазового перехода: заготовку, нагретую до температуры чуть выше интервала фазового превращения, кладут в матрицу пресса. Остывая, металл заготовки в момент перекристаллизации резко изменяет свою магнитную проницаемость, что отмечается изменением тока в измерительной обмотке прибора, который включает пресс.
2.3.Молекулярные явления II рода
Êмолекулярным явлениям II рода относятся:
1)сорбция — поглощение одного вещества другим;
2)диффузия — выравнивание концентраций вещества по всему объему;
3)осмос — самопроизвольный переход вещества через полупроницаемую перегородку, разделяющую два раствора различной концентрации;
4)цеолиты — вещества, способные менять свои свойства при изменении внешних условий.
2.3.1.Сорбция
Входы: íåò.
Выходы: количество вещества.
Графическая иллюстрация приведена на рис. 2.9.
Сущность
Сорбция — это поглощение одного вещества другим. Поглотитель — сорбент, поглощаемое вещество — сорбат.
Если поглощение происходит только в поверхностном слое сорбента, т. е. происходит поверхностная сорбция, она называется адсорбцией.
Если же сорбат продиффундировал по всему объему сорбента, т. е. если произошла объемная сорбция, она называется абсорбцией.
По механизму протекания процесса сорбция подразделяется на физическую и химическую.
34

При физической сорбции между сорбентом и сорбатом происходит только межмолекулярное взаимодействие, т. е. сцепление достаточно непрочное, и со временем начинается обратный процесс — процесс отдачи поглощенного вещества, и в конце концов устанавливается равенство скоростей обоих процессов:
Рис. 2.9. Зависимость величины адсорбции от давления при
Vадсорбции = Vдесорбции. постоянной температуре
Химическая сорбция намного прочнее физической, десорбция самопроизвольно практически не происходит.
Еще одно отличие между физической и химической сорбцией заключается в том, что при повышении температуры физическая сорбция уменьшается, а химическая увеличивается.
В чистом виде физическая и химическая сорбция встречаются редко, чаще всего сорбция включает в себя элементы их обеих.
Адсорбция происходит на границе раздела следующих фаз:
–твердое тело — газ;
–твердое тело — раствор;
–раствор — газ.
В случае поглощения газа твердым адсорбентом адсорбция является функцией температуры и газового давления.
На рис. 2.9 показана зависимость величины адсорбции от давления при постоянной температуре.
Математическое описание
X ,
S
где Г — величина адсорбции, кмоль/м2; X — количество адсорбата, кмоль;
S— площадь адсорбента, м2.
Âслучае если площадь адсорбента измерить трудно, то площадь его поверхности заменяют его массой:
35

X , m
ãäå m — масса адсорбента, кг.
Применение
Сорбция применяется для очистки воды. Под сорбционной очисткой воды обычно понимают сорбцию (концентрирование) веществ на поверхности или в объеме пор твердого материала. Теоретически любое тело в пространстве ограничено поверхностью, и, следовательно, вещество его потенциально является сорбентом. Однако в практике очистки воды используются лишь сорбенты с развитой или специфической поверхностью естественного или искусственного происхождения, применение которых значительно эффективнее. Исторически применение сорбентов связано с микропористыми углеродными материалами — активными углями.
А. с. 24743. Двухфазное рабочее тело для компрессора теплосиловых установок, состоящее из газа и мелких частиц твердого тела, отли- чающееся тем, что с целью дополнительного сжатия газа в холодильнике и компрессоре и дополнительного расширения в нагревателе в качестве твердой фазы использованы сорбенты с общей или избирательной поглотительной способностью.
2.3.2. Диффузия
Входы: íåò.
Выходы: концентрация.
Графическая иллюстрация приведена на рис. 2.10.
Сущность
Если состав газовой смеси или жидкости не однороден, то тепловое движение молекул рано или поздно приводит к выравниванию концентрации каждого компонента во всем объеме. Такой процесс называется диффузией. При протекании процесса диффузии всегда имеются так называемые диффузионные потоки вещества, величина и скорость которых определяется свойствами среды и градиентов концентрации. Скорость диффузии в газах увеличивается с понижением давления и ростом температуры. Увеличение температуры вызывает ускорение диффузионных потоков в жидкостях и твердых телах. Кроме градиента концен-
36
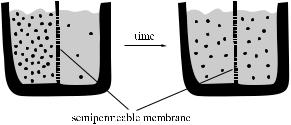
Рис. 2.10. Схема диффузии через полупроницаемую мембрану
трации, к возникновению диффузионных потоков приводит наличие температурных градиентов в веществе (термодиффузия). Перепад температур в однородной по составу смеси вызывает появление разности концентрации между областями с различной температурой, при этом в газах более легкий компонент газовой смеси скапливается в области с более низкой температурой. Таким образом, явление термодиффузии можно использовать для разделения газовых смесей; этот метод весьма ценен для разделения изотопов.
При диффузионном перемещении двух газов, находящихся при одинаковой температуре, наблюдается явление, обратное термодиффузии: в смеси возникает разность температур — эффект Дюфора. При диффузионном смешивании газов, составляющих воздух, возникающая разность температур составляет несколько градусов.
Явление диффузии молекул в струю пара лежит в основе работы диффузионных вакуумных насосов (пароструйные насосы); термодиффузия паров метилового спирта обеспечивает возможность надежной работы так называемых диффузионных камер — приборов для наблюдения ионизирующих частиц.
Диффузия в твердых сплавах со временем приводит к однородности сплава. Для ускорения диффузии применяется длительный нагрев сплава (отжиг); уничтожение внутренних напряжений при отжиге металла также есть следствие процессов диффузии и их ускорения при повышении температуры.
Создание больших концентраций газа на границе с металлом при создании условий, обеспечивающих некоторое «разрыхление» поверхностного слоя металла, приводит к диффузии газа внутрь металла; диффузия азота в металлы лежит в основе процесса азотирования. Диффузионное
37

насыщение поверхностных слоев металла различными элементами позволяет получать самые различные свойства поверхностей, необходимые в практике. Фактически процессы цементации, алитирования, фосфатирования есть процессы диффузии углерода, алюминия, фосфора внутрь структуры металла. Скорость диффузии при этом легко регулируется с помощью различных режимов термообработки.
Математическое описание
Уравнение диффузии (описывает распространение растворяемого вещества вследствие диффузии)
dC D d 2C , dt dx2
ãäå D — коэффициент диффузии; Ñ — концентрация;
t — время;
x — смещение.
Применение
А. с. 461774. Способ производства изделий из низкоуглеродистых сталей путем отжига заготовки и холодного выдавливания, отличающийся тем, что с целью улучшения условий выдавливания перед отжигом заготовку подвергают термодиффузионной обработке, преимущественно цементации.
2.3.3. Осмос
Входы: концентрация. Выходы: давление.
Графическая иллюстрация приведена на рис. 2.11.
Сущность
Осмос — самопроизвольный переход вещества через полупроницаемую перегородку (мембрану), разделяющую два раствора различной концентрации или раствор и чистый растворитель. Осмос приближает систему к равновесию путем выравнивания концентраций по обе стороны перегородки.
Наиболее важный случай осмоса — переход молекул чистого растворителя в раствор через полупроницаемую мембрану, не пропускаю-
38

щую молекулы растворенного вещества (см. рис. 2.11). В этом слу- чае происходит переход молекул из чистого растворителя в раствор, концентрация которого при этом понижается. В общем случае двух
растворов А и В разной концентрации (концентрация раствора А
больше, чем В) возникает поток вещества от А к В. Этот поток можно предотвратить, если повы-
сить давление в растворе В, при- чем разность давлений по обе стороны перегородки при этих условиях называется осмотическим давлением, а достигнутое термодинамическое равновесие — осмотическим равновесием. Электро-
осмос (электроэндоосмос) — движение жидкостей или газов через капилляры, твердые пористые диафрагмы и мембраны, а также через слои очень мелких частиц под действием внешнего электрического поля.
Осмос можно усилить (или ослабить), применяя электрические поля.
Математическое описание
V RT ln(1 x),
где — осмотическое давление;
V — молярный объем растворителя;
R — универсальная газовая постоянная; T — температура;
õ — молярная доля растворенного вещества. Уравнение состояния Вант — Гоффа:
– для разбавленных растворов неэлектролитовcRT ,
ãäå ñ — молярность раствора;
– для разбавленных растворов электролитов
39
icRT ,
ãäå i — коэффициент Вант — Гоффа, i 1 (v 1);— степень диссоциации;
v — число ионов, на которое распадается молекула электролита.
Применение
Осмос (электроосмос) применяется для очистки коллоидных растворов от примесей, для очистки глицерина, сахарных сиропов, воды, при дублении кожи, а также при окраске некоторых материалов.
A. c. 240825. Способ сушки изоляции кабелей в шахтах электросетях с изолированной нейтралью отличается тем, что с целью упрощения процесса токоведущие жилы кабелей подсоединяют к положительному полюсу источника постоянного тока, отрицательный полюс которого соединяют с землей для осуществления сушки за счет использования явления электроосмоса.
2.3.4. Цеолиты |
|
Входы: íåò. |
|
Выходы: цвет, адсорбционные свойства. |
|
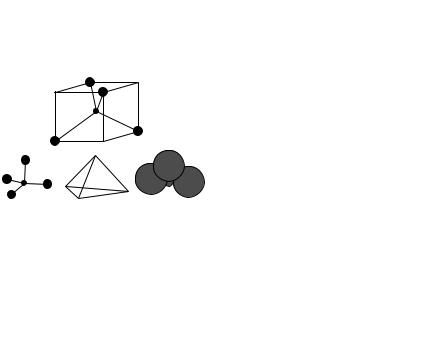
Графическая иллюстрация приведена на рис. 2.12. |
|
|
Сущность |
|
Цеолиты — вещества, способ- |
|
ные менять свои свойства (цвет, |
|
адсорбционная способность и др.) |
|
под действием других веществ или |
|
в результате изменения внешних |
|
условий. |
Рис. 2.12. Структура кристалла цеолита |
Цеолиты являются кристалли- |
|
|
|
ческими водными алюмосиликата- |
|
ми, они относятся к группе каркас- |
ных алюмосиликатов. Каркасы цеолитов (см. рис. 2.12) содержат каналы |
|
и сообщающиеся между собой полости, в которых находятся ионы и мо- |
|
лекулы воды. Катионы довольно подвижны и обычно могут в той или |
|
иной степени обмениваться на другие катионы. Чистые цеолиты бес- |
|
цветны. Если катионы щелочных или щелочно-земельных металлов, |
|
обычно присутствующие в синтетических цеолитах, обменять на ионы |
|
40
