
479
.pdf
2.2.2. Варочная кислота и графики варки целлюлозы
Для сульфитной варки целлюлозы применяется сульфитная варочная кислота, для характеристики которой используются следующие термины:
Состав варочной кислоты: 5…10 % всего SO2, 0,8…1,3 % связанного SO2.
Варочный раствор для бисульфитной варки отличается от сульфитной варочной кислоты тем, что в нем нет растворенного SO2 (при рН 4,5). На практике рН варочного раствора колеблется от 3,5
до 5,0.
Состав варочного раствора для бисульфитной варки в зависимости от рН представлен ниже:
Величина рН |
3,5…4,0 |
4,5 |
5,0 |
|
|
|
|
Состав |
NaHSO3 + SO2 |
NaHSO3 |
NaHSO3 + Na2SO3 |
варочного |
|||
раствора |
|
|
|
|
|
|
31 |
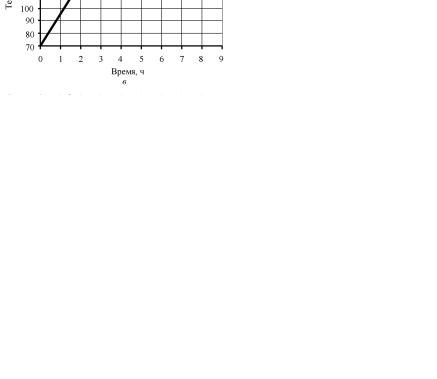
Рис. 7. Графики варки: а – сульфитной целлюлозы; б – бисульфитной целлюлозы при pH варочного раствора 3,5…4,0; в – бисульфитной целлюлозы при pH варочного раствора 4,5…5,0
Варка сульфитной и бисульфитной целлюлозы проводится по определенному режиму, для характеристики которого используется график, изображаемый в координатах «время – температура» (рис. 7).
2.2.3. Химические процессы при сульфитной варке
При нагревании древесной щепы с сульфитной кислотой происходят реакции с лигнином (сульфонирование, гидролитическая деструкция, сульфитолиз, кислотная конденсация) и углеводами (гидролиз, окисление). Эти основные реакции сопровождаются многочис-
32
ленными побочными окислительно-восстановительными реакциями бисульфита и сернистой кислоты, в результате которых образуются серная кислота, тиосульфаты, политионаты. При побочных реакциях варки образуются следующие продукты: цимол (за счет окисления терпенов), уксусная и муравьиная кислоты (в результате отщепления ацетильных и формильных групп), метиловый спирт (за счет отщепления метоксильных групп лигнина), углекислый газ, фурфурол и др.
Сульфонирование – реакция присоединения к лигнину ионов бисульфита с образованием лигносульфоновых кислот, в которых шестивалентная сера прочно связана с органическим веществом. Реакция сульфонирования лигнина может идти в кислой, нейтральной
ищелочной средах. В кислой среде (в условиях обычной сульфитной варки при рН варочного раствора 1,5...2,5) процесс сульфонирования лигнина идет значительно быстрее, чем при варке при той же температуре, но с высоким значением рН рабочего раствора (например, при бисульфитной варке (рН 4...5) и при нейтрально-сульфитной (рН около 9)).
На основании изучения кинетики сульфонирования в кислой
инейтральной средах сульфонирующиеся группы лигнина разделены на два типа – А и В, различающиеся реакционной способностью.
Группы А разделены на группы X и Z, на долю которых приходится приблизительно по 15 % общего количества сульфонирующихся групп. Группы X в основном представляют собой группировки бензилового спирта или его эфира со свободным гидроксилом в п-по- ложении. Группы Z – это группировки бензилового спирта с этерифицированным фенольным гидроксилом. Группы X и Z сульфонируются на первой стадии варки с образованием твердой лигносульфоновой кислоты по схеме, представленной на рис. 8.
Сульфирование групп А начинается с заметной скоростью при температуре около 80 °С и любом значении рН (1...9).
33
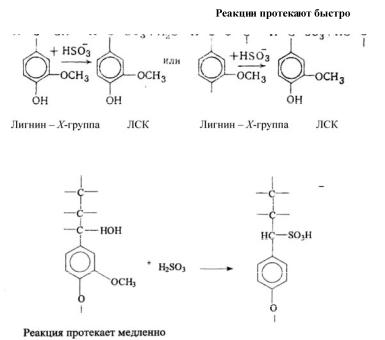
Рис. 8. Реакция сульфонирования лигнина (группа А)
На долю групп В приходится около 70 % всех сульфонирующихся групп лигнина. Группы В сульфонируются в кислой среде. При рН больше 3,5 они совсем не реагируют с компонентами сульфитной кислоты или реагируют очень медленно. При их сульфонировании вводится до 0,7 атомов S на фенилпропановую единицу. Группы В представляют собой группировку бензилового эфира с замещенным фенольным гидроксилом и эфирной связью в β-поло- жении. В результате кислотного гидролиза группы В превращаются в группы В′ (рис. 9), которые способны сульфонироваться в нейтральном растворе, но из-за наличия заместителя в β-положении группы В' менее реакционно-способны, чем группы Z. Таким образом, группа В сульфонируется в период варки по предполагаемой схеме
(см. рис. 9)
34

Рис. 9. Реакция сульфонирования лигнина (группа В)
Вкислой среде (при рН меньше 3,5) группы А легче реагируют
сфенолами, чем сульфируются. В нейтральной и слабощелочной средахчастьгруппА сульфируетсябыстро, а другая часть– медленно.
Сульфирование придает лигнину гидрофильные свойства и предохраняет его в условиях варки от конденсации. Реакция сульфирования лигнина наиболее быстро протекает в кислой среде, при этом увеличивается опасность конденсации.
Природный лигнин очень реакционно-способен и при известных условиях способен инактивироваться, в связи с чем резко снижается его способность сульфироваться и растворяться при варке. Поэтому сульфирование лигнина в процессе варки целлюлозы должно проводиться в условиях, исключающих заметную конденсацию. На практике такие условия создаются применением определенного температурного режима варки, включающего, как правило, операцию пропитки и наличие основания в варочной кислоте.
Реакция сульфирования лигнина начинается при температуре 50...70 °С и с повышением температуры резко возрастает. Вначале образуются неустойчивые соединения серы с лигнином, которые при дальнейшем сульфировании превращаются в устойчивые сульфокислоты.
35
Поскольку при производстве целлюлозы реакция сульфирования лигнина начинается в гетерогенной среде, важной технологической операцией является пропитка растительного сырья варочным раствором.
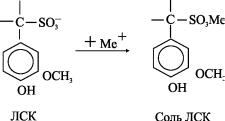
Вначале образуется твердая лигносульфоновая кислота, которая по своей активности не уступает серной кислоте, и поэтому под ее воздействием возможна конденсация молекул лигнина. Для предотвращения конденсации на первой стадии варки в сульфитную варочную кислоту вводят основание, главная роль которого заключается в нейтрализации образовавшейся лигносульфоновой кислоты. Поскольку катионы основания проникают в толщу растительной ткани (щепы) значительно медленнее, чем SO2, то для предотвращения конденсации лигнина под действием сернистой кислоты и образовавшейся лигносульфоновой кислоты пропитку проводят при температуре 105...110 °С в течение определенного времени. Таким образом, на стадии пропитки при сульфитной варке происходит не только физический процесс проникновения варочного раствора в щепу и диффузия его в растительные ткани, но и процесс сульфирования лигнина с образованием твердой лигносульфоновой кислоты и лигносульфонатов.
Нейтрализация ЛСК катионами основания протекает следующим образом:
Гидролитическое расщепление макромолекул лигнина на мелкие фрагменты, способные переходить в раствор:
36
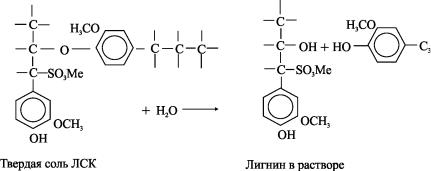
После введения в лигнин более 3,5 % серы он становится относительно устойчивым к процессам конденсации, роль катионов основания в этом процессе снижается и возможно дальнейшее повышение температуры без опасности конденсации лигнина. При дальнейшем повышении температуры под действием возрастающей активности варочного раствора происходит дальнейшее сульфирование лигнина, приводящее его к неограниченному набуханию и растворению.
Поскольку лигносульфоновая кислота обладает катионообменными свойствами и растворяется значительно лучше, чем ее соли, то в условиях варки возможна реакция
RSO3Na + H+ ↔ RSO3H + Na+.
С уменьшением количества катионов основания в варочном растворе растворимость лигнина увеличивается. Следовательно, на первой стадии варки, т.е. при пропитке, основание играет положительную роль, предохраняя лигнин от конденсации, а на второй стадии – отрицательную, так как тормозит его растворение и способствует протеканию ряда побочных реакций. Поэтому в последнее время появились ступенчатые варианты сульфитной варки с применением на конечной стадии варки водных растворов SO2.
Основной реакцией углеводов при сульфитной варке является гидролитическое расщепление легкогидролизуемых полисахаридов с образованием простых сахаров и промежуточных продуктов гидро-
37

лиза. При мягких условиях варки целлюлоза получается жесткой, а в отработанном щелоке будет содержаться большое количество олигосахаров. Гидролиз полисахаридов протекает по следующим уравнениям:
(C6H10O5)n + nH2O → nC6H12O6
гексозаны |
гексозы |
галактаны |
галактоза |
маннан |
манноза |
глюкан |
глюкоза; |
(C6H8O4)n + nH2O → nC5H10O5
пентозаны |
пентозы |
ксилан |
ксилоза |
арабан |
арабиноза |
Под действием ионов бисульфита часть сахаров окисляется до альдоновых кислот:
2HSO3– + 2C6H12O6 → S2O32– + 2C6H12O7 + H2O.
Также под действием ионов бисульфита часть сахаров превращается в альдегид-бисульфитные соединения с непрочно связанной серой:
Вобразовании соединений с легко отщепляемым SO2 принимают участие альдегидные группы не только сахаров и продуктов их распада (формальдегида, метилглиоксаля, фурфурола), но и лигнина.
Общий расход SO2 на химические реакции сульфитной варки составляет 7...9 % от массы сырья.
Впоследнее время появились различные модификации сульфитной варки, которые позволяют получить целлюлозу различного назначения с высокими показателями качества.
38
2.2.4.Получение сульфитной целлюлозы
влабораторных условиях
Подготовка щепы и варочной кислоты. Лабораторные автокла-
вы кафедры рассчитаны на загрузку 250 и 500 г абсолютно сухой щепы. Расчет потребного для варки количества щепы производится с учетом ее влажности. Влажность щепы определяют электронным влагомером ЭВ-2К, руководствуясь прилагаемой инструкцией.
Для варки целлюлозы может быть использована кислота на кальциевом, магниевом, натриевом или аммониевом основаниях, а также кислота смешанного основания. Состав варочной кислоты:
Са(HSO3)2 + SO2 + H2O (для кальциевого основания);
NаHSO3 + SO2 + H2O (для натриевого основания);
Mg(HSO3)2 + NаHSO3 + SO2 + H2O (для магниево-натриевого основания) и т.д.
Подготовка варочной кислоты складывается из приготовления абсорбента и насыщения его SO2 (из баллона с жидким SO2). Для получения абсорбента применяют жженую известь, NaOH или Na2CO3, NH4OH.
Потребное количество указанных реагентов определяется расчетом в соответствии с составом и объемом кислоты (указываются руководителем в соответствии с поставленной задачей).
Например, для приготовления 2 л кислоты составом 8 % всего SO2 и 1,2 % Na2O надо взять
2000 1,2 24 ã Na2O или 24 · 1,29 = 31 г NaOH. 100
Водный раствор NaOH готовят из концентрированного 40%-но- го раствора. Концентрацию приготовленного раствора проверяют титрованием соляной кислотой. На титрование берут 5…10 мл раствора NaOH, добавляют 2…3 капли метилоранжа и титруют 1 н. раствором HCl.
Приготовив раствор основания заданной концентрации, производят насыщение его SO2. В готовой кислоте определяют содержание всего SO2, свободного SO2, связанного SO2 и основания.
39
2.2.4.1. Анализ кислоты
Определение содержания всего SO2 в кислоте. Наибольшее распространение получил йодометрический метод определения всего SO2 в кислоте. Метод основан на способности йода окислять в водных растворах любой сернистый ангидрид в серную кислоту по реакции
SO2 + I2 + 2H2O = H2SO4 + 2HI.
В коническую колбу наливают 100 мл дистиллированной воды, несколько капель 0,2%-ного раствора крахмала и 1 мл анализируемой кислоты (при этом кончик пипетки с кислотой погружают в жидкость) и титруют 0,1 н. раствором йода до появления неисчезающего синего окрашивания. 1 мл 0,1 н. раствора йода соответствует 0,0032 г SO2.
Содержание всего SO2 в кислоте равно 0,0032а · 100 %, где а – объем 0,1 н. раствора йода, пошедшего на титрование, мл.
Определение содержания связанного SO2 в кислоте и основа-
нии. Метод основан на способности серной кислоты взаимодействовать с бисульфитами по реакциям
Ca (HSO3)2 + H2SO4 = CaSO4 + 2SO2 + 2H2O,
2NaHSO3 + H2SO4 = Na2SO4 + 2SO2 + 2H2O.
Количество связанного SO2 определяется по количеству израсходованной на реакцию с бисульфитом кислоты.
Вконическую колбу наливают 100 мл дистиллированной воды
иточно 10 мл 0,1 н. раствора серной кислоты. Нагревают до кипения
ивносят точно 1 мл исследуемой кислоты (конец пипетки погружают в кипящую жидкость, другой конец закрывают слегка пальцем во избежание выбрасывания кислоты). Полученный раствор кипятят
10 мин до полного удаления растворенного SO2 и SO2, выделившегося в результате взаимодействия серной кислоты и гидросульфита. Содержимое колбы быстро охлаждают, добавляют 2–3 капли метилового красного и титруют 0,1 н. раствором NaOH до перехода крас-
ного цвета раствора в желтый. 1 мл 0,1 н. раствора H2SO4 соответствует 0,0032 г связанного SO2.
40
