
Принципы и основные методы генетической инженерии. (110
.pdfАнализ проводят следующим образом (рис. 8).
–Выделенную, очищенную, денатурированную и разбитую на фрагменты ДНК помещают на лист агарозного геля, где происходит электрофоретическое разделение фрагментов по массе и заряду.
–Лист агарозного геля, где произошло электрофоретическое фракционирование смеси фрагментов ДНК по массе и заряду, помещают на фильтровальную бумагу, смоченную концентрированным солевым (буферным) раствором.
–Затем на гель накладывают нитроцеллюлозный фильтр, где происходит иммобилизация (или адсорбция, или фиксация) одноцепочечных фрагментов ДНК.
–Поверх фильтра накладывают стопку листов сухой фильтровальной бумаги, которая обеспечивает медленный ток буферного раствора через гель (т.е. служит своеобразным капиллярным насосом). Солевой раствор, проходя через агарозный гель, увлекает за собой фрагменты ДНК, которые задерживаются нитроцеллюлозой и связываются с ней, а раствор впитывается сухой фильтровальной бумагой.
–Далее ДНК денатурируют щелочью, а фильтр выдерживают в вакууме при температуре 80 0С, в результате чего одноцепочечные фрагменты ДНК необратимо иммобилизуются (фиксируются) на нитроцеллюлозе. При этом расположение полос иммобилизованной ДНК точно соответствует их расположению в геле.
–ДНК, связанную с фильтром, помещают в раствор с меченым ДНК зондом, в котором и происходит гибридизация. Гибридизироваться (образовывать водородные связи) со специфическим зондом будут только комплементарные ему фрагменты ДНК, которые можно обнаружить в виде светлых полос на рентгеновской пленке, т.е. радиоавтографии нитроцеллюлозного фильтра (рис. 8).
Дот-блоттинг. Для приготовления дот-блоттов препарат ДНК или РНК наносят непосредственно на фильтр. Капельки препарата выглядят в виде точек на фильтре, что объясняет название типа блоттинга (англ. dot – точка). Из геномной ДНК, предварительно обработанной ультразвуком, образуются фрагменты длиной 5–10 пар нуклеотидов. Чтобы сделать ДНКили РНКпробы доступными зонду, их нужно денатурировать, т.е. перевести в одноцепочечную форму. Это происходит под воздействием температу-
ры 100 °С. Затем денатурированные нуклеиновые кислоты инкубируют на льду: быстрое понижение температуры предотвращает их ренатурацию, т.е. комплементарное спаривание цепей. Денатурированную ДНК или РНК наносят непосредственно на фильтр, который инкубируют в растворе, содержащем зонд. Чтобы анализируемая нуклеиновая кислота не перешла в раствор, ее необходимо зафиксировать на фильтре (мембране). Для этого используют два типа фильтров: нитроцеллюлозный и нейлоновый. Для иммо-
21
билизации нуклеиновых кислот на нитроцеллюлозном фильтре используют прожаривание при 80 °С в вакууме, а на нейлоновом фильтре – УФ-об- лучение в течение 3–5 минут.
После инкубации препарата нуклеиновых кислот с меченым изотопом зондом проводят радиоавтографию в специальной кассете или идентификацию нерадиоактивными методами.
Дот-блоттинг позволяет ответить только на один вопрос: есть ли в данном образце искомая последовательность нуклеотидов.
Для выделения и анализа РНК (например, для выяснения того, присутствует ли в данном типе клеток мРНК, считанные с данного гена, т.е. экспрессируется ген или нет; для определения количества этой РНК и его изменения в развитии данного типа клеток; для определения размера транскрипта какого-то гена и др.) применяется Нозерн-блот анализ. В данном случае молекулы РНК, выделенные из клетки, разделяются по размерам с помощью гель-электрофореза, а затем переносятся на фильтр. После гибридизации с меченым одноцепочечным зондом выявляются места гибридизации (гомологии) РНК и зонда.
Если нуклеотидная последовательность искомого гена (или мРНК) не известна, но известен белок, синтез которого он контролирует, то можно выделить небольшое количество чистого белка, определить аминокислотную последовательность некоторой его части (достаточно знание 5–6 аминокислотных остатков). Пользуясь таблицей генетического кода, можно установить все возможные последовательности нуклеотидов в том участке мРНК (или самого гена), который кодирует данную аминокислотную последовательность. В этом случае можно синтезировать зонд для поиска нужных клонов в библиотеке генов.
Вестерн-блоттинг (иммуноэлектроблоттинг, белковый блоттинг) – это метод идентификации уникальных белков. Аналогично рассмотренной ранее технике Саузерн- и Нозерн-блот-гибридизации нуклеиновых кислот в его основе лежит явление высокоспецифичного взаимодействия антиген– антитело. Таким образом, антигеном (мишенью) является определяемый белок, а зондом – антитело к нему.
Антитела к исследуемому белку получают различными способами. Наиболее простым является введение очищенной пробы белка в кровяное русло лабораторного животного (обычно кролика). В его организме вырабатываются антитела (иммуноглобулины, Ig) к данному чужеродному белку. Это первичные антитела, которые и будут взаимодействовать с белкоммишенью. Однако было бы не рационально вводить метку для идентификации непосредственно в данные антитела. Для определения разных белков потребовалось бы метить разные антитела, что привело бы к их высокой стоимости. Более разумным оказалось использование универсальных антител – конъюгированных антииммуноглобулинов, являющихся, по сути, ан-
22
тителами к антителам, выработанным при использовании идентифицируемого белка как антигена. К примеру, конъюгированные антииммуноглобулины к Ig кролика будут взаимодействовать со всеми иммуноглобулинами, синтезированными у кролика к разным антигенам. Таким образом, именно такие универсальные вторичные антитела несут изотопную или нерадиоактивную метку. Кроме неизотопной метки, которая в ходе ряда реакций приводит к образованию нерастворимого окрашенного соединения (как в случае блоттинга нуклеиновых кислот), очень часто используют хемилюминесцентную метку, обладающую более высокой чувствительностью.
Предположим, что нам нужно определить наличие некоторого белка в ткани (органе) методом Вестерн-блоттинга. Первым этапом после экстракции белков из гомогената является разделение их по молекулярным массам
спомощью SDS-электрофореза в полиакриламидном геле (ПААГ). Метод SDS-электрофореза подразумевает денатурацию нативных белков. Таким образом, молекулы белка, обладающие одинаковой молекулярной массой, пройдут в геле одинаковый путь и выстроятся в виде полосы. Поскольку в смеси присутствуют белковые молекулы разного размера, образуется множество полос. Визуализировать результаты электрофореза можно окрашиванием белка (кумасси бриллиантовый синий, амидо черный, окрашивание серебром). Окрашивание серебром обладает уникальной чувствительностью, что позволяет определить всего 0,1 нг белка в полученной полосе. Это очень важно для контроля количества белка, нанесенного на гель.
Вторым этапом белкового блоттинга является перенос белков из геля на мембрану. Это делается потому, что полиакриламид не позволяет диффундировать большим молекулам иммуноглобулинов к белку. А иммобилизованный на мембране белок становится доступным антителам. В отличие от блоттинга нуклеиновых кислот перенос белка на мембрану происходит под воздействием электрических сил, т.е. в электрическом поле.
Наконец, полученный блот инкубируют с антисывороткой к белку, а затем с антииммуноглобулинами. Результат визуализируют в соответствии
сиспользуемым типом метки.
Кроме идентификации белков, некоторая модификация Вестернблоттинга позволяет устанавливать белок-белковые взаимодействия в клетке. В этом случае зондом является не антитело, а один из взаимодействующих белков.
В наших экспериментах проводилась идентификация белка альтернативной оксидазы в митохондриях различных растений. Для разделения белков использовался 12,5 % SDS-ПААГ. Для идентификации альтернативной оксидазы применялись антитела на данный белок из S.glutatium, полученные при иммунизации кролика. Для визуализации комплекса антителоальтернативная оксидаза применяли конъюгат антител против антител кролика с щелочной фосфатазой, который обеспечивал флуоресцентное прояв-
23
ление. Результаты экспериментов приведены на рис. 3 Установлено, что стрессовые условия могут значительно изменять содержание альтернативной оксидазы в митохондриях. Так, для цветной капусты наиболее существенная индукция наблюдалась при инкубации растений в атмосфере с повышенным содержанием кислорода, а в митохондриях зеленого перца максимальное количество альтернативной оксидазы обнаруживалось при инкубации растений при пониженной температуре.
4. АМПЛИКАЦИЯ ФРАГМЕНТОВ ДНК С ПОМОЩЬЮ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР)
4.1. Принципы метода ПЦР
Техника амплификации фрагментов ДНК с помощью полимеразной цепной реакции (ПЦР – PCR – polymerase chain reaction), которая револю-
ционизировала существующие методы молекулярного анализа геномов, была предложена в 1985 г. Кэри Мюллисом, за ее разработку в 1993 г. ему была присуждена Нобелевская премия. Полимеразная цепная реакция имитирует природный процесс воспроизведения (удвоения) ДНК – репликацию, происходящую на матричной основе (по принципу комплементарности) с участием фермента ДНК-полимеразы. Но если во время репликации удваивается вся ДНК, то при ПЦР происходит многократное копирование (воспроизведение, амплификация) лишь интересующего исследователя специфического небольшого фрагмента, расположенного между двумя праймерами.
Комплементарное достраивание нитей начинается в определенных стартовых точках, положение которых определяется затравками (праймерами). Праймеры – синтетические олигонуклеотиды, включающие около 20 нуклеотидов, каждый из которых комплементарен и будет гибридизироваться с одной из двух цепей на противоположных концах подлежащего амплификации фрагмента ДНК. Праймеры ориентированы таким образом, что синтез ДНК происходит только между ними, т.к. затравки комплементарны последовательностям ДНК на левой и правой границе амплифицируемого фрагмента. 3’-концы праймеров направлены навстречу друг другу на амплифицируемый участок (ДНК-мишень). То есть праймеры как бы «запирают» с двух сторон фрагмент, который должен быть многократно удвоен (рис. 9).
Открытие термостабильной ДНК-полимеразы (Taq – полимеразы) у обитающих в горячих источниках бактерий Thermis aquaticus, позволили сделать процесс амплификации ДНК циклическим и использовать его для работы in vitro. Этот процесс автоматизирован и осуществляется с помощью специального прибора (термоциклера = амплификатора), который по
24
заданной экспериментатором программе проводит серию многократно повторяющихся циклов (20–30 циклов) и осуществляет быструю смену температур.
Каждый цикл ПЦР включает три кратковременных этапа, протекающих в различных температурных режимах (рис. 9).
1этап. Денатурация ДНК. Кратковременное нагревание нативной ДНК приводит к изменению ее физико-химических свойств, в частности, вязкости, происходит разрушение водородных связей, соединяющих комплементарные цепи, и разъединение цепей исходной молекулы ДНК. В та-
ком состоянии каждая цепочка может служить матрицей для репликации. Протекает при 93–95 0С в течение 30–40 с.
2этап. Присоединение праймеров (отжиг) при охлаждении реакци-
онной смеси. Присоединение праймеров происходит комплементарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. Для каждой пары праймеров существует
своя температура отжига, значения которой располагаются в интервале 50–65 0С. Время отжига 20–60 с.
3этап. Синтез ДНК (элонгация). С участием термостабильной ДНКполимеразы (Taq-полимераза) происходит избирательный синтез (копирование) участка ДНК, расположенного между двумя праймерами. Амплификация происходит в том случае, если расстояние между праймерами находится в пределах 50–4000 оснований. Синтез ДНК идет от 5’ к 3’-ему концу
вобоих направлениях, начиная с участков присоединения праймеров. То есть наращивание праймеров происходит навстречу друг другу. Материалом для синтеза новых цепей ДНК служит добавляемая в буферный раствор смесь
четырех дезоксирибонуклеотидтрифосфатов (дНТФ). Процесс происходит при температуре 70–72 0С. Время протекания синтеза – 20–40 с. (рис. 9).
25
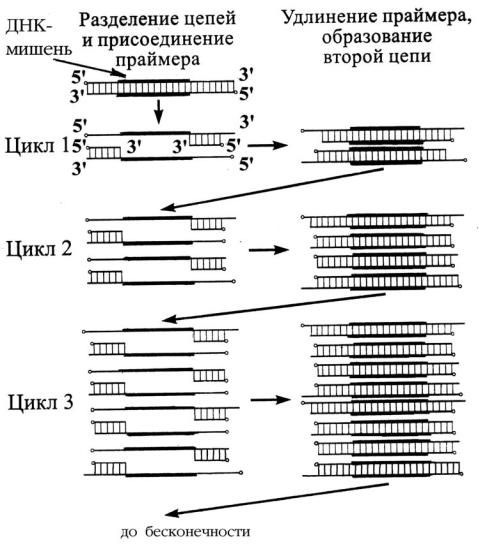
Рис. 9. Схема полимеразной цепной реакции
Раствор с полученными копиями ДНК снова подогревают для начала нового цикла амплификации, при котором только что синтезированные фрагменты ДНК (ампликоны) служат матрицей для синтеза новых цепей. То есть в каждом цикле число амплифицируемых фрагментов ДНК удваивается. Общее их количество может быть вычислено по формуле 2n, где n – число циклов амплификации. Поэтому, даже если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30–40 циклов амплификации синтезируется около 1 млрд (108) копий фрагментов (ампликонов), что по времени занимает 3–4 ч. То есть используя очень небольшое, следовое количество матричной ДНК (несколько нанограммов), можно получить миллионы копий необходимой ДНК, что делает возможным визуальный учет результатов после гель-электрофореза и не требует гибридизации с радиоактивным зондом.
26
4.2. Визуализация и учет результатов реакции
После окончания ПЦР для учета ее результатов используют агарозный гель-электрофорез ДНК. Готовят пластину агарозного геля, представляющего собой застывшую после расплавления в электрофорезном буфере агарозу в концентрации 1,5–2,5 %, со специальными лунками, в которые вносят продукты амплификации. При электрофорезе скорость миграции ДНК через агарозный гель определяется пятью главными параметрами.
Размер молекул ДНК. Молекулы линейной двуцепочечной ДНК перемещаются в геле предположительно одним концом вперед со скоростью, обратно пропорциональной десятичному логарифму их молекулярных масс.
Концентрация агарозы. Фрагменты ДНК данного размера перемещаются в геле, содержащем разные концентрации агарозы, с разными скоростями. Чем больше концентрация агарозы, тем выше сопротивление, действующее на ДНК со стороны геля и, следовательно, меньше путь, который пройдет в нем нуклеиновая кислота. Таким образом, применяя гели разных концентраций, можно разделить большой набор различающихся по размеру фрагментов ДНК.
Конформация ДНК. ДНК, имеющие одинаковую молекулярную массу, но разные конформации (линейная, кольцевая и т.д.), движутся с разными скоростями.
Напряженность электрического поля. При низких значениях напря-
женности скорость перемещения фрагментов линейной ДНК пропорциональна величине напряженности электрического поля. Однако с увеличением напряженности электрического поля подвижность фрагментов ДНК с высокой молекулярной массой возрастает. А следовательно, эффективность разделения ДНК снижается. Максимальное разделение фрагментов происходит при значениях напряженности, не превышающих 5 В/см.
Температура. Обычно электрофорез в агарозных гелях ведут при комнатной температуре. Однако гели, содержащие менее 0,5 % агарозы, очень мягкие, поэтому с ними лучше работать при 4 0С.
При прочих равных условиях расстояние в геле, пройденное более длинной молекулой ДНК, будет меньше, чем путь более короткой ДНК. Визуализация результатов ПЦР основана на принципе этого метода: в ходе амплификации образуется огромное количество (миллионы, миллиарды) фрагментов ДНК одинаковой длины. Следовательно, в электрическом поле они пройдут одинаковый путь и выстроятся в одну полосу.
Наиболее удобный метод визуализации ДНК в агарозных гелях – окрашивание ее флюоресцирующим красителем бромистым этидием, который обычно добавляют непосредственно в гель. Молекула этого вещества содержит плоскую группу, которая интеркалирует между соседними основаниями ДНК. В результате такой интеркаляции в непосредственной близости от оснований краситель связывается с ДНК, что сопровождается увеличе-
27
нием интенсивности флюоресценции. УФ-излучение, поглощаемое ДНК в области 260 нм и передаваемое на краситель (или же излучение, поглощаемое самим красителем при длинах волн 300 и 360 нм), испускается затем в красно-оранжевой области видимого спектра (590 нм).
После окончания электрофореза, продолжающегося от 10 мин до 1 ч гелевую пластину помещают на фильтр трансиллюминатора, излучающий свет в УФ-диапазоне. В случае успешно прошедшей ПЦР на геле видны полосы продуктов амплификации. Яркость полос может быть различной. Поэтому часто в ПЦР-лабораториях принято оценивать результат по трех-, четырехили пятибальной системе. Если же амплификация в силу каких-либо причин не произошла, флюоресцирующие полосы на геле отсутствуют.
4.3. Полимеразная цепная реакция в реальном времени
Наиболее современный метод детекции основан на накоплении в результате амплификации флюоресцентного продукта. Как правило, флюоресцентно меченный зонд добавляется к смеси нуклеотидов или используются флюоресцентные производные нуклеотидтрифосфатов. Накопление длинноцепочечных продуктов амплификации приводит к интеркаляции зондов и росту интенсивности флюоресценции. Амплификатор оснащается системой детекции флюореценции и позволяет отслеживать ее изменение при каждом цикле амплификации. Специальное программное обеспечение позволяет отслеживать, на каком цикле достигается некий контрольный уровень флюореценции, и рассчитывать количество исходных копий гена в пробе. Данный метод широко используется для количественного определения концентрации мРНК для различных генов.
5. ОБЛАСТИ ПРИМЕНЕНИЯ И ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ПЦР
5.1. Диагностические технологии на базе ПЦР
Метод ПЦР вряд ли мог получить столь широкое распространение, если бы не его уникальная чувствительность, позволяющая найти всего одну определенную молекулу ДНК из миллионов других. На этой сверхчувствительности основаны главные диагностические технологии ПЦР. ПЦР позволяет амплифицировать любые интересующие участки генома (длиной до 4 тыс. пн) с использованием специфичных или произвольных (случайных) праймеров. ПЦР-маркеры различаются длиной амплифицированной последовательности. Для определения размера полученных ПЦР-фрагментов (ПЦР-продуктов) их разделяют с помощью гель-электрофореза.
О полиморфизме ДНК организмов судят по присутствию или отсутствию полосы в каждом паттерне (рисунке расположения полос) при элек-
28
трофоретическом разделении фрагментов ДНК, их окраске и фотографировании в УФ свете. Такие различия в паттерне могут быть связаны с делециями или инсерциями в амплифицируемом фрагменте.
Благодаря большой информативности и экономичности, возможности достаточно быстрого изучения многочисленных выборок и локусов (100–1000 локусов против 10–20 локусов аллозимов) метод ПЦР-анализа с применением различных молекулярных ДНК-маркеров в настоящее время широко используются в генетических исследованиях. Метод ПЦР лежит в основе картирования различных геномов, ДНК-идентификации личности, установления родства людей, в судебной медицине (поскольку позволяет проводить генетическую «дактилоскопию» по одной единственной клетке, диагностики наследственных (выявление мутантных генов), а также инфекционных заболеваний бактериальной и вирусной природы (обнаружение генетического материала патогенных микроорганизмов в клинических образцах).
Например, данный метод используется для диагностики бессимптомного носительства возбудителей инфекционного заболевания – вируса иммунодефицита человека (ВИЧ), которые в латентной стадии инфекции могут присутствовать в организме человека лишь в небольшом числе копий. Другой пример: С.А. Булатом (одним из первых применивших в нашей стране метод ПЦР для идентификации грибов и анализа их генетической изменчивости) были сконструированы геноспецифичные праймеры (обозначенные как Cs5), амплифицирующие только фрагменты ДНК, специфичные для патогенного гриба ячменя и пшеницы Cochliobolus sativus, что позволяет выявлять устойчивые к данному грибу растения (рис. 10).
В зависимости от природы праймера (специфичный, полуспецифичный, произвольный = случайный) и способа идентификации продуктов амплификации различают несколько методов и маркеров ПЦР-анализа. Остановимся на молекулярных маркерах, которые наиболее широко используются для выявления генетического полиморфизма и картирования генома животных, человека, растений и микроорганизмов.
К числу таких маркеров, основанных на ПЦР, относятся RAPDмаркеры и микросателлиты.
RAPD-маркеры – random amplified polymorphic DNA (RAPD-PCR –
случайно амплифицированная полиморфная ДНК).
При необходимости амплификации гена или фрагмента ДНК с известной нуклеотидной последовательностью используют два геноспецифичных праймера, фланкирующих (ограничивающих) нужную последовательность. В этом случае прямой праймер соответствует по нуклеотидной последовательности началу нужного гена, а обратный комплементарен второй цепи в конце этого гена. Таким образом можно исследовать полиморфизм конкретных локусов, для которых хотя бы частично известна нуклеотидная последовательность.
29
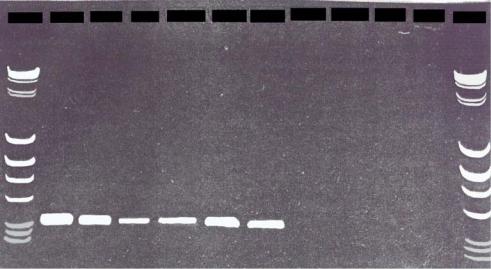
Рис. 10. Иллюстрация применения ПЦР-анализа со специфичными праймерами для диагностики патогенного для ячменя и пшеницы гриба
Cochliobolus sativus.
Амплифицированный фрагмент строго специфичен для C. sativus. Шесть первых дорожек – в исследуемых образцах присутствует ДНК патогена, четыре пустых дорожки – устойчивые к данному патогену растения. По краям (М) – маркер молекулярных масс (электрофорез маркерных макромолекул с известными молекулярными массами: ДНК фага лямбда,
расщепленная Hind III, и ДНК плазмиды pBR322, расщепленная Alu I)
Методика ПЦР позволяет амплифицировать ДНК из любого участка генома, в том числе фрагменты ДНК с неизвестной (анонимной) нуклеотидной последовательностью (при использовании RAPD-маркеров). При RAPD-методе используют стандартные наборы праймеров – случайные (произвольные) праймеры. Использование олигонуклеотидных праймеров произвольной структуры основано на том, что в больших геномах для них имеются множественные сайты посадки, а следовательно, и инициации ПЦР. В этом случае используется, как правило, только один праймер и амплифицируются участки между этим праймером и его обратной (инвертированной) последовательностью. Праймер связывается с геномной ДНК в двух различных участках – инвертированных повторах (ип). Инвертированные повторы – это участки молекулы ДНК, два сегмента которых имеют одинаковую нуклеотидную последовательность, но противоположную ее ориентацию.
Обычно используются произвольные праймеры из 10 нуклеотидов, содержащие не менее 50 % GC. Так как пара G-C содержит три водородных связи, а пара A-T – только две, гибрид «ДНК-праймер», содержащий менее 50 % GC, плавится до того, как полимераза начинает полимеризацию и про-
30
