
Строение вещества (120
..pdfдонорно-акцепторному механизму. Координационная связь при этом рассматривается как обычная ковалентная полярная -связь, но с бóльшей степенью ионности. Комплексообразователь выступает в роли акцептора, лиганд – в роли донора неподеленной электронной пары. Вакантные атомные орбитали комплексообразователя, принимающие участие в связи, подвергаются гибридизации и имеют бóльшую энергию по сравнению с энергией занятых атомных орбиталей, не участвующих в гибридизации. В образовавшемся комплексе гибридные орбитали, количество которых равно КЧ комплексообразователя, располагаются строго определенным образом, так, чтобы электронные пары лигандов находились как можно дальше друг от друга. В зависимости от типа гибридизации атомных орбиталей (АО) комплексообразователя возникает различная геометрическая структура комплекса (треугольник, квадрат, тетраэдр, октаэдр и др.). Обобществленная электронная пара после гибридизации будет находиться уже в поле двух ядер: комплексообразователя и лиганда.
При всей наглядности теории ВС она имеет ряд недостатков. Она не всегда позволяет объяснить пространственное строение и магнитные свойства комплексов. К тому же, используя эту теорию, нельзя дать ответ на вопрос: почему внутренние (n − 1)d-АО не всегда участвуют в комплексообразовании? Помимо всего прочего, квантовомеханические расчеты не подтверждают участие в образовании комплексов d-АО с высокой энергией. На основании теории ВС также нельзя сделать вывод об окраске комплексов и их устойчивости в водных растворах.
В теории кристаллического поля (КП), в отличие от теории ВС, исходным является предположение о чисто ионной природе координационной связи, т. е. она базируется на электростатических представлениях о строении комплексов. Эта теория эффективно используется для объяснения энергии стабилизации, магнитных свойств, окраски комплексов и скорости обмена в них лигандов. Наряду с обычными представлениями в ней рассматривается и влияние электростатического поля лигандов на энергетическое состояние d-электронов комплексообразователя. Поскольку наиболее распространенными являются комплексы с КЧ = 6 и 4, то характер этого влияния следует рассмотреть применительно к октаэдрическому (КЧ = 6) и тетраэдрическому (КЧ = 4) полям лигандов.
Основой теории КП является электростатическая теория Косселя – Магнуса, дополненная методом валентных связей. Теория КП была предложена для объяснения влияния лигандов на ион-комп-
21

лексообразователь, имеющий незавершенные внутренние (n − 1)d- АО. Лиганды располагаются вокруг центрального атома в вершинах полиэдров (правильных многогранников) в виде жестко закрепленных точечных зарядов. При этом электронная конфигурация лиганда и его объем не имеют значения. В свободном состоянии все электроны на (n − 1)d-АО имеют одинаковую энергию. Под действием электростатического поля лигандов, окружающих центральный атом, d-АО комплексообразователя расщепляются, что приводит к изменению их энергии. Энергия и количество образованных подуровней зависят от расположения лигандов, т. е. от симметрии полиэдра.
Выше было сказано, что наиболее распространенными являют-
ся октаэдрическое и тетраэдрическое поля лигандов. В этих по-
лях (n − 1)d-АО оказываются в неравноценном положении. Так, в октаэдрическом поле dz2 - и dx2 y2 -АО расположены вдоль осей
координат и подвергаются сильному электростатическому воздействию лигандов, приобретая более высокую энергию по сравне-
нию с энергией исходных (n − 1)d-АО (d на рис. 3, а). Орбитали dxy, dxz и dyz расположены между осями координат и в значительно меньшей степени попадают в поле лигандов, что приводит к уменьшению их энергии (dε на рис. 3, а). Разность между энергиями орбиталей называют параметром расщепления (например,
на рис. 3, а о – параметр расщепления в октаэдрическом поле). Параметр расщепления характеризует силу создаваемого лигандами поля и зависит от природы центрального атома и лигандов: чем
сильнее поле лигандов, тем больше значение о. Параметр расщепления измеряется в килоджоулях на моль (кДж/моль).
d |
E |
|
d |
|
E |
||
|
|
||
|
|
|
т |
|
|
|
|
|
|
(n-1)d |
|
d |
a |
б |
d |
|
|
|
|
|
a |
|
б |
Рис. 3. Расщепление (n – 1)d-АО в полях лигандов: a – октаэдрическом; б – тетраэдрическом
22
Если поле лигандов слабое и имеется незавершенный 3d-
подуровень, то реализуется тетраэдрическое поле лигандов. Рас-
щепление (n − 1)d-АО в тетраэдрическом поле происходит зеркально расщеплению в октаэдрическом поле, при этом т будет меньше о (см. рис. 3, б).
Для катионов 3d-элементов существует экспериментально установленный спектрохимический ряд, в котором лиганды располагаются в порядке убывания силы кристаллического поля:
CN NO2 NH3 ЭДТА2− NCS H2O СН3СОО− > > C2O24 OH dmg NO3 Cl Br I
Лиганды начала ряда носят условное название сильнопольные, лиганды конца ряда – слабопольные. Тем не менее в зависимости от природы и степени окисления 3d-элемента, а также от возникающего у комплексообразователя расщепления лиганды середины, начала или конца ряда могут оказывать неоднородное воздействие на центральный атом, т. е. изменять свои положения в спектрохимическом ряду. Числовое значение параметра расщепления у катионов 3d-элементов изменяется в пределах от 420 кДж/моль для [Fe(CN)6]3− до 30 кДж/моль для [CoI4]2−. Значения приблизительно пропорциональны значениям энергии связей комплексообразователь – лиганд, что проявляется во многих свойствах комплексов, важнейшим из которых является энергетическая стабилизация комплекса, т. е. его термодинамическая устойчивость. Последняя определяется положением лиганда в спектрохимическом ряду, числом электронов на d-АО у комплексообразователя и энергией спаривания электронов, т. е. энергией их взаимного отталкивания, если два электрона оказываются на одной орбитали.
Переходы электронов с низкоэнергетического на высокоэнергетический уровень осуществляются под воздействием квантов света (фотонов) в видимой области спектра и в прилегающих к ней УФ- и ИК-областях. На переход электронов затрачивается только часть энергии фотона, а оставшаяся (дополнительная) часть вызывает появление окраски раствора комплекса (табл. 6). Поглощаемая часть энергии есть параметр расщепления , рассчитываемый по формуле
NAh |
c |
|
11,96 104 |
, |
(4) |
|
|
|
|||||
|
|
|
|
где – длина волны, нм.
23

|
|
|
|
|
Таблица 6 |
|
Соответствие длины волны и дополнительных цветов |
||||
|
|
|
|
|
|
|
Дополнительный |
Длина волны |
Дополнительный |
Длина волны |
|
|
цвет |
λ, нм*, погло- |
цвет |
λ, нм*, погло- |
|
|
(окраска раствора) |
щаемого света |
(окраска раствора) |
щаемого света |
|
|
|
|
|
|
|
|
Желтый |
430 |
Синий |
580 |
|
|
Оранжевый |
480 |
Голубой |
610 |
|
|
Красный |
500 |
Светло-зеленый |
680 |
|
|
Красно- |
530 |
Зеленый |
720 |
|
|
коричневый |
||||
|
|
|
|
||
|
Фиолетовый |
560 |
Темно-зеленый |
760 |
|
|
|
|
|
|
|
* Значения приближенные.
Окраска комплекса также зависит от степени окисления центрального атома. Например, комплексы меди (I) бесцветны, тогда как комплексы меди (II) окрашены. Дело в том, что 3d-АО у иона Сu+ заполнены целиком (конфигурация 3d10) и переход электронов с од-
ной d-АО на другую невозможен. Аналогично ионам Cu+ окраски также не имеют комплексы Ag+, Zn2+, Cd2+ и Hg2+ (конфигурация d10).
При рассмотрении комплексов со значительной степенью ковалентности координационной связи наиболее полное и точное описание характера взаимодействия комплексообразователя и лигандов дает теория молекулярных орбиталей, которую в приложении к комплексным соединениям называют теорией поля лигандов (ПЛ). Она фактически объединяет первые две теории (ВС и КП) и является ведущей при рассмотрении строения комплексов. Учитывая структуру комплексообразователя и лигандов как единого целого, теория ПЛ дает наиболее полные ответы на вопросы о КЧ, геометрических характеристиках и энергии связей. Рассмотрение теории ПЛ ввиду ее сложности выходит за рамки большинства программ по химии в технических университетах.
Последовательность проведения опыта
1. Налейте в три чистые пробирки по 2…4 мл водного раствора соли заданного комплексообразователя с лигандом I (см. табл. 1) и отметьте окраску раствора в них.
24
2.Одну их пробирок оставьте в качестве образца для сравнения окраски растворов.
3.Во вторую пробирку добавьте 2…4 мл концентрированного
раствора вещества (соли, гидроксида), содержащего лиганд II. В случае, если лигандами являются анионы ЭДТА2 , то к раствору
вначале добавьте 1 мл концентрированного раствора NH4ОН, а затем уже около 4 мл раствора трилона Б.
4.Содержимое второй пробирки тщательно перемешайте, после чего отметьте в ней окраску раствора комплексного соединения с заданным лигандом.
5.Повторяя действия, описанные в пп. 3−4, проведите аналогичное исследование с раствором в третьей пробирке, добавив в нее вещество, содержащее лиганд III.
Обработка результатов
1. Исходные данные, наблюдения, результаты определений и расчетов, а также выводы запишите в табл. 7.
|
|
Таблица 7 |
Результаты эксперимента |
||
|
|
|
Исходные данные |
Наблюдения |
|
|
|
|
Ион-комплексообразователь |
Изучаемый |
Окраска (цвет пропускания) |
|
лиганд |
водного раствора комплекса |
|
I − |
|
|
II − |
|
|
III − |
|
Результаты определений и расчетов |
Выводы |
|
|
Значение |
|
Длина волны , нм, погло- |
параметра |
Возрастающий спектрохи- |
щаемого комплексом цвета |
расщепления |
мический ряд лигандов |
|
, кДж/моль |
|
|
|
|
|
|
|
|
|
|
2.По окраске водного раствора комплекса определите по табл. 6 длину волны , нм, поглощаемого комплексом света.
3.Приведите уравнения реакций образования комплексов с соответствующим лигандом. Определите КЧ комплексообразователя в них. Назовите эти комплексы по систематической номенклатуре.
25
4.Определите силу кристаллического поля изучаемых лигандов, рассчитав по формуле (4) их параметр расщепления в октаэдрическом поле ( о) или в тетраэдрическом поле ( т).
5.На основании значений расположите исследованные лиганды в возрастающий спектрохимический ряд.
6.Напишите электронную формулу комплексообразователя в форме свободных атома и иона. Изобразите энергетическую диаграмму расщепления (n – 1)d-АО иона-комплексообразователя в тетраэдрическом (КЧ= 4) или октаэдрическом(КЧ= 6) поле лигандов.
7.Укажите тип гибридизации АО комплексообразователя. Изобразите геометрическую форму комплексов. Укажите число, тип и механизм образования связей в них, а также магнитные свойства комплексов.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Разность в энергиях 3s- и 3p-подуровней для атома магния составляет 260,5 кДж/моль. Определите длину волны излучения при его переходе из возбужденного состояния в основное состояние (переход 3p 3s).
Решение. Используя уравнение Планка, находим
|
NAhc |
|
6,022 1023 6,622 10 34 2,998 108 |
|
|
E |
260 500 |
||||
|
|
|
|||
|
|
|
459,2 10 9 м 459,2 нм. |
|
Пример 2. Рассчитайте степень ионности связи в газообразных частицах HCl и NaCl, если их дипольные моменты равны 1,08 и 10,00 Д, а длина диполей – 0,125 и 0,260 нм соответственно.
Решение. По разности значений электроотрицательности (по Полингу) определяем вид связи:
ΔχHCl = χCl − χH = 3,16 – 2,20 = 0,94; ΔχNaCl = χCl − χNa = 3,16 – 0,93 = 2,23.
Следовательно, в HCl связь ковалентная полярная с частично ионным характером, так как 0,4 < ΔχHCl < 1,9, а в NaCl связь ионная с частично ковалентным характером, поскольку ΔχNaCl > 1,9.
26
Степень ионности связи оценивают по значению эффективного заряда δ, рассчитываемому по уравнению (2), в котором избыточный заряд q находят из соотношения (3). В результате подстановки получают:
HCl |
|
HCl |
|
100 % |
|
1,08 3,34 |
10 30 |
|
100 % 18 %; |
|||||
l |
HCl |
q |
|
0,125 |
10 9 |
1,6 10 19 |
|
|||||||
|
|
e |
|
|
|
|
|
|
|
|
|
|
||
NaCl |
|
NaCl |
|
100 % |
10,0 3,34 10 30 |
|
100 % 80 %. |
|||||||
l |
|
q |
|
0,26 |
10 9 |
|
1,6 10 19 |
|
||||||
|
|
|
NaCl |
e |
|
|
|
|
|
|
|
|
|
|
Таким образом, в HCl связь ковалентная полярная с 18 % ионности, а в NaCl связь ионная с 20 % (100 – 80 = 20) ковалентности.
Пример 3. Укажите тип гибридизации АО комплексообразователя в ионах [CoF6]3− и [Co(NH3)6]3+. Каковы их пространственная структура и магнитные свойства? Назовите указанные комплексы по систематической номенклатуре.
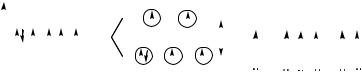
Решение. В гексафторокобальтат (III)-анионе [CoF6]3− в связях с фторид-ионами участвуют шесть sp3d2-гибридных орбиталей иона Со3+. Таким образом, пространственная структура комплекса – октаэдр.
Лиганд F является слабопольным, поэтому в октаэдрическом поле одна 3d -орбиталь несет неподеленную электронную пару, а
две 3d - и две 3d -орбитали – по одному электрону (рис. 4). В этом случае комплекс является парамагнитным.
E |
|
|
|
|
|
|
|
|
|
|
|
sp3d2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
Co3+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
|
|
|
|
|
|
|
4d |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Слабое поле |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
F F F |
|
F F |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
||||||||||||||||||||
Рис. 4. Расщепление 3d-подуровня иона Со3+ и образование связей в комплексном анионе [CoF6]3−
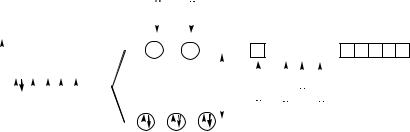
В катионе гексаамминкобальта (III) лиганды NH3 создают сильное поле, в результате чего две 3d -орбитали являются свободными и сами участвуют в образовании связей с лигандами (рис. 5). Имеет
27
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 NH3 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d2sp3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
4p |
|
|
|
|
|
|
|
|
4d |
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
3d |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
Co3+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 |
|
|
|
||||
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 NH3 |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
Сильное поле |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d
Рис. 5. Расщепление 3d-подуровня иона Со3+ и образование связей в комплексном катионе[Co(NH3)6]3+
место d 2sp3-гибридизация АО иона Со3+, что соответствует октаэдрическому расположению лигандов, но комплекс является уже диамагнитным.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Напишите электронные формулы атомов хрома Cr и палладия Pd в основном и ближайшем возбужденном состояниях. Покажите распределение их валентных электронов для этих состояний по квантовым ячейкам. Определите число неспаренных электронов в этих состояниях.
2.Напишите электронные формулы атома меди и иона Cu+. Для обеих частиц покажите распределение валентных электронов по квантовым ячейкам. Укажите магнитные свойства частиц.
3.Длина волны излучения атома стронция Sr при переходе его электронов с 5р-подуровня на 5s-подуровень составляет 460,7 нм. Рассчитайте разность в энергиях этих подуровней.
4.Атомы калия K окрашивают пламя в фиолетовый цвет. Длина волны этого характеристического излучения равна 404,5 нм. Определите его частоту.
5.Значения длины волны излучения, отвечающего переходу
электрона из возбужденного состояния (n = 2) в основное состояние (n = 1), для ионов He+ и Li2+ равны соответственно 30,38 и 13,50 нм. Рассчитайте разность в энергиях энергетических уровней для этих ионов. Объясните полученный результат.
6.Напишите электронные формулы ионов Li+ и Н . У какого из них больше первая энергия ионизации?
28
7.Какие из указанных частиц являются изоэлектронными: Fe2+, Co3+, Cr3+, Ni2+, Mn и Cu+?
8.В каком случае энергия электрона со следующим набором квантовых чисел больше: а) n = 5, l = 0, ml = 0, ms = +1/2; б) n = 4,
l = 2, ml = −1, ms = −1/2?
9. Назовите элементы, атомы которых имеют по одному электрону на 3d- и 4d-АО. Напишите электронные формулы атомов этих элементов. Найдите в Периодической системе элементы, электронная формула валентных орбиталей которых (n−1)d10ns1.
10. Назовите элемент Э 4-го периода, зная, что его высший оксид имеет состав Э2О7, а с водородом он образует газообразное соединение НЭ. Приведите его электронную формулу и укажите возможные степени окисления.
11. Вычислите энергию связи в молекулах О2 и NaI, которые диссоциируют под действием излучения с длиной волны: первая
2,41 102 нм; вторая 3,24 102 нм.
12. Три элемента Х, Y и Z имеют относительные значения электроотрицательности 3, 2 и 1 соответственно. Приведите формулы в соответствии с последовательностью написания в них символов элементов всех возможных двухатомных молекул с указанием в каждой вида связи.
13. Ионы Са2+ и Сd2+ имеют приблизительно одинаковые ионные радиусы, равные 0,104 и 0,099 нм соответственно. Какой из этих ионов оказывает большее поляризующее воздействие на анионы? Какое из соединений (CaCl2 или CdCl2) обладает более высокой температурой плавления и почему?
14. Какая энергия потребуется для разложения 1,25 г иодоводородной кислоты HI, энергия диссоциации которой равна 298,4 кДж/моль? Будет ли она подвергаться разложению под действием УФ-излучения с длиной волны 3,2 102 нм?
15. Определите вид связи (ковалентная, ионная, металлическая, межмолекулярная) в кристаллах по значению их температуры Тпл и теплоты Нпл плавления:
Кристалл....................................... |
Ar |
Mg |
Si |
NaCl |
Тпл, K............................................. |
83 |
923 |
1683 |
1081 |
Нпл, кДж/моль............................ |
1,17 |
8,96 |
46,50 |
28,50 |
16. Установите вид кристаллической решетки (атомная, ионная, металлическая, молекулярная) по значению ее энергии U при температуре 298 K у следующих веществ:
29
Вещество ................. |
NaCl C (алмаз) |
Cu |
H2O |
I2 |
CO2 |
U, кДж/моль............. |
774 715 |
302 |
50 |
42 |
26 |
17. Кристаллы LiCl и KCl, Si и Ge, Al2O3 и Ge2O3 являются по-
парно изоморфными. Установите, какие пары веществ образуют твердые растворы замещения, если радиусы r катионов (атомов) этих веществ составляют:
Катион (атом)........... |
Li+ |
K+ |
Si |
Ge |
Al3+ |
Ge3+ |
r, нм .......................... |
0,068 |
0,133 |
0,134 |
0,139 |
0,057 |
0,055 |
18.К какому виду кристаллов относят следующие твердые вещества: NaI, NaF, NaCl? Расположите их в порядке возрастания степени полярности связи.
19.Рассчитав молярную массу, установите формулу соединения, кристаллизующегося в кубической сингонии с одной фор-
мульной единицей в элементарной ячейке и, длиной ребра куба, равной 4,16 10−10 м, если соединение состоит из атомов церия Се и бора В и его плотность равна 4,73 г/см3.
20.Определите структурный тип решетки (простая, гранеили объемноцентрированная кубические), в которой кристаллизуется
платина Pt, а также рассчитайте значение эффективного радиуса rэф ее атомов, если ее плотность составляет 21,45 г/см3, а длина ребра куба равна 3,93 10−10 м.
21.Напишите формулы анионных и катионных комплексов, образуемых данным ионом-комплексообразователем и соответст-
вующими лигандами: а) Cr3+: OH , H2O; б) Pt4+: Cl , NH3. Назовите эти комплексы по систематической номенклатуре.
22.Напишите формулы следующих комплексных соединений: а) гексагидроксоплюмбат (IV) натрия; б) нитрат диамминсеребра.
23.Назовите комплексное соединение в соответствии с систе-
матической номенклатурой: а) K4[Fe(CN)6]; б) [Cr(NH3)6](NO3)3;
в) (NH4)2[Hg(NCS)4]. Определите заряд и КЧ иона-комплексо- образователя.
24.Напишите молекулярные и ионно-молекулярные уравнения
реакций образования комплексных соединений: а) CuSO4 +
+ NH4OH(изб) ; б) AlF3 + NaF ; в) Cr2(SO4)3 + NaCN(изб) .
Укажите заряды комплексных частиц и ионов-комплексообра- зователей, а также КЧ последних.
25. Чему равен заряд комплексообразователя в комплексах:
а) [Co(NH3)5Cl]2+; б) [Pt(OH)2Cl4]2−; в) [Cr(H2O)4Cl2]+?
30
