
- •Л. П. Павлюченкова
- •14.1. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.2. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.3. На анализ представлена проба соли сине-голубого цвета. Испытания показали следующее:
- •14.4. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.5. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.6. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.7. На анализ представлена проба соли темно-зеленого цвета. Испытания показали следующее:
- •14.8. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.10. На анализ представлена проба соли зеленоватого цвета. Испытания показали следующее:
- •14.12. На анализ представлена проба соли розового цвета. Испытания показали следующее:
- •14.13. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.14. На анализ представлена проба соли коричневатого цвета. Испытания показали следующее:
- •14.15. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.16. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.18. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.19. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.20. На анализ представлена проба соли желтого цвета. Испытания показали следующее:
- •14.21. На анализ представлена проба соли фиолетового цвета. Испытания показали следующее:
- •14.22. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.23. На анализ представлена проба соли розового цвета. Испытания показали следующее:
- •14.24. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.25. На анализ представлена проба соли белого цвета. Испытания показали следующее:
- •14.26. На анализ представлена проба соли темно-зеленого цвета. Испытания показали следующее:
Министерство образования и науки Российской Федерации Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
"Хабаровская государственная академия экономики и права"
Л. П. Павлюченкова
Неорганическая и аналитическая химия
Сборник заданий
Хабаровск 2005
2
Министерство образования и науки Российской Федерации Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
"Хабаровская государственная академия экономики и права"
Кафедра естественнонаучных дисциплин
Л.П. Павлюченкова
Неорганическая и аналитическая химия
Для самостоятельной внеаудиторной работы студентов дневной формы обучения специальности «Товароведение и экспертиза товаров» и
«Технология продуктов общественного питания»
Сборник заданий
Первый проректор по учебной работе
___________________________Т.В. Чернова «_____» _____________________ ______ г. Рекомендовано к изданию редакционной комиссией ИБС Протокол №____________ от ____________
Председатель комиссии по естественным наукам__________________ __В.В. Кольцов Обсуждено на заседании кафедры ЕНД «____» ________ 200__ г. протокол № ____
Зав. кафедрой ____________ В.Л. Бутуханов Составитель___________Л.П. Павлюченкова «____» ___________ 200__ г.
Хабаровск 2005
3 |
|
Содержание |
|
Предисловие………………………………………………………………. |
4 |
Задание по неорганической химии……………………………………… |
5 |
Тема 1. Номенклатура неорганических соединений……………………. |
5 |
Тема 2. Строение атома. Периодический закон и периодическая |
10 |
система элементов Д.И. Менделеева…………………………………….. |
|
Тема 3. Химическая связь………………………………………………… |
10 |
Тема 4. Концентрация растворов………………………………………… |
12 |
Тема 5. Определение рН кислот и оснований…………………………... |
16 |
Тема 6. Гидролиз солей…………………………………………………… |
20 |
Тема 7. Малорастворимые соединения………………………………….. |
22 |
Тема 8. Комплексные соединения……………………………………….. |
25 |
Тема 9. Смещение химического равновесия……………………………. |
30 |
Тема 10. Окислительно-восстановительные реакции в растворах…….. |
31 |
Тестовое задание для самооценки усвоения основных разделов |
35 |
неорганической химии…………………………………………………… |
|
Задание по аналитической химии………………………………………... |
39 |
Тема 11. Качественный анализ. Реакции катионов 1-3 аналитических |
39 |
групп……………………………………………………………………….. |
|
Тема 12. Качественный анализ. Реакции 4-6 аналитических групп…… |
41 |
Тема 13. Качественный анализ. Реакции анионов……………………… |
43 |
Тестовый контроль для самооценки усвоения реакций обнаружения |
44 |
катионов и анионов………………………………………………………. |
|
Тема 14. Качественный анализ. Ситуационная задача по анализу соли. |
48 |
Тема 15. Титриметрический анализ кислотно-основное титрование…. |
60 |
Тема 16. Перманганатаметрия…………………………………………… |
69 |
Тема 17. Иодометрия……………………………………………………… |
73 |
Тема 18. Аргентометрия………………………………………………….. |
81 |
Тема 19. Комплексометрия……………………………………………….. |
86 |
Тестовый контроль знаний по аналитической химии………………….. |
90 |
Приложение……………………………………………………………….. |
95 |
Библиографический список……………………………………………… 104
4
ПРЕДИСЛОВИЕ
Настоящее учебное пособие предназначено для самостоятельной работы студентов специальности «Товароведение и экспертиза товаров» и «Технология продуктов общественного питания» с целью организации познавательной деятельности. Основную роль в этой деятельности играет выполнение индивидуальных заданий, направленных на поиск необходимой информации, решение ситуационных задач и составление соответствующих выводов.
Задания сгруппированы по темам, включающим вопросы общей, неорганической и аналитической химии (химический анализ), и расположены в порядке прохождения материала и увеличения его сложности.
К заданиям основных разделов даны краткие предварительные указания. При этом предполагается, что студент знаком с соответствующим материалом по лекциям и учебникам.
Необходимый справочный материал представлен в Приложении.
5
ЗАДАНИЯ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
Задания по неорганической химии включают 10 тем, номер задания по каждой из них соответствует номеру варианта.
Тема 1. Номенклатура неорганических соединений
Составление химических формул и названий неорганических веществ проводится в соответствии с номенклатурными правилами Международного союза теоретической и прикладной химии (ИЮПАК), адаптированных к традициям русского языка.
Химическая формула полностью отражает состав данного вещества. По формуле строится систематическое название, также полностью отражающее состав вещества. Например, Hg2Cl2 – дихлорид диртути, Mn2O7 – оксид марганца (VII), Na2CO3 – триоксокарбонат (IV) натрия.
Для наиболее распространенных неорганических веществ применяются, помимо систематических названий, традиционные (отражающие состав не полностью). Например, HNO3 – азотная кислота, KNO3 – нитрат калия. Также допускается использование специальных названий (совсем не отражающих состав), таких как H2O – вода, NH3 – аммиак. Эти названия обычно более короткие и поэтому удобны в использовании.
Кроме того, в технической литературе зачастую применяют бессистемные тривиальные названия, например, сода, едкий натр, медный купорос, соляная кислота, негашеная известь, бура.
Для большинства элементов корни их русских названий совпадают с корнями латинских названий элементов. В случае несовпадения в производные названия вводятся корни латинских названий элементов
(табл. 1.1).
6
Таблица 1.1
Название и корни латинских названий элементов
Символ |
|
Корень латинского |
Символ |
|
Корень |
|
Название |
Название |
латинского |
||||
|
|
|||||
|
названия |
|
||||
|
|
|
|
названия |
||
|
|
|
|
|
||
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|
|
Ag |
Серебро |
аргент- |
N |
Азот |
нитр- |
|
|
|
|
|
|
|
|
As |
Мышьяк |
арс-, арсен- |
Ni |
Никель |
никкол- |
|
|
|
|
|
|
|
|
Au |
Золото |
аур- |
O |
Кислород |
окс-, оксиген- |
|
|
|
|
|
|
|
|
C |
Углерод |
карб, карбон- |
Pb |
Свинец |
плюмб- |
|
|
|
|
|
|
|
|
Cu |
Медь |
купр- |
S |
Сера |
сульф-, тио- |
|
|
|
|
|
|
|
|
Fe |
Железо |
ферр- |
Sb |
Сурьма |
стиб- |
|
|
|
|
|
|
|
|
H |
Водород |
гидр-, гидроген- |
Si |
Кремний |
сил-, силиц-, |
|
|
|
|
|
|
силик- |
|
Hg |
Ртуть |
меркур- |
|
|
||
|
|
|
|
|
|
|
Mn |
Марганец |
Марган- |
Sn |
Олово |
станн- |
|
|
|
|
|
|
|
Количественный состав вещества в названии характеризуется с помощью греческих числительных, используемых как числовые
приставки: |
|
|
|
|
моно – 1 |
три – 3 |
пента – 5 |
гепта – 7 |
нона – 9 |
ди – 2 |
тетра – 4 |
гекса – 6 |
окта – 8 |
дека – 10 |
Римскими цифрами, приводимыми в скобках после названия элемента, указывается (при необходимости) его степень окисления, например:
SO2 – оксид серы (IV), FeCl3 – хлорид железа (III),
Сu2+ – катион меди (II) (читается катион меди два).
Одноэлементные анионы называют с добавлением к названию элемента
окончания – ид и слова «ион»: |
|
O2- – оксид-ион, |
S2- – сульфид-ион, |
Cl- – хлорид-ион, |
H- – гидрид-ион. |
Для некоторых ионов применяются вместо систематических названий специальные, например O22- – пероксид-ион.
Специальные названия присваивают многим многоэлементным ионам:
|
7 |
NH4+ – катион аммония, |
HS- – гидросульфид-ион, |
H3O+ – катион оксония, |
NCS- – тиоцианат-ион, |
CN- – цианид-ион, |
OH- – гидроксид-ион. |
Специальные названия катионов и анионов переходят в названия сложных веществ без изменения. Например, NH4Cl – хлорид аммония, H2O2 – пероксид водорода, Ba(OH)2 – гидроксид бария, HCN – циановодород, Fe(NCS)3 – тиоцианат железа (III).
Для наиболее распространенных оксокислот и их кислотных остатков
используются следующие традиционные названия: |
|
||
|
Оксокислота |
Кислотный остаток |
|
HAsO2 |
- метамышьяковистая кислота |
AsO2- |
- метаарсенит |
H3AsO3 |
- ортомышьяковистая кислота |
AsO33- |
- ортоарсенит |
H3AsO4 |
- мышьяковая кислота |
AsO43- |
- арсенат |
HBO2 |
- метаборная кислота |
BO2- |
- метаборат |
H3BO3 |
- ортоборная кислота |
BO33- |
- ортоборат |
|
|
B4O72- |
- тетраборат |
H2CO3 |
- угольная |
CO32- |
- карбонат |
HClO |
- хлорноватистая |
ClO- |
- гипохлорит |
HClO2 |
- хлористая |
ClO2- |
- хлорит |
HClO3 |
- хлорноватая |
ClO3- |
- хлорат |
HClO4 |
- хлорная |
ClO4- |
- перхлорат |
H2CrO4 |
- хромовая |
CrO42- |
- хромат |
H2Cr2O7 |
- дихромовая |
Cr2O72- |
- дихромат |
HMnO4 |
- марганцовая |
MnO4- |
- перманганат |
H2MnO4 |
- марганцовистая |
MnO42- |
- манганат |
HNO3 |
- азотная |
NO3- |
- нитрат |
HNO2 |
- азотистая |
NO2- |
- нитрит |
H3PO4 |
- офтофосфорная |
PO43- |
- ортофосфат |
H2SO4 |
- серная |
SO42- |
- сульфат |
H2SO3 |
- сернистая |
SO32- |
- сульфит |
H2SO3S |
- тиосерная |
S2O33- |
- тиосульфат |
(H2S2O3) |
|
|
|
8
Указанные традиционные названия кислотных остатков входят в названия соответствующих солей.
В русском варианте правил ИЮПАК название вещества читается справа налево, то есть в начале называется его электроотрицательная составляющая (анион) в именительном падеже, а затем электроположительная (катион) в родительном падеже. При этом в случае одноэлементного аниона используют суффикс – ид, а в случае многоэлементного аниона суффикс – ат (если элемент имеет постоянную степень окисления или элемент с переменной степенью окисления находится в высшей степени окисления) или суффикс – ит (если элемент находится в низшей степени окисления).
Например: |
|
CO – оксид углерода (II) |
Fe2(SO4)3 – сульфат железа (III) |
CO2 – оксид углерода (IV) |
NaNO2 – нитрит натрия |
HCl - хлорид водорода |
KJ – иодид калия |
(хлороводород) |
KJO3 – иодат калия |
NaH – гидрид натрия |
|
Традиционные названия кислых солей образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-, например:
KHSO4 – гидросульфат калия, NaH2PO4 – дигидрофосфат натрия.
Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-, например:
FeOHNO3 – гидроксонитрат железа (II), (CoOH)2SO4 – гидроксосульфат кобальта (II), BiOCl – оксохлорид висмута (III).
Задания по теме «Номенклатура неорганических соединений» даны в табл. 1.2.
9
Таблица 1.2
Номенклатура неорганических соединений
№ |
Дайте название |
№ |
Напишите формулу |
п/п |
соединению |
п/п |
соединения |
|
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
1.1. |
Ca3(PO4)2 |
1.1. |
Гидросульфит натрия |
1.2. |
CuOHCl |
1.2. |
Сульфат бария |
|
|
|
|
1.3. |
NaJO |
1.3. |
Тиосульфат натрия |
|
|
|
|
1.4. |
Ca(HSO4)2 |
1.4. |
Иодат натрия |
1.5. |
KBrO3 |
1.5. |
Гидроксосульфат железа (III) |
1.6. |
Cr2(SO4)3 |
1.6. |
Дихромат калия |
1.7. |
Sb2O3 |
1.7. |
Гипоиодит натрия |
1.8. |
NaH2AsO3 |
1.8. |
Гидроксид бария |
1.9. |
Na2O2 |
1.9. |
Нитрат алюминия |
1.10. |
AlOHSO4 |
1.10. |
Дигидрофосфат кальция |
1.11. |
(NiOH)2SO4 |
1.11. |
Иодид аммония |
1.12. |
Bi2S3 |
1.12. |
Гидросульфат кальция |
1.13. |
Ba(ClO3)2 |
1.13. |
Гидроксосульфат меди (II) |
1.14. |
NaH2AsO4 |
1.14. |
Гидрид кальция |
1.15. |
Na2S2O3 |
1.15. |
Гидроксокарбонат меди (II) |
1.16. |
СuCrO4 |
1.16. |
Сульфит серебра |
1.17. |
(CuOH)2CO3 |
1.17. |
Хромат серебра |
1.18. |
AgNCS |
1.18. |
Сульфид висмута (III) |
|
|
|
|
1.19. |
Pb(JO3)2 |
1.19. |
Гидроксид кальция |
1.20. |
KJO4 |
1.20. |
Сульфид серебра |
1.21. |
CrPO4 |
1.21. |
Иодид серебра |
1.22. |
KNO2 |
1.22. |
Перманганат серебра |
1.23. |
Fe(OH)2Cl |
1.23. |
Тиоцианат меди |
1.24. |
Na2Cr2O7 |
1.24. |
Бромид гидроксосвинца (II) |
1.25. |
CuNCS |
1.25. |
Тиосульфат серебра |
|
|
|
|
1.26. |
Hg(NCS)2 |
1.26. |
Ацетат свинца |
1.27. |
NaClO4 |
1.27. |
Тетраборат натрия |
1.28. |
(NH4)2MoO4 |
1.28. |
Гипохлорит кальция |
1.29. |
Zn(CN)2 |
1.29. |
Арсенит серебра |
1.30. |
CdNH4PO4 |
1.30. |
Цианид ртути (II) |
10
Тема 2. Строение атома. Периодический закон и периодическая система элементов Д.И. Менделеева
При выполнении задания по этой теме необходимо дать характеристику одному из элементов периодической таблицы Д.И. Менделеева (в соответствии
сномером задания в Вашем варианте):
-напишите электронную формулу химического элемента;
-укажите принадлежность к s-, р-, d-семейству;
-укажите характерные степени окисления элемента;
-укажите на окислительно-восстановительные свойства элемента в виде простых и сложных веществ;
-напишите формулы оксидов и соответствующих гидроксидов или кислот;
-укажите, образует ли этот элемент гидриды.
2.1. Sn |
2.11. Fe |
2.21.F |
2.2. Mg |
2.12. Co |
2.22.Al |
2.3.Cu |
2.13. Ni |
2.23.P |
2.4.Ag |
2.14. Br |
2.24.N |
2.5.K |
2.15.Cl |
2.25.Mn |
2.6.S |
2.16.J |
2.26.Na |
2.7.Cr |
2.17.Zn |
2.27.As |
2.8.Pb |
2.18.Cd |
2.28.Bi |
2.9.Sb |
2.19.Ca |
2.29.B |
2.10.Pt |
2.20.Hg |
2.30.Au |
Тема 3. Химическая связь
При изучении этой темы следует уяснить современные представления о природе химической связи. Так, механизм образования ковалентной химической связи удобнее рассмотреть с позиций метода валентных связей. На основе современных представлений о строении атома объясните свойства химической связи: энергию, длину, насыщаемость, направленность, полярность. Разберитесь в особенностях ионной, металлической и водородной связи.
11
3.1.По какому механизму образования ковалентной связи построены молекулы J2 и NH3?
3.2.По какому механизму образования ковалентной связи построены молекулы F2, H2O? В какой из молекул связь является полярной? Почему?
3.3.На основании сравнения величин относительной электроотрицательности для р-элементов проследите, как изменяется полярность связи в молекулах NH3 и РН3.
3.4.Приведите схему образования молекулы N2 (с учетом перекрывания электронных облаков соединяющихся атомов). Сколько сигма- и пи-связей в молекуле азота?
3.5.Молекулы H2О и СО2 содержат по две полярные связи каждая. Почему молекула Н2О полярная, СО2 – неполярная?
3.6.По какому механизму образования ковалентной связи построен ион аммония NH4+?
3.7.Используя значения относительной электроотрицательности, укажите и объясните направление общей электронной пары для соединений HF и CF.
3.8.Дипольные моменты H2O и H2S равны 1,84 Д и 0,93 Д соответственно. В какой молекуле связь более полярна?
3.9.Сколько сигма- и писвязей в молекулах O2, N2, Br2?
3.10.Исходя из метода валентных связей сделайте вывод о возможных валентностях серы в стационарном и возбужденном состоянии.
3.11.Дипольный момент СО2 равен нулю, а H2O – 1,84 Д. Как построены эти молекулы?
3.12.По какому механизму образования ковалентной связи построен ион оксония H3O+?
3.13.Приведите примеры молекул, между атомами которых возникает водородная связь. Как влияет водородная связь на свойства веществ?
3.14.Какие атомные орбитали участвуют в образовании химической связи сероводорода H2S? Полярная ли эта молекула?
3.15.Какой тип связи в галогенидах щелочных металлов? Почему?
3.16.Почему молекула Cl2 неполярна, а JCl полярна?
3.17.Объясните, в каких молекулах CO, CO2, HBr, Br2 связь полярная, в каких неполярная?
12
3.18.По какому механизму образования ковалентной связи построены молекулы N2, HCl, H2O?
3.19.В каких молекулах возникает ионная связь? Приведите примеры.
3.20.Чем отличается металлическая связь от ковалентной?
3.21.Приведите схему образования молекулы O2 (с учетом перекрывания электронных облаков соединяющихся атомов). Какие связи в молекуле кислорода?
3.22.По какому механизму образования ковалентной связи построены молекулы Br2 и PH3?
3.23.Молекулы H2O и CO2 содержат по две полярные связи каждая. Почему молекула H2O полярная, а CO2 – неполярная?
3.24.Дипольный момент CO2 равен нулю, а H2S – 0,93 Д. Как построены эти молекулы?
3.25.В каких случаях возникает водородная связь? Приведите примеры.
3.26.В каком случае возникает более прочная водородная связь:
H … J, H … O /\ или H … N /\ ?
3.27.Приведите схему образования связей в молекуле CO. Сколько связей образуется?
3.28.Какие механизмы образования ковалентной связи соблюдаются в молекулах СО, О2?
3.29.Возможно ли образование молекул He2, F2?
3.30.Какие связи в молекулах N2, CO, C2H2?
Тема 4. Концентрация растворов
Состав раствора количественно выражают чаще всего через массовую долю, молярную и эквивалентную (нормальную) концентрацию, а также титр.
Массовая доля – это отношение массы компонента В к массе раствора. Обычно ее выражают в процентах:
ω(B) |
m(B) |
100 (%) . |
(4.1) |
|
m |
||||
|
|
|
Например, 5 % раствор хлорида натрия означает, что в 100г раствора содержится 5 г NaCl.
13
Молярная концентрация – это отношение количества растворенного вещества В к объему раствора:
с( В |
n B |
моль/дм3 . |
(4.2) |
||||
|
|
||||||
|
|
|
V |
|
|||
Количество вещества можно найти по формуле |
|
||||||
n(B) |
|
m(B) |
, |
|
(4.3) |
||
|
|
||||||
|
|
|
M(B) |
|
|||
тогда |
|
|
|
|
|
|
|
c(B) |
|
|
m(B) |
. |
(4.4) |
||
|
|
|
|||||
|
|
M(B) V |
|
||||
Одномолярный раствор – это раствор, содержащий 1 моль вещества в 1дм3 раствора. Для обозначения молярной концентрации используют символ М, например, 1М – одномолярный (с = 1 моль/дм3); 0,1 М – децимолярный (с = 0,1 моль/дм3); 0,01 М – сантимолярный (с = 0,01 моль/дм3); 0,001 М – миллимолярный (с = 0,001 моль/дм3).
Молярная концентрация эквивалентов (нормальная концентрация) –
это отношение количества вещества эквивалентов к объему раствора:
|
с 1/z |
n 1/zB |
|
моль/дм 3 |
(4.5) |
||
|
|
V |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
||
или |
с(1/zB) |
|
|
. |
(4.6) |
||
|
M(1/zB)V |
||||||
Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть какимлибо другим способом равноценна по химическому действию одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Формула эквивалента для вещества В имеет вид 1/z В, где 1/z называют фактором эквивалентности (его еще обозначают fэкв), а z – эквивалентным числом. Например, для H2SO4 фактор эквивалентности равен ½, эквивалентное число равно 2, при условии, что оба иона водорода будут участвовать в химической реакции.
Молярная и нормальная концентрация связаны между собой формулой с(1/z В) = z c (B).
14
Титр – это отношение массы растворенного вещества (в г) к объему его раствора (в см3).
Т В |
m B |
г/см3 . |
(4.7) |
|
V |
||||
|
|
|
Зная титр раствора, можно вычислить молярную и нормальную концентрацию:
с(В) |
n(B)1000 |
|
m(B)1000 |
|
T(B)1000 |
(4.9) |
||||
|
|
|
|
|
|
|
|
|
||
V |
|
|
M(B)V |
|
|
M(B) |
||||
|
|
|
|
|
|
|||||
или |
|
c(1/zB) |
T(B)1000 |
. |
|
(4.9а) |
||||
|
M(1/zB) |
|
||||||||
|
|
|
|
|
|
|
|
|||
Плотность раствора (ρ) – это отношение массы раствора к его объему:
ρ |
m |
г/см3 . |
(4.10) |
|
V |
||||
|
|
|
Соотношение между массовой долей (в%), плотностью и молярной
(или нормальной) концентрацией следующее: |
|
||||
с(В) |
ωρ10 |
, |
|
(4.11) |
|
|
|||||
|
M(B) |
|
|||
|
|
ωρ10 |
|
||
c(1/zB) |
|
. |
(4.11а) |
||
M(1/zB) |
|||||
Пример 1. Определите массовую долю (в%) азотной кислоты в 4,3 М растворе HNO3, плотность которого составляет 1,14 г/см3.
Решение. Из формулы 4.11 находим выражение массовой доли ω:
ωс(В)М(В) .
ρ10
Молярная масса азотной кислоты равна 63,0 г/моль,
ω(HNO3 ) |
4,3 |
63,0 |
23,8%. |
|
|
|
|||
1,14 10 |
||||
|
|
|||
Пример 2. Определите массу хлорида бария, необходимую для приготовления 2 дм3 децинормального раствора.
Решение. Фактор эквивалентности BaCl2 равен ½, эквивалентная масса равна половине молярной массы:
M(1/2BaCl2 ) |
M(BaCl2 ) |
|
208,2 |
104,1г/моль . |
|
2 |
|
2 |
|
||
|
|
|
|||
Из формулы 4.6 находим выражение массы:
15
m(BaCl2) = c(1/2BaCl2) M(1/2BaCl2)V = 0,1 ∙ 104,1 ∙ 2 = 20,8 г.
4.1. Раствор с массовой долей КОН 15% имеет плотность ρ = 1,14 г/см3. Рассчитайте его молярную концентрацию.
4.2.Определите массу NaCl, которая требуется для приготовления 2 дм3 0,1 М раствора.
4.3.Определите массу BaCl2, которая требуется для приготовления 500 см3:
а) 0,2 н. раствора; б) 0,1 М раствора.
4.4.Какова молярная концентрация 0,15 н. раствора H3PO4?
4.5.Какова молярная концентрация раствора с массовой долей H3PO4
14,6% (плотность ρ = 1,08 г/см3)?
4.6.Какова эквивалентная (нормальная) концентрация серной кислоты с массовой долей 8% (плотность ρ = 1,055 г/см3)?
4.7.В 200 см3 раствора находится 0,166 г иодида калия. Рассчитайте молярную концентрацию и титр этого раствора.
4.8.В 200 см3 раствора содержится 1 г NaOH. Вычислите молярную концентрацию и титр этого раствора.
4.9.1,825 г хлороводорода содержится в 500 см3 раствора. Определите молярную концентрацию и титр этого раствора.
4.10.Титр раствора NaCl составляет 0,0058 г/см3. Какова его молярная концентрация?
4.11.Сколько граммов HCl содержится в 1 дм3 0,1 М раствора соляной кислоты?
4.12.Титр раствора H2SO4 составляет 0,0049 г/см3. Какова его нормальная (эквивалентная) концентрация?
4.13.Определите массу нитрата натрия, которая требуется для приготовления 2 дм3 децимолярного раствора.
4.14.Определите массовую долю (в%) карбоната калия в его 2 М растворе
(ρ = 1,21 г/см3).
4.15.Рассчитайте титр 0,05 н. раствора H2SO4.
4.16.Титр раствора Ba(OH)2 равен 0,00855 г/см3. Какова нормальная (эквивалентная) концентрация этого раствора?
4.17.Сколько граммов H2SO4 содержится в 2 дм3 0,2 н. раствора серной кислоты?
16
4.18.Определите массовую долю (в%) КОН в его 2 М растворе (ρ = 1,095 г/см3).
4.19.Сколько граммов AgNO3 необходимо взять для приготовления 2 дм3 0,05 М раствора?
4.20.Титр раствора H2SO4 равен 0,0098 г/см3. Какова его нормальная (эквивалентная) концентрация?
4.21.Определите нормальную (эквивалентную) концентрацию фосфорной кислоты с ρ = 1,060 г/см3.
4.22.Титр раствора AgNO3 равен 0,00169 г/см3. Определите его молярную концентрацию.
4.23.Какую массу сульфита натрия необходимо взять для приготовления 2 дм3
0,1 н. раствора Na2SO3, участвующего в полуреакции
Na2SO3 - 2ē + H2O = Na2SO4 + 2H+?
4.24.Определите массу NaOH, необходимую для приготовления 200 см3 раствора с массовой долей NaOH 30% (плотность раствора ρ = 1,33 г/см3).
4.25.В 40 г воды растворили 3,5 г медного купороса CuSO4 ∙ 5H2O. Рассчитайте массовую долю (в %) безводного сульфата меди в полученном растворе.
4.26.Определите фактор эквивалентности для KMnO4, участвующего в полуреакции MnO4- + 8H+ + 5ē = Mn2+ + 4H2O, рассчитайте массу KMnO4, необходимую для приготовления 1дм3 0,05 н. раствора.
4.27.Какую массу йода, участвующего в полуреакции J2 + 2e- = 2J-, необходимо взять для приготовления 1дм3 0,05 н. раствора?
4.28.Определите нормальную (эквивалентную) концентрацию ортофосфорной кислоты (ρ = 1,060 г/см3).
4.29.Какова массовая доля (в %) 0,5 н. раствора серной кислоты?
4.30.Как приготовить 30% раствор NaCl из двух растворов, если первый с массовой долей 50%, второй с массовой долей 15%. Сколько весовых частей каждого раствора необходимо взять?
Тема 5. Определение рН кислот и оснований
По степени диссоциации электролиты делят на сильные и слабые. Сильные электролиты практически полностью диссоциируют в растворах.
17
К ним относятся: неорганические кислоты – соляная HCl, иодоводородная HJ, бромоводородная HBr, азотная HNO3, серная H2SO4, хлорная HClO4, марганцовая HMnO4; гидроксиды щелочных и щелочно-земельных металлов – KOH, NaOH, LiOH, Ba(OH)2, Ca(OH)2; все соли (кроме галогенидов ртути), в том числе считающиеся практически нерастворимыми в воде, так как они в действительности растворяются, но в очень малой степени. Растворы таких солей сильно разбавлены, в них нет недиссоциированных молекул, а есть только ионы, число которых незначительно.
Слабые электролиты – вещества, которые частично диссоциируют на ионы. К ним относятся неорганические кислоты – угольная H2CO3, кремневая H2SiO3, сернистая H2SO3, азотистая HNO2, фосфорная H3PO4, хлорноватистая HClO, циановодородная (синильная) HCN, борная H3BO3, сероводородная H2S; органические кислоты, такие как муравьиная HCOOH, уксусная CH3COOH, щавелевая H2C2O4; основания – гидроксид аммония, гидразин, малорастворимые в воде гидроксиды металлов; комплексные ионы, например, [Ag(NH3)2]+, а также вода.
По кислотно-основным свойствам растворы подразделяются на кислые, нейтральные и щелочные. Это качественная характеристика среды. Для количественной характеристики используют молярную концентрацию ионов водорода. Более удобно кислотность (основность) водных растворов выражать через десятичный логарифм молярной концентрации ионов Н+, взятый с обратным знаком. Эта величина называется водородным показателем и обозначается символом рН:
рН = - lg c(H+). |
(5.1) |
По аналогии с рН введен гидроксильный показатель рОН: |
|
рОН = - lg c(OH-). |
(5.2) |
Ионное произведение воды Kw – постоянную величину для чистой воды и водных растворов – также можно представить в логарифмической форме:
Кw = с(Н+) с (ОН-) = 1 ∙ 10-14, |
(5.3) |

18
рКw = рН + рОН = 14. |
(5.4) |
Если раствор нейтральный , то рН = рОН = 7. В кислом растворе рН < 7, в щелочном растворе рН > 7.
Определение рН среды – важная аналитическая задача. При расчете рН сильных кислот и оснований учитывают их практически полную диссоциацию в воде. Примерное определение рН и рОН без учета коэффициента активности проводят по формулам 5.1; 5.2.
Пример 1. Считая диссоциацию хлороводородной кислоты в воде полной, вычислите рН 0,01 М раствора HCl.
Решение. Концентрация ионов водорода в растворе равна концентрации хлороводородной кислоты:
с(Н+) = 0,01 моль/дм3, рН = - lg c(H+), рН = - lg 1 ∙10-2 = 2.
Пример 2. Рассчитайте рН 0,56% раствора гидроксида калия (ρ = 1 г/см3). Решение. Определяем молярную концентрацию 0,56% раствора КОН
по формуле 4.11. Молярная масса КОН составляет 56,0 г/моль:
с(КОН) |
0,56 |
1 10 |
0,1 моль / дм 3 |
, |
|
|
|
||||
56,0 |
|||||
|
|
|
|||
рОН = - lg c(OH-) = - lg 0,1 = 1,
рН = 14 – рОН = 14 -1 = 13.
Слабые кислоты (НА) и основания (В) диссоциируют в растворе мало:
HA + H2O = H3O+ + A-.
Можно считать, что с(НА) = [HA], и [Н3О+] (или просто [H+]) = [A-], тогда выражение константы кислотности Ка принимает следующий вид (без учета степени диссоциации):
|
[H ][A ] |
[H ]2 |
||
Ka |
|
|
|
, |
[HA] |
|
|||
|
c(HA) |
|||
отсюда
19
|
|
|
1 pKa |
1 lgc(HA) . |
|
[H ] Kac(HA) и pH |
(5.5) |
||||
|
|
|
2 |
2 |
|
Аналогично, допуская, что в растворе слабого основания В единственным источником OH- – ионов может быть равновесие
В + Н2О = ВН+ + ОН-,
получаем
[OH-] = 
 Kв с(В), (где Кв – константа основности),
Kв с(В), (где Кв – константа основности),
|
рОН |
|
1 |
pKв |
|
1 |
lgc(B) |
|
|||
|
2 |
2 |
|
||||||||
|
|
|
|
|
|
||||||
или |
рН 14 |
1 |
pK |
|
1 |
lgc(B). |
(5.6) |
||||
2 |
в |
2 |
|||||||||
|
|
|
|
|
|
|
|
||||
Значения рКa и pKв приведены в Приложении 2.
Пример 3. Рассчитайте рН 0,01 М раствора уксусной кислоты.
Решение. Показатель константы кислотности рКа уксусной кислоты согласно справочным данным равен 4,76.
Решение проводим по формуле 5.5
рН |
1 |
4,76 |
1 |
lg1 10 2 |
2,38 1 3,38. |
|
2 |
2 |
|||||
|
|
|
|
5.1.Рассчитайте рН 0,01 М раствора HNO3.
5.2.Рассчитайте рН 0,02 М раствора NaOH.
5.3.Рассчитайте рН 0,36% раствора HCl (ρ = 1 г/см3).
5.4.Рассчитайте рН 0,6% раствора уксусной кислоты (ρ = 1 г/см3).
5.5.Рассчитайте рН 0,17% раствора аммиака (ρ = 1 г/см3).
5.6.Рассчитайте рН 0,5% раствора аммиака (ρ = 0,996 г/см3).
5.7.Рассчитайте рН 0,6% раствора гидроксида натрия (ρ = 1,005 г/см3).
5.8.Рассчитайте рН водного раствора, в 200 см3 которого содержится 4,0 г гидроксида натрия.
5.9.Рассчитайте рН водного раствора, в 100 см3 которого содержится 0,56г гидроксида калия.
20
5.10. Рассчитайте рН 0,02 М раствора HClO4.
5.11. Рассчитайте рН раствора ,1 дм3 которого содержит 5,6 г гидроксида калия.
5.12.Рассчитайте рН 0,05 М раствора HNO3.
5.13.Рассчитать рН 0,05 М раствора NH4OH.
5.14.Рассчитайте рН 1% раствора хлорной кислоты HClO4 (ρ = 1,005 г/см3).
5.15.Рассчитайте рН 0,3% раствора уксусной кислоты (ρ = 1 г/см3).
5.16.Рассчитайте рН раствора молочной кислоты HC3H5O3 с концентрацией 0,01 моль/дм3.
5.17.Рассчитайте рН раствора бензойной кислоты C6H5COOH с концентрацией 0,1 моль/дм3.
5.18.Рассчитайте рН раствора муравьиной кислоты HCOOH с концентраций 0,02 моль/дм3.
5.19.Рассчитайте рН 0,02 М раствора LiOH.
5.20.Рассчитайте рН 0,05 М раствора NaOH.
5.21.Рассчитайте рН 0,03 М раствора КОН.
5.22.Рассчитайте рН водного раствора, в 100 см3 которого содержится 2г гидроксида натрия.
5.23.Рассчитайте рН раствора, 2 дм3 которого содержат 0,2 моль HCl.
5.24.Рассчитайте рН 0,15% раствора уксусной кислоты (ρ = 1 г/см3).
5.25.Рассчитайте рН 0,34% раствора аммиака (ρ = 1 г/см3).
5.26.Рассчитайте молярную концентрацию раствора HCl, рН которого равен 2.
5.27.Рассчитайте молярную концентрацию раствора NaOH, рН которого равен 13.
5.28.Каково значение рН 0,02 М раствора молочной кислоты HC3H5O3?
5.29. Определите |
значение рН 2% |
раствора хлорной кислоты HClO4 |
(ρ = 1,010 г/см3). |
|
|
5.30. Определите |
значение рН |
1,25% раствора азотной кислоты |
(ρ = 1,005 г/см3). |
|
|
Тема 6. Гидролиз солей
Для предложенных водных растворов солей Вашего варианта определите возможность протекания реакции гидролиза. Необходимо
21
вспомнить, что реакция между ионами соли и водой протекает только в том случае, если образуются слабые (в том числе малорастворимые) электролиты (см. Приложение 8). Это приводит к смещению равновесия в диссоциации воды и, следовательно, к изменению рН среды. Таким образом, чтобы выполнить это задание, надо знать сильные и слабые кислоты и основания, а также шкалу рН в водных растворах. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
В случае протекания реакции гидролиза запишите соответствующие уравнения реакций, определите тип гидролиза (по катиону или аниону) и определите реакцию среды (рН >7; рН = 7; рН<7).
6.1.Bi (NO3)3, KCl, K2SO4, BaCl2, Na2SO3.
6.2.KJ, Na2HPO4, SnCl2, NaCl, NaNO3.
6.3.MgCl2, FeCl2, Na2S, Na2SO4, NaCl.
6.4.K2CO3, NaBr, AlCl3, KCl, Ba(CH3COO)2.
6.5.KJ, Fe (NO3)3, Ca(NO3)2, NH4NO3, NH4NO2.
6.6.LiCl, Ca (CH3COO)2, Na2SO4, BaCl2, (NH4)2SO4.
6.7.Na2SO4, (NH4)2SO4, Al2 (SO4)3, Na2SO3, NaNO3.
6.8.NH4NO2, CaCl2, KCl, NaNO3, KCN.
6.9.Na2SO3, K2SO4, K2S, NaNO3, FeCl3.
6.10.Ba(NO3)2, FeCl3, NaBr, K2SO4, (NH4)2S.
6.11.Na2SO4, Na2CO3, (NH4)2CO3, KJ, SnCl2.
6.12.K2SO3, BiCl3, NH4Cl, KJ, NaNO3.
6.13.K2S, KCl, KCH3COO, MgSO4, NaNO3.
6.14.CuCl2, NH4NO3, CaCl2, NaBr, Na2S.
6.15.NaNO2, NH4Cl, KNO3, BaCl2, FeSO4.
6.16.NaH2PO4, KBr, Sn(NO3)2, KCl, NaNO3.
6.17.Na2CO3, Fe (NO3)3, CuSO4, NaBr, CaCl2.
6.18.Na2S, NH4NO3, K2SO3, NaCl, K2SO4.
6.19.KBr, NH4CH3COO, K2S, K2SO4, Mg (NO3)2.
6.20.(NH4)2S, NaCl, Na2SO3, K2SO4, CaCl2.
6.21.BiCl3, KCl, NaNO3, Na2HPO4, Na2S.
6.22.(NH4)2SO4, Na3PO4, KNO3, KBr, FeCl3.
6.23.SnCl2, Na2S, NaBr, NaNO2, K2SO4.
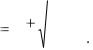
22
6.24.NaCl, CuCl2, KJ, Na2SO3, Fe2(SO4)3.
6.25.Ni (NO3)2, BaCl2, K2SO4, Na2HPO4, NaCl. 6.26.SbCl3, NH4NO3, NaCH3COO, KBr, Сa(NO3)2. 6.27.Sr (CH3COO)2, MgSO4, AlCl3, KJ, BaCl2. 6.28.Ba (NO3)2, NH4Br, NaNO2, K2S, NaNO3. 6.29.K2SO3, NaH2PO4, (NH4)2SO4, Na2SO4, KBr.
6.30.(NH4)2CO3, MgCl2, NaBr, FeCl3, KJ.
Тема 7. Малорастворимые электролиты
Задания по этой теме представлены в виде задач, для решения которых необходимо знать правило произведения растворимости и растворимость малорастворимых электролитов с ионным типом кристаллической решетки.
Осадок малорастворимого электролита выпадает, если произведение концентрации его ионов (ПИ) в растворе больше произведения растворимости (ПР). Значения ПР приведены в Приложении 3.
Пример 1. Выпадет ли осадок AgCl при сливании равных объемов 0,01
М раствора AgNO3 и 0,02 М раствора NaCl? ПР(AgCl) = 1,78 ∙ 10-10.
Решение. При сливании равных объемов общий объем раствора увеличивается вдвое, следовательно, первоначальная концентрация ионов уменьшается вдвое. Находим произведение концентрации ионов, образующих малорастворимое соединение:
Ag+ + Cl- = AgCl↓.
ПИ = [Ag+] [Cl-] = 5∙10-3∙1∙10-2 = 5 ∙10-5. Полученное ионное произведение больше произведения растворимости, следовательно, осадок выпадет.
Взаимосвязь произведения растворимости (ПР) с растворимостью (Р) в
моль/дм3 для электролита АmBn выражается формулой
|
m n |
ПРA |
B |
|
|
|
|
m n |
|||
РAmBn |
|
|
|
. |
|
|
mm |
nn |
|||
23
Для бинарных электролитов РАВ = 
 ПР.
ПР.
Растворимость в г/дм3 (Р') находят по формуле P' = P ∙ M.
Пример 2. Какова растворимость оксалата кальция, если ПР(CaC2O4) =
2,29 ∙ 10-5?
Решение
|
[Ca2 ] [C O 2 |
|
|
|
|
|
|
P |
] |
ПР(CaC O |
) |
|
2,29 10-9 4,78 10 5 моль/дм3. |
||
CaC2O4 |
2 4 |
|
2 4 |
|
|
|
|
Для выражения растворимости в г/дм3 полученное значение умножают на молярную массу соли:
Р' = 4,78 ∙ 10-5 моль/дм3 ∙ 128,1 г/моль = 6,12 ∙ 10-3г/дм3.
7.1.Каким из реагентов NaCl, KJ или NaBr можно полнее осадить ион серебра из раствора его соли?
7.2.Образуется ли осадок PbCl2 при смешивании равных объемов 0,02 М
HCl и 0,01 М Pb(NO3)?
7.3.К раствору, содержащему ионы Fe2+, Mg2+ и Zn2+ в равных концентрациях, по каплям прибавляли раствор NaOH. Какой из малорастворимых гидроксидов образуется в первую очередь?
7.4.В насыщенном растворе какого из сульфидов CuS, PbS или ZnS будет меньше концентрация иона металла? Какой из перечисленных ионов будет осажден в виде сульфида наиболее полно?
7.5.Произведение растворимости (ПР) оксалата кальция CaC2O4 равно 2 ∙10-9. Найдите растворимость этой соли.
7.6.Сколько граммов CaCO3 содержится в 2 дм3 насыщенного раствора?
7.7.На раствор, содержащий 0,2 моль/дм3 ионов Ba2+ и 0,01 моль/дм3 ионов Ca2+, подействовали раствором оксалата аммония (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.8.Растворимость AgJ равна 1,2 ∙ 10-8 моль/дм3. Вычислите произведение растворимости AgJ.
7.9.Сколько граммов PbSO4 можно растворить при 250С в 1 дм3 воды?
7.10.Пользуясь произведением растворимости AgCl и AgBr, определите, в каком из насыщенных растворов этих солей содержится больше ионов серебра.
24
7.11.Будет ли выпадать осадок CaSO4 при сливании равных объемов растворов 0,01 М CaCl2 и 0,1 М Na2SO4?
7.12.Вычислите произведение растворимости BaCO3, если его растворимость составляет 8,8 ∙ 10-3 г/дм3.
7.13.Растворимость AgNCS в воде при 250С составляет 8,38 ∙ 10-7 моль/дм3. Вычислите произведение растворимости при этих условиях.
7.14.Образуется ли осадок Ca(OH)2 при сливании равных объемов 0,01 М
CaCl2 и 0,02 М NaOH?
7.15.В какой последовательности будут осаждаться из раствора ионы CO32-, C2O42-, CrO42-, находящиеся в равных концентрациях, при добавлении раствора BaCl2?
7.16.При 250С в 500 см3 воды растворяется 1,63 ∙ 10-3 г BaCrO4. Чему равно при тех же условиях произведение растворимости этой соли?
7.17.Сколько граммов CaCO3 можно растворить при 250С в 2 дм3 воды?
7.18.Какова растворимость в (г/дм3) PbSO4?
7.19.В насыщенном растворе какого электролита – BaC2O4 или BaCrO4 – содержится меньше ионов бария?
7.20.К раствору, содержащему ионы Ba2+ и Ca2+ в равных концентрациях, добавляли по каплям раствор (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.21.Пользуясь произведением растворимости BaCO3 и CaCO3, определите, в каком из насыщенных растворов этих солей больше содержится карбонат-ионов.
7.22.Сколько граммов BaCO3 содержится в 2 дм3 насыщенного раствора?
7.23.Образуется ли осадок BaSO4 при сливании 20 см3 0,005 М раствора BaCl2 и 20 cм3 0,001 М раствора H2SO4?
7.24.Какова растворимость в (г/дм3) PbCl2?
7.25.К раствору, содержащему ионы Cl-, Br- и J- в равных концентрациях, по каплям прибавляли раствор AgNO3. Какой из перечисленных галогенидов серебра образуется в первую очередь?
7.26.Вычислите растворимость (в г/100 см3) AgNCS.
7.27.Какая соль – SrCO3 или BaCO3 – более растворима в воде и во сколько раз?
7.28.Какая соль – BaSO4 или CaSO4 – более растворима в воде?
7.29.Вычислите растворимость (в г/100 см3) CaC2O4 в воде.
25
7.30. Сколько граммов AgCl находится в 500 см3 насыщенного раствора?
Тема 8. Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных, или координационных соединений. В узлах кристаллической решетки таких соединений находятся комплексные ионы, способные к самостоятельному существованию в растворе, а в некоторых случаях и в газообразном состоянии.
Строение и свойства комплексных соединений объясняются координационной теорией А. Вернера.
В формуле комплекса [MLn] (молекула, ион) различают центральный атом – комплексообразователь (М) и лиганды (L). Название комплекса строится из названия лиганда с предшествующей числовой приставкой, указывающей число n лигандных групп, и названия центрального атома.
Названия анионных лигандов всегда имеют соединительную гласную –
о, например: |
|
F- – фторо, |
CN- – циано, |
Cl- – хлоро, |
NCS- – тиоцианато. |
OH- – гидроксо, |
|
Некоторые нейтральные лиганды имеют специальные названия:
H2O – аква, |
NH3 – аммин, |
СO – карбонил, |
NO – нитрозил. |
Вкатионных комплексах вначале дается название аниона внешней сферы, затем комплексного катиона с указанием степени окисления комплексообразователя. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I).
Ванионных комплексах называют комплексный анион, имеющий окончание –ат, с указанием степени окисления комплексообразователя, название которого образуют от латинского корня элемента, если таковой не совпадает с русским, затем называют катион. Например, K[Ag(CN)2] дицианоаргентат (I) калия.

26
Названия нейтральных комплексов составляют по общим правилам систематических названий неорганических веществ. Например, [Pt(NH3)2Cl2] – дихлородиамминплатина (II).
В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды (1 частица), они подразделяются на монодентатные (dentate - зубчатый) и полидентатные. Например, NH3, Cl-, OH- являются монодентатными лигандами, этилендиамин H2N-CH2-CH2-NH2 – бидентатным. Би- и полидентатные лиганды при взаимодействии с комплексообразователем образуют замкнутые циклы. Комплексы с такими лигандами называют клешневидными, или хелатными. Например, при взаимодействии иона платины (II) с этилендиамином вокруг центрального атома замыкаются два пятичленных цикла, образуется заряженный хелат.
|
H2 |
|
|
|
2+ |
|
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
H |
N |
|
|
C |
|
2C |
|
|
|
H2 |
|
| |
t |
| |
|
||
H |
N |
|
|
C |
|
2C |
|
|
|
H2 |
|
|
H2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
Ион бисэтилендиаминплатины (II)
В водных растворах комплексных соединений имеет место первичная диссоциация как сильного электролита (если комплексное соединение имеет внешнюю сферу) и вторичная диссоциация комплексной частицы как слабого электролита. Например, в хлориде диамминсеребра первичная диссоциация проходит как у любой соли на катион и анион:
[Ag(NH3 )2 ]Cl [Ag(NH3 )2 ] Cl .
Cl .

27
Затем комплексный ион по стадиям диссоциирует на составные части: центральный атом и лиганды. Каждая стадия описывается константой нестойкости (Кн):
[Ag(NH3 )2 ] [Ag(NH3 )]
[Ag(NH3 )] NH3 ,
NH3 ,
K |
|
[Ag(NH3 )] [NH3 ] |
, |
||
|
H(1) |
[Ag(NH3 )2 |
] |
|
|
|
|
|
|
||
[Ag(NH 3 )] Ag
Ag  NH3 ,
NH3 ,
K |
|
[Ag ][NH3 ] |
. |
|
H(2) |
[Ag(NH3 )] |
|
|
|
||
Суммарно этот процесс записывают так:
[Ag(NH 3 )2 ] Ag
Ag  2NH3 ,
2NH3 ,
K H |
[Ag ][NH |
3 |
]2 |
. |
|
|
|
||||
[Ag(NH3 )2 |
] |
||||
|
|
||||
Назовите указанное в Вашем варианте комплексное соединение. Вычислите степень окисления и координационное число центрального атома – комплексообразователя. Напишите уравнение реакции диссоциации комплексного соединения как сильного электролита, затем как слабого электролита. Составьте суммарное выражение для константы нестойкости комплексного иона. Укажите типы связей в комплексном соединении. Кроме того, составьте формулу комплексного соединения по его названию. Задание сведено в табл. 8.1.
Таблица 8.1
Комплексные соединения
№ Дайте название
Напишите формулу соединения
n/n соединению
|
|
28 |
|
|
|
1 |
2 |
3 |
|
|
|
8.1. |
[Co(NH3)5Cl]Cl |
Тетраиодомеркурат (II) калия |
|
|
|
8.2. |
Cr(H2O)6]Cl3 |
Гексанитрокобальтат (III) натрия |
|
|
|
8.3. |
K[AuCl4] |
Нитрат тетрамминмеди (II) |
8.4. |
(NH4)2[Co(NCS)4] |
Амминпентахлороплатинат (IV) калия |
|
|
|
8.5. |
Na2[Zn(OH)4] |
Гексацианоферрат (II) железа (III) - калия |
8.6. |
K[BiJ4] |
Хлорид гексаакваалюминия (III) |
|
|
|
8.7. |
K2[Cd(NO2)4] |
Тетратиоцианатокобальтат (II) аммония |
|
|
|
8.8. |
K[AgCl2] |
Гексафтроалюминат (III) калия |
|
|
|
8.9. |
Na3[Ag(S2O3)2] |
Тетранитрокадмат (II) натрия |
|
|
|
8.10. |
H2[SnCl6] |
Тетрагидроксоцинкат (II) натрия |
8.11. |
[Cd(NH3)4]SO4 |
Дихлородиаммин платина (II) |
|
|
|
8.12. |
H[FeCl4] |
Гидроксид тетрамминмеди (II) |
8.13. |
[Ag(NH3)2]OH |
Тетрацианоникколат (II) калия |
|
|
|
8.14. |
H2[SiF6] |
Гексанитрокупрат (II) натрия свинца |
|
|
|
8.15. |
K[Cr(OH)4] |
Тетраиодоаргентат (I) калия |
|
|
|
8.16. |
[Al(H2O)6]Cl3 |
Тетрагидроксоферрат (II) аммония |
|
|
|
8.17. |
H3[SbCl6] |
Гексатиоцианатоферрат (III) калия |
|
|
|
8.18. |
(NH4)2[Cu(NCS)4] |
Трисульфитокупрат (II) калия |
|
|
|
8.19. |
Na2[Ag(SO4)3] |
Пентабромоаргентат (I) водорода |
8.20. |
[Ni(N2H4)6]Cl2 |
Хлорид тиоцианатопентамминкобальта (III) |
|
|
|
8.21. |
[Co(NH3)6](OH)3 |
Пентафтороферрат (III) калия |
|
|
|
8.22. |
[Cr(H2O)4Cl2]Cl |
Бромид дихлоротетрамминплатины (IV) |
|
|
|
8.23. |
[Pb(NH3)4Cl2]Br2 |
Тетрагидроксоалюминат (III) калия |
|
|
|
8.24. |
H2[CoCl4] |
Гексагидроксостаннат (IV) натрия |
|
|
|
8.25. |
K[Pt(NH3)Cl3] |
Хлорид гексааквахрома (III) |
|
|
|
8.26. |
K2[Fe(NO)(CN)5] |
Гексагидридоалюминат (III) лития |
8.27. |
[Pt(NH3)5Cl]Cl3 |
Хлорид дихлоротетраамминхрома (III) |
|
|
|
8.28. |
[Co(NH3)5NO3]SO4 |
Гексахлороплатинат (IV) серебра |
|
|
|
8.29. |
[Pt(NH3)5Cl4] |
Хлорид хлоронитратотетраамминкобальта (III) |
|
|
|
8.30. |
[Co(NН3)5 SO4]Br |
Пентахлородиамминплатинат (IV) калия |
|
|
|
8.31. |
Na[Pb(OH)3] |
Дитиосульфатоаргентат (I) калия |
29
8.32. В следующем задании укажите дентатность лигандов:
8.32.1. CH3COOH. |
8.32.4. H2SO4. |
|||||
8.32.2. C6H5N. |
|
|
8.32.5. H2N – CH2 – CH2 – COOH . |
|||
8.32.3. H2C2O4. |
|
|
|
|
||
|
|
|
CH2COOH |
|
|
|
8.32.6. HN |
CH2COOH. |
|
|
|||
|
|
|
|
|
||
|
|
|
CH2COOH |
|
|
|
8.32.7. N |
|
CH2COOH |
|
|
||
|
|
|
||||
|
|
|
CH2COOH. |
|
|
|
8.32.8. |
|
|
|
|
|
|
|
|
|
|
|||
|
HOOCH2C |
|
|
CH2COOH |
||
|
|
|
|
|
|
|
|
|
|
|
|
N – CH2 - CH2 – N |
|
|
HOOCH2C |
|
|
|||
|
|
CH2COOH |
||||
|
|
|
|
|
|
|
8.33. Пользуясь значениями константы нестойкости комплексных ионов, определите, в растворе какого комплексного соединения больше ядовитого цианид-иона:
8.33.1. [Cо (CN)6]4-; |
8.33.2. |
[Fe (CN)6]3-; |
8.33.3. [Fe (CN)6]4-. |
Кн = 8,1 ∙ 10-20 |
Кн = |
1,2 ∙ 10-44 |
Кн = 1,2 ∙ 10-37 |
8.34.2.Рассчитав общую константу равновесия реакции, ответьте, возможны ли реакции:
8.34.1. [Cd(NH3)4]2+ |
+ 4H+ = Cd2+ + 4NH4+. |
Кн = 2, 75 ∙ 10-7 |
Кн = 5,4 ∙ 10-10 |
8.34.2. [Cu(NH3)4]2+ |
+ Cо2+ = [Cо(NH3)4]2+ + Cu+. |
Кн = 9,3 ∙ 10-13 |
Кн = 8,5 ∙ 10-6 |
8.34.3. AgBr↓ + 2NH3 = [Ag(NH3)2]Br .
30
ПР = 5,89 ∙ 10-13 Кн = 8,32 ∙ 10-6
8.34.4. AgBr↓ + 2NaS2O3 = Na3 [Ag(S2O3)2] + NaBr.
Кн = 3,47 ∙ 10-14
Тема 9. Смещение химического равновесия
В соответствии с принципом Ле-Шателье смещение химического равновесия в растворах возможно при изменении концентрации и температуры. Так, реакции гидролиза усиливаются при разбавлении раствора соли и нагревании; диссоциация слабой кислоты подавляется в присутствии сильного электролита, содержащего одноименный ион; комплексный ион разрушается, если его лиганды связываются в более слабый или малорастворимый электролит; малорастворимый электролит растворяется, если при действии реагента один из его ионов образует слабый электролит и т.п.
Пример 1. Как сместить равновесие вправо в системе
HCN = H+ + CN-?
Смесить равновесие вправо, то есть усилить диссоциацию слабой кислоты можно, связав ион водорода щелочью в еще более слабый электролит – воду:
H+ + OH- = H2O.
Пример 2. Как подавить гидролиз (то есть смесить равновесие влево) в реакции:
Sn2+ + 2H2O = Sn(OH)2↓ + 2HCl.
Добавив ионы водорода (то есть кислоту), увеличим концентрацию продукта реакции, тем самым сместим равновесие влево.
31
Пример 3. Как смесить равновесие вправо в системе:
[Ag(NH3)2]+ = Ag+ + 2NH3?
Вданном случае из равновесия можно вывести ион серебра, связав его
вмалорастворимое соединение, например AgJ. Кроме того, аммиак можно связать в слабый электролит NH4+ действием кислоты:
а) [Ag(NH3)2]+ + J- = AgJ↓ + 2NH3;
б) [Ag(NH3)2]+ + 2H+ = Ag++ 2NH4+.
Если в реакции указано 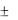 Н, следует варьировать температурой.
Н, следует варьировать температурой.
Как сместить равновесие в равновесных системах?
9.1. Сr3+ + 2H2O = CrO2- + 4H+. |
9.16. CH3COOH = CH3COO- + H+. |
9.2. HCOOH = HCOO- + H+. |
9.17. NH4OH = NH4+ + OH-. |
9.3. Cu2+ + 4NH3 = [Cu (NH3)4]2+. |
9.18. [Zn (OH)4]2- = Zn2+ + 4OH-. |
9.4. [Al (OH)4]- = Al3+ + 4OH-. |
9.19. 2CrO42- + 2H+ = Cr2O72- + H2O. |
9.5. FeCl3 + 3H3O = Fe (OH)3↓ + 3HCl. |
9.20. MgCO3↓ = Mg2+ + CO32-. |
9.6. PbJ2↓ = Pb2+ + 2J- + ΔH. |
9.21. Al (OH)3↓ = Al3+ + 3OH-. |
9.7. BiCl3 + 2H2O = Bi (OH)2Cl↓ + 2HCl. |
9.22. K2S + 2H2O = 2KOH + H2S↑. |
9.8. BaCO3↓ = Ba2+ + CO32-. |
9.23. Co2+ + 4NCS- = [Co (NCS)4]2-. |
9.9 Pb2+ + 2Cl- = PbCl2↓ - ΔH. |
9.24. [Pb (OH)3]- = Pb2+ + 3OH-. |
9.10. Zn (OH)2↓ = Zn2+ + 2OH-. |
9.25. Mg (OH)2↓ = Mg2+ + 2OH-. |
9.11. Sb3+ + 3H2O = Sb(OH)3↓ + 3H+. |
9.26. СrO2- + 4H+ = Cr3+ + 2H2O. |
9.12. PbCl2↓ = Pb2+ + 2Cl- + ΔH. |
9.27. SnCl2 + 2H2O = Sn (OH)2. |
9.13. [Co (NH3)4]2+ = Co2+ + 4NH3. |
9.28. Сr2O72- + H2O = 2CrO42- + 2H+. |
9.14. ZnO22- + 4H+ = Zn2+ + 2H2O. |
9.29. HCN = H+ + CN-. |
9.15. CaSO3↓ = Ca2+ + SO32-. |
9.30. As3+ + 3H2O = AsO33- + 6H+. |
Тема 10. Окислительно-восстановительные реакции в растворах
32
Окислительно-восстановительные реакции (редокс-реакции) в растворах сопровождаются переходом электронов от одних молекул или ионов к другим, что приводит к изменению степени окисления атомов, между которыми происходит такой переход. Процессы с присоединением и с отдачей электронов
Ох1 + ne = Red1; Red2 – ne = Ox2;
рассматривают как полуреакции восстановления и окисления соответственно. В каждой полуреакции вещество в более высокой степени окисления называют окисленной формой Ох, а вещество в более низкой степени окисления – восстановленной формой Red. Окисленная и восстановленная формы вещества составляют сопряженную пару. Полуреакции окисления и восстановления неосуществимы одна без другой: если есть донор электронов, должен быть акцептор. Реально протекает суммарная реакция
Ох1 + Red2 = Red1 + Ox2.
При этом число отдаваемых электронов должно быть равно числу принимаемых.
10.1.Определите, какой процесс (окисление или восстановление) происходит в полуреакции, поставьте знак (+ или -) и количество электронов:
10.1.1.NO3- ± ne + 4H+ = NO + 2H2O.
10.1.2.MnO2 ± ne + 4OH-= MnO42- + 2H2O.
10.1.3.NO2- ± ne + 2H+ = NO + H2O.
10.2.Составьте полуреакции, укажите какому процессу они соответствуют:
10.2.1.MnO4- → Mn2+.
10.2.2.CrO2- → CrO42-.
10.2.3.BrO3- → Br2.
10.3.Определите в правой части уравнения окисленную и восстановленную форму серы:

33
3S + 6KOH = 2K2S + K2SO3 + 3H2O.
10.4.Укажите, в каких из перечисленных соединений хлор проявляет себя только как восстановитель: KClO, KCl, KClO3, HClO4.
10.5.Укажите, какое из перечисленных соединений проявляет себя только как окислитель: KCl, KMnO4, FeCl3, NaNO2, Cl2.
Для определения направления реакции используют значения электродных потенциалов взаимодействующих редокс-пар. В качестве окислителя в реакции всегда будет выступать окислитель той пары, стандартный потенциал (Е0) которой больше, а в качестве восстановителя – восстановитель той пары, потенциал которой меньше. Реакция должна самопроизвольно пойти в том
направлении, для которого разность потенциалов Е0 положительна.
Пример. Будет ли FeCl3 окислять KJ в стандартных условиях?
Решение. По справочным таблицам (Приложение 4) находим необходимые полуреакции и соответствующие им значения Е0.
Fe3+ + ē = Fe2+; |
E0 = 1,51 В; |
J2 + 2ē = 2J-; |
Е0 = 0,54 В. |
Так как стандартный потенциал пары железа больше Е0 пары иода, следовательно, ион Fe3+ является более сильным окислителем, чем J2. Очевидно, уравнение реакции будет следующим:
2FeCl3 + 2KJ = 2FeCl2 + J2 + 2KCl.
Проверим это предположение с помощью расчета электродвижущей силы:
Е = Е0Fe3 /Fe2 E0J |
2 |
/2J = 0,77 – 0,54 = 0,23 В. |
|
|
34
Положительное значение Е свидетельствует о возможности окисления иодид-ионов ионами Fe3+ в стандартных условиях.
10.6. В нижеследующих заданиях определите окислитель и восстановитель, уравняйте окислительно-восстановительную реакцию и рассчитайте ее электродвижущую силу.
10.6.1.CrCl3 + H2O2 + KOH = K2CrO4 + KCl + H2O.
10.6.2.Al + KNO2 + KOH = K3AlO3 + NH3 + H2O.
10.6.3.MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O.
10.6.4.CrCl3 + KMnO4 + H2O = H2CrO4 + MnO2 + KCl + HCl.
10.6.5.Zn + KClO3 + H2SO4 = ZnSO4 + KCl + H2O.
10.6.6.Mn(NO3)2 + NaBiO3 + HNO3 = HMnO4 + Bi(NO3)3 + NaNO3 + H2O.
10.6.7.Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH.
10.6.8.KMnO4 + KJ + H2SO4 = MnSO4 + KJO3 + H2O.
10.6.9.CuS + HNO3 = Cu(NO3)2 + S + NO + H2O.
10.6.10.KMnO4 + H2O2 + H2SO4 = MnSO4 + O2 + K2SO4 + H2O.
10.6.11.KBrO3 + KBr + HCl = Br2 + KCl + H2O.
10.6.12.Bi(OH)3 + Na2SnO2 = Na2SnO3 + Bi + H2O.
10.6.13.Cu + HNO3 = Cu(NO3)2 + NO + H2O.
10.6.14.Zn + HNO3 = NH4NO3 + Zn(NO3)2.
10.6.15.KMnO4 + FeCl2 + HCl = MnCl2 + FeCl3 + KCl + H2O.
10.6.16.K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O.
10.6.17.KMnO4 + NaNO2 + H2SO4 = MnSO4 + NaNO3 + K2SO4 + H2O.
10.6.18.NaBr + MnO2 + H2SO4 = Br2 + MnSO4 + Na2SO4 + H2O.
10.6.19.Zn + KNO2 + KOH = K2ZnO2 + NH3 + H2O.
10.6.20.FeSO4 + HNO3 + H2SO4 = Fe2(SO4)3 + NO + H2O.
10.6.21.K2Cr2O7 + KJ + H2SO4 = Cr2(SO4)3 + J2 + K2SO4 + H2O.
10.6.22.KJO3 + KJ + HCl = J2 + KCl + H2O.
10.6.23.KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O.
10.6.24.FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
10.6.25.KJ + H2O2 + HCl = J2 + KCl + H2O.
10.6.26.KClO3 + FeCl2 + HCl = KCl + FeCl3 + H2O.
10.6.27.Na2SO3 + Na2Cr2O7 + H2SO4 = Cr2 (SO4)3 + Na2SO4 + H2O.
10.6.28.KMnO4 + H2SO4 + H2S = K2SO4 + MnSO4 + S + H2O.
35
10.6.29.Na2SO3 + J2 + H2O = Na2SO4 + HJ.
10.6.30.KClO3 + H2SO3 = KCl + H2SO4.
10.6.31.KJ + NaNO2 + HCl = J2 + NO + KCl + NaCl + H2O.
10.7. Какие из следующих металлов способны вытеснять водород из кислот: Sn, Zn, Hg, Al, Cu?
10. 8. Может ли металлическая медь вытеснить ртуть из растворов солей ртути (II)?
10.9. Можно ли действием Br2 окислить:
10.9.1.J- до J2;
10.9.2.Cl- до Cl2?
10.10. Будет ли происходить окисление железа (II) перманганатом калия в кислой среде, если
[MnO4-] = 0,5 моль/дм3; [Mn2+] = 0,05 моль/дм3; рН = 4; [Fe2+] = [Fe3+] =
1 моль/дм3?
Для решения задачи:
-составьте уравнение редокс-реакции в ионном виде;
-найдите стандартные потенциалы редокс-пар в справочной таблице;
-рассчитайте реальный потенциал для пары марганца по уравнению Нернста;
- рассчитайте Е редокс-реакции и константу химического равновесия.
Тестовые задания для самооценки усвоения основных разделов неорганической химии
Выберите правильный ответ в заданиях 1, 2, 5, 6, 7, 12, 15, 16, 19, 22; укажите соответствие в заданиях 3 – 4, 8 – 9, 10 – 11, 17 – 18; допишите недостающее в заданиях 20 – 23.
1. Fe(OH)2Cl имеет название: |
|
А. Хлорид железа (III). |
Г. Дигидроксохлорид железа (III). |
Б. Гидрохлорид железа (III). |
Д. Гидроксохлорид железа (III). |
В. Дигидрохлорид железа (III). |
|
|
36 |
|
|
|
|
|
|
|
|
|
|
|
2. Молекула N2 образована связями: |
|
|
|
|
|
|
|
|
|
|
|
|
А. 2 сигма, 1 пи. |
Г. 3 пи. |
|
|
|
|
|
|
|
|
|
|
|
Б. 1 пи, 1 сигма, 1 дельта. |
Д. 1 сигма, 2 пи. |
|
|
|
|
|
|
|||||
В. 3 сигма. |
|
|
|
|
|
|
|
|
|
|
|
|
3 – 4. Концентрация раствора. |
Формула ее выражения. |
|||||||||||
|
А. |
T = |
m |
. |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
V |
|
|
|
|
|
|
|||
3. Молярная концентрация |
|
|
|
|
|
|
n(A) |
|||||
|
Б. |
с(А) = |
|
|
. |
|
||||||
эквивалентов |
V |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В. |
Т = |
n |
. |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
V |
|
|
|
|
|
|
||
4. Титр |
|
|
|
|
|
|
|
|
m |
|||
|
Г. |
с(1/zА) = |
|
|
. |
|
||||||
|
|
V |
||||||||||
|
Д. |
с(1/zА) = |
n (1/z A) |
. |
||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
V |
|
5.Растворы слабых электролитов характеризуются понятием: А. Константа гидролиза.
Б. Произведение растворимости. В. Константа ионизации.
Г. Степень гидролиза.
Д. суммарная константа химической реакции.
6.Сильным электролитом является:
А. H2S. |
Б. NH3·H2O. |
В. NaCl. |
Г. [Ag(NH3)2]+. |
|
Д. CH3COOH. |
|
|
|
|
7. Слабым электролитом является: |
|
|
||
А. HNO3. |
Б. H2SO3. В. KJ. |
Г. СH3COONH4. |
Д. NaOH. |
|
8 – 9. Формула протолита. |
Формула расчета рН. |
|
||
8. NaOH |
А. рН = 14 – рОН. |
|
||
|
37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б. рН = |
1 |
рКа |
- |
1 |
lg са. |
||||||||
|
|
|
||||||||||||
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
||
9. NH3 ∙ H2O |
B. рН = 14 - |
|
1 |
|
рКb + |
|
1 |
lg сb. |
||||||
2 |
|
2 |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
Г. рН = - lg ca. |
|
|
|
|
|
|
|
||||||
|
Д. рН = 7 + |
1 |
|
|
рКb + |
1 |
|
lg cb. |
||||||
|
2 |
|
|
2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
10 – 11. Реакция среды. |
Соль. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А. Na2SO3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
10. Кислая |
Б. NaCl. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В. K2SO4. |
|
|
|
|
|
|
|
|
|
|
|
|
|
11. Щелочная |
Г. NH4Cl. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Д. NaNO3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
12. Сущность буферного действия заключается в связывании Н+ и ОН- компонентами буфера в соединения:
А. Слабая кислота, слабое основание, вода.
Б. Вода, сильная кислота, сильное основание. В. Сильное основание, слабая кислота, вода. Г. Вода, слабое основание, сильная кислота.
Д. Сильная кислота, слабое основание, малорастворимое соединение.
13 – 14. Формула малорастворимого |
Формула расчета растворимости. |
||||||||||
соединения. |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
A. |
|
|
ПР . |
|||||||
13. AgCl |
|
|
|
|
|
|
|
|
|
|
|
Б. |
|
Пр . |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
В. |
3 |
|
|
Пр |
. |
|||||
|
|
|
|
|
|||||||
|
|
|
22 |
|
|
|
|
|
|||
14. PbCl2 |
|
|
|
|
|
|
|
|
|
||
Г. |
|
|
|
|
Пр |
||||||
|
3 |
|
3 . |
||||||||
|
|
|
3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
Д. |
|
|
|
Пр |
. |
|||||
|
|
|
|
|
|||||||
|
|
|
4 |
|
|
|
|
|
|||
38
15. Осаждение анионов нитратом серебра при их одинаковой концентрации происходит в последовательности:
А. ПРAg2SO4 = 1,6 ∙ 10-5. Б. ПРAg2CO3 = 1,2 ∙ 10-12. В. ПРAg2С2O4 = 3,5 ∙ 10-11. Г. ПРAg2S = 2,1 ∙ 10-50.
Д. ПРAg2SO3 = 1,5 ∙ 10-14.
16. Смещение равновесия вправо в гетерогенной системе CaCO3↓ = Ca2+ + CO32- достигается добавлением реактива:
|
А. Избыток щелочи. |
Г. Хлороводородная кислота. |
|
Б. Избыток аммиака. |
Д. Хлорид кальция. |
|
В. Горячая вода. |
|
17 – 18. Окислительно-восстановительные |
Формула соединения. |
|
свойства веществ. |
|
|
|
|
А. H2S. |
17. |
Только окислитель |
Б. NaNO2. |
|
|
В. KMnO4. |
18. |
Только восстановитель |
Г. H2O2. |
|
|
Д. K2SO4. |
19. Степень окисления центрального атома-комплексообразователя в соединении Cu2 [Fe(CN)6] равна:
А. +3. Б. -3. В. +2. Г. +4. Д. +6.
20.K3 [Al(OH)6] по химической номенклатуре называют ……………..
21.Гексахлороплюмбат (IV) аммония имеет формулу ………………..
22.Константа нестойкости комплексного иона [Pt (H2O) (NH3)2OH]+ имеет выражение………………..
39
23. Координационное число центрального атома в комплексном соединении Na3 [Ag (S2O3)2] равно:
А. 2. Б. 6. В. 4. Г. 8. Д. 1.
40
ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Задания по аналитической химии включают темы 11 – 19
Тема 11. Качественный анализ. Реакции катионов 1 – 3 аналитических групп
11.1.Какой принцип разделения на группы лежит в основе кислотноосновной классификации катионов?
11.2.Какие катионы входят в состав 1, 2, 3 аналитических групп?
11.3.Можно ли действием HCl, H2SO4, NaOH осадить катионы первой аналитической группы?
11.4.Как открыть катион аммония, используя его специфическую реакцию?
11.5.Какой катион первой группы можно обнаружить в их смеси действием раствора щелочи?
11.6.Можно ли обнаружить ион калия с гидротартратом натрия в кислой или щелочной среде? Ответ обоснуйте, используя принцип смещения равновесия. Укажите аналитический эффект реакции.
11.7.Каким образом можно обнаружить катионы калия и натрия, не используя реактивы? Как этот способ называется? Каков аналитический эффект для каждого катиона?
11.8.При каких условиях можно обнаружить ион натрия с гексагидроксостибатом (V) калия? Приведите соответствующее уравнение реакции, укажите аналитический эффект. Как повысить чувствительность этой реакции?
11.9.Каков аналитический эффект обнаружения иона калия с гексанитрокобальтатом (III) натрия. Напишите уравнение реакции, укажите условия ее проведения.
11.10.Приведите уравнение реакции, лежащей в основе обнаружения иона калия микрокристаллоскопическим методом. Укажите аналитический эффект.
11.11.Приведите уравнение реакции обнаружения (и аналитический эффект) иона аммония с реактивом Несслера.
41
11.12.Ион калия находится в растворе с рН 10. Можно ли его обнаружить по реакции с гидротартратом натрия?
11.13.Какая реакция называется специфической? У какого катиона первой группы имеется такая реакция? Составьте уравнение соответствующей реакции и укажите ее аналитический эффект.
11.14.Какие катионы можно обнаружить «сухим путем»?
11.15.Что собой представляет реактив Несслера и какой катион первой аналитической группы можно им обнаружить? Приведите уравнение реакции и аналитический эффект.
11.16.Каким групповым реактивом осаждают катионы второй аналитической группы? Что общего у этих осадков?
11.17.Чем отличаются между собой хлориды катионов второй аналитической группы?
11.18.Можно ли обнаружить ион свинца действием HCl в горячем растворе?
11.19.В чем растворяется AgCl? Составьте соответствующее уравнение реакции.
11.20.Чем отличается осадок PbJ2 от AgJ? Что собой представляет реакция «золотого дождя»?
11.21.Что общего и в чем отличие осадков хроматов серебра и свинца?
11.22.Как доказать наличие иона серебра в комплексном ионе [Ag(NH3)2]+? Составьте соответствующее уравнение равновесия для комплекса и покажите, с помощью каких реагентов его можно сместить и обнаружить ион серебра.
11.23.Можно ли, действуя избытком щелочи на катионы второй группы, отделить ион свинца?
11.24.Чем отличается сульфат свинца от сульфатов бария и кальция?
11.25.Какой катион второй аналитической группы можно открыть по окислительно-восстановительной реакции с Cu?
11.26.В чем отличие хлорида ртути (I) от хлорида серебра при их взаимодействии с избытком аммиака?
11.27.Можно ли обнаружить ион ртути (I) в присутствии других ионов второй группы по реакции с избытком аммиака?
11.28.Каковы аналитические эффекты взаимодействия катионов второй аналитической группы с хроматом калия?
42
11.29.Какие соединения образуют катионы второй аналитической группы с избытком щелочи?
11.30.Чем отличаются по внешнему виду осадки иодидов серебра, свинца и ртути (I)?
11.31.Какой групповой реактив у катионов третьей аналитической группы?
11.32.Каковы общие свойства у сульфатов катионов третьей аналитической группы?
11.33.Можно ли обнаружить ион кальция в кислой среде с помощью оксалата аммония?
11.34.Как «сухим путем» обнаружить ионы бария и кальция?
11.35.Каковы свойства хромата бария?
11.36.Можно ли обнаружить ион кальция с помощью оксалата аммония в присутствии иона бария?
11.37.При каких условиях можно обнаружить ион бария с помощью дихромата калия?
11.38.Можно ли получить осадок сульфата бария, если подействовать на
раствор BaCl2 насыщенным раствором CaSO4 (ПРBaSO4 = 1,1 ∙ 10-10; ПРCaSO4
= 2,5 ∙ 10-5)?
11.39.Растворится ли BaSO4 в разбавленной минеральной кислоте? Ответ поясните.
11.40.В чем отличие BaSO4 от PbSO4?
Тема 12. Качественный анализ. Реакции катионов 4 – 6 аналитических групп
12.1.По какому принципу выделены катионы в четвертую аналитическую группу? Перечислите катионы.
12.2.Чем отличаются гидроксиды четвертой группы от гидрооксидов пятой и шестой аналитических групп?
12.3.Гидроксид какого катиона четвертой группы растворяется в избытке аммиака? Запишите соответствующее уравнение реакции.
12.4.Какой катион четвертой группы отсутствует, если раствор не окрашен?
43
12.5.Какие катионы четвертой группы можно обнаружить по реакциям окисления – восстановления? Приведите примеры реакций.
12.6.Как обнаружить ион олова (II), используя его восстановительные свойства?
12.7.Учитывая, что соли олова (II) легко гидролизируются при растворении в воде с образованием осадка, предложите вариант получения раствора соли (без осадка).
12.8.Какие реакции комплексообразования используют для обнаружения иона алюминия? Какой это тип комплексов? Запишите соответствующие уравнения реакций, укажите способ проведения и аналитический эффект.
12.9.Как обнаружить ион хрома (III), последовательно окисляя его до надхромовой кислоты?
12.10.Какой катион четвертой группы можно обнаружить с помощью K4[Fe(CN)6]? Каков аналитический эффект реакции?
12.11.Чем отличаются гидроксиды пятой аналитической группы от гидроксидов четвертой группы?
12.12.Какие катионы пятой группы можно отличить по цвету свежеосажденного гидроксида?
12.13.Приведите реакции обнаружения висмута (III), используя его способность к комплексообразованию.
12.14.Приведите реакции обнаружения висмута (III), используя его окислительные свойства.
12.15.Какой катион пятой аналитической группы можно обнаружить по реакции гидролиза?
12.16.Как обнаружить ион железа (II), используя его способность к образованию комплексов – хелатов?
12.17.По каким реакциям можно отличить ионы железа (II) от ионов железа (III)?
12.18.С какими реагентами ион железа (III) образует окрашенные комплексы? Приведите уравнения реакций и аналитический эффект.
12.19.Приведите окислительно-восстановительную реакцию обнаружения иона марганца (II).
44
12.20.Приведите уравнение реакции, укажите условия и аналитический эффект обнаружения ион магния с гидрофосфатом натрия.
12.21.По какому принципу и какие катионы выделены в шестую аналитическую группу?
12.22.Приведите формулу и укажите цвета аммиакатов катионов шестой аналитической группы.
12.23.Какие катионы шестой группы отсутствуют, если исследуемый раствор бесцветен?
12.24. Какой катион присутствует, если раствор окрашен а) в розовый; б) в голубой; в) в зеленый цвет?
12.25.Как обнаружить ион меди (II) в присутствии всех катионов шестой группы?
12.26.Какие реакции комплексообразования используют для обнаружения иона кобальта (II)?
12.27.В чем отличие иодида ртути (II) от иодида ртути (I)?
12.28.Как обнаружить ион ртути (II) в присутствии всех катионов шестой группы?
12.29.Можно ли обнаружить ион никеля (II) с помощью реактива Чугаева в присутствии иона железа (II)? Приведите условия проведения реакции и аналитический эффект.
12.30.В чем отличие аналитических форм ионов кальция, цинка, железа (III) и меди (II), получаемых с реактивом K4 [Fe(CN)6]?
Тема 13. Качественный анализ. Реакции анионов
13.1.Какие реакции осаждения используют для разделения анионов на три группы? В какой среде можно отделить анионы первой группы от второй?
13.2.Какой анион может осаждаться хлоридом бария в кислой среде?
13.3.Чем отличаются малорастворимые соли серебра анионов второй группы от анионов первой группы?
13.4.Какие анионы не осаждаются хлоридом бария и нитратом серебра?
13.5.Как подразделяют анионы по их способности к участию в окислительно-восстановительных реакциях?
45
13.6.Какие анионы будут обесцвечивать подкисленный раствор KMnO4?
13.7.Какие анионы можно обнаружить по их способности выделять газ при взаимодействии с кислотой?
13.8.Как обнаружить тиосульфат-ион с помощью HCl в присутствии сульфит - иона?
13.9.Какие анионы могли присутствовать в растворе, если при добавлении к нему иодида калия и подкислении выделился J2?
13.10.Как обнаружить иодид- и бромид - ионы по реакции с хлорной водой? Как повышают чувствительность этой реакции?
13.11.Можно ли обнаружить фосфат - ион в кислой среде действием хлорида бария?
13.12.Как обнаружить нитрат - ион по реакции восстановления металлами?
13.13.По какой реакции можно отличить нитрит - ион от нитрат - иона?
13.14.Что образуется при взаимодействии тетраборат - иона с этанолом в кислой среде? Каковы условия получения аналитического эффекта?
13.15.С помощью каких реакций можно обнаружить ацетат - ион?
13.16.С каким анионом нитрат серебра образует осадок желтого цвета,
растворимый в азотной кислоте?
13.17.Какой органический реагент при взаимодействии с нитрат- и нитритионом дает одинаковый аналитический эффект?
13.18.Какие анионы будут осаждаться нитратом серебра: а) в нейтральной среде; б) в кислой среде?
13.19.Как обнаружить фосфат - ион с магнезиальной смесью?
13.20.Как обнаружить ацетат - ион, используя способность карбоновых кислот образовывать эфиры?
Тестовый контроль для самооценки усвоения реакций обнаружения катионов и анионов
1. Групповым реагентом для катионов Ca2+, Ba2+, Sr2+ является:
А. NaOH. Б. H2SO4. В. H3PO4. |
Г. HCl. |
Д. NH3 ∙ H2O. |
|
|
|
|
46 |
|
|
2. |
Реагентом для обнаружения иона натрия является: |
|
||||
|
А. K [Sb (OH)6]. |
Б. KOH. В. Реактив Несслера. |
Г. Na3 [Co (NO2)6]. |
|||
|
Д. NaHC4H4O6. |
|
|
|
|
|
3. |
По реакции гидролиза можно обнаружить ион: |
|
||||
А. NH4+ . |
Б. Ca2+. |
В. Bi3+. |
Г. Pb2+. |
Д. Mn2+. |
||
4. |
Реакцию «золотого дождя» с KJ дает ион: |
|
|
|||
А. Ca2+. |
Б. Ag+. |
В. Pb2+. |
Г. Bi3+ . |
Д. Hg2+. |
||
5. |
Раствор KMnO4 |
в кислой среде обесцвечивает анион: |
|
|||
А. СO32- . |
Б. SO42-. В. CH3COO-. |
Г. SO32-. |
Д. B4O72-. |
|||
6. |
AgNO3 |
в кислой среде осаждает ион: |
|
|
||
А. SO32- . |
Б. Br-. |
В. S2O32-. |
Г. PO42- . |
Д. CO32-. |
||
7.Аналитическим эффектом обнаружения нитрат - ионов с дифениламинам является:
А. Образование осадка голубого цвета. Б. Выделение газа.
В. Появление синего окрашивания раствора. Г. Появления красного окрашивания раствора. Д. Образование кристаллов черного цвета.
8.Аналитическим эффектом обнаружения иона меди с избытком раствора аммиака является
А. Образование белого осадка.
Б. Появление голубой окраски раствора.
В. Появление сине - фиолетовой окраски раствора.
47
Г. Выделение металлической меди. Д. Образование голубого осадка.
9. Осадок хлорида серебра растворим в паре реактивов: А. В азотной кислоте и щелочи.
Б. В щелочи и уксусной кислоте. В. В уксусной кислоте и аммиаке.
Г. В аммиаке и тиосульфате натрия.
Д. В тиосульфате натрия и серной кислоте.
10 – 11. |
Групповой реагент. |
Осаждаемый ион. |
|
|
А. Ba2+. |
10. HCl |
Б. Na+. |
|
|
|
В. Al3+. |
11. H2SO4 |
Г. Ag+. |
|
|
|
Д. Zn2+. |
12 – 13. |
Аналитический реагент. |
Обнаруживаемый ион. |
|
|
А. K+. |
12. |
K2CrO4 |
Б. Fe3+. |
|
|
В. Ag+. |
13. |
NH4NCS |
Г. Mg2+. |
|
|
Д. Fe2+. |
14 – 15. |
Обнаруживаемый ион. |
Окраска пламени горелки. |
|
|
А. Желтая. |
14. |
K+. |
Б. Зеленая. |
|
|
В. Фиолетовая. |
15. |
Na+. |
Г. Красная. |
|
|
Д. Красно-бурая. |
|
|
48 |
16 – 17. |
Обнаруживаемый ион. |
Реагент. |
|
|
А. HCl. |
16. NH4+. |
Б. (NH4)2C2O4. |
|
|
|
В. H2O2. |
17. Ca2+. |
Г. K2[HgJ4] + KOH. |
|
|
|
Д. KJ. |
18 – 19. |
Обнаруживаемый ион |
Аналитический эффект. |
по реакции с K4[Fe(CN)6]. |
|
|
|
|
А. Осадок синего цвета. |
18. |
Cu2+ . |
Б. Осадок белого цвета. |
|
|
В. Осадок красно-бурого цвета. |
19. |
Fe3+. |
Г. Синее окрашивание раствора. |
|
|
Д. Осадок зеленого цвета. |
20 -21. Обнаруживаемый ион. |
Аналитический эффект при действии |
|
|
|
кислоты. |
20.SO32-.
21.S2O32-.
22 – 23. Обнаруживаемый ион.
22.CH3COO-.
23.PO43 -.
А. Выпадение осадка.
Б. Выделение бесцветного газа и помутнение раствора.
В. Выделение бесцветного газа. Г. Появление окраски раствора. Д. Выделение бурого газа.
Реагент.
А. MgCl2 + NH4OH + NH4Cl.
Б. NH3 ∙ H2O + NH4Cl.
В. C2H5OH + H2SO4.
Г. Na2CO3 + NaOH.
Д. K2[HgJ4] + KOH.
