
1.Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
Химия – наука о строении, свойствах в-в, их превращениях и сопровождающих явлениях.
Предмет химии – химические элементы и их соединения, а так же закономерности, которым подчиняются различные химические реакции.
Задачи:
•Изучение современных представлений о строении в-ва.
•Изучение в-в, свойства и строение которых зависят от положения в периодической системе.
•Изучение природы хим реакции, используемых в производстве хим в-в.
•Изучение подходов к описанию хим процессов с целью оптимизировать условия их практической оптимизации.
Цель: получение в-в с заданными свойствами.
Химизация народного хозяйства не только количественно, но и качественно изменяет различные отрасли промышленности. Так, в машиностроении все чаще производят изделия из пластических масс, синтетических смол, каучуков и их комбинаций с древесиной, керамикой, металлами. Следовательно, вместо режущих станков появляется необходимость в машинах, способных придавать заданную форму путем литья, вальцевания и т. д. Принципиально изменяются некоторые отрасли легкой промышленности. Например, пошив одежды и обуви заменяется склеиванием их и сваркой из новых синтетических материалов.
Коллоидная химия играет важную роль в развитии науки, промышленности и сельского хозяйства. Большое значение коллоидная химия имеет для биологической и медицинской науки, так как растительные и животные организмы в своем составе содержат сложные коллоидные системы, например кровь, молоко, а жизненные процессы носят коллоидно-химический характер. Трудно назвать отрасль промышленности, где бы коллоидная химия не находила применения.
2. Основные понятия химии
Атом – наименьшая частица химического элемента сохраняющая все его основные свойства. Состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Химический элемент – вид атомов с одинаковым положительным зарядом ядра.
118 химических элементов, 92 – в природе.
Молекула – наименьшая частица вещества способная существовать самостоятельно и сохранять его основные свойства.
Формульная масса – сумма атомных масс всех элементов входящих в соединение с учетом числа каждого элемента в формуле.
3. Основные понятия химии.
Моль – кол-во в-ва содержащее столько структурных элементарных единиц (атомов, молекул…) сколько содержится атомов в 12 гр изотопа 12С.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих его, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Относительная атомная масса (Ar) - безразмерная величина, показывает во сколько раз масса атома больше 1/12массы атома 12C.
1 а.е.м= 1.66·10−27 (кг)
Эквивалент – это некая реальная или условная частица, которая может присоединять, высвобождать или быть каким либо другим образом эквивалентно одному иону Н в кислотно-основных реакциях или одному электрону в овр.
4. Основные стехиометрические законы.
Закон сохранения массы:
Масса в-в вступивших в реакцию равна массе в-в образовавшихся после реакции.
Закон постоянства состава:
Всякое чистое вещество независимо от способа его получения имеет постоянный количественный и качественный состав.
Закон эквивалентов:
Массы реагирующих друг с другом в-в, а так же массы продуктов этой реакции пропорциональны массам эквивалентов этих веществ.
5. Газовые законы: Г. Люссака, Авогадро, объединенный газовый закон.
Закон объемных отношений Г. Люссака:
При неизменной температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образовавшихся газообразных продуктов, как небольшие целые числа.
Закон Авогадро:
В равных объемах различных газов при одинаковых условиях (t, p) содержится равное число молекул.
Объединенный газовый закон:
Объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так: P1V1 / T1 = P2V2 / T2
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева:
PV= (m/M) RT
где m - масса газа; M - молекулярная масса; P - давление; V - объем; T - абсолютная температура (К); R - универсальная газовая постоянная 8,314 Дж/(моль·К).
Для данной массы конкретного газа отношение m/M постоянно, поэтому из уравнения Клайперона-Менделеева получается объединенный газовый закон.
6.Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
В1897 г. английским физиком Дж. Томсоном были открыты электроны. Он изучал катодные лучи, возникающие при электрическом разряде в сильно разреженных газах. Изучение свойств этих лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света, т.е. поток электронов.
Атом, по Томсону, состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий электрически отрицательные заряды электронов, образно — подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по объёму всего атома. Согласно этой модели, электроны могли свободно вращаться в такой положительно заряженной субстанции. Их орбиты удерживались внутри атома тем, что при удалении электрона от центра положительно заряженного облака, он испытывает увеличение силы притяжения к центру облака, возвращающей его обратно. Положительных частиц эта молекула не предполагала и невозможно было объяснить испускание положительно заряженных альфа-частиц радиоактивными веществами.
В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфачастиц в газах и других веществах была обнаружена положительно заряженная часть атома. Он предложил следующую схему строения атома (планетарная модель):
•В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых
сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
В 1913 году свою модель атома предложил Н. Бор, за основу он брал планетарную модель. Однако электрон в модели Резерфорда, двигаясь вокруг ядра, должен был как бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую.
Современная модель строения атома:
1.В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (например, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5.10-7 нм).
2.Положительный заряд и почти вся масса атома сосредоточены в ядре атома.
3.Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу.
4.Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра.
7. Характеристика основных квантовых чисел.
Четыре квантовых числа описывают состояние электрона в атоме, характеризуют его энергию, спин, формулу электронного облака и его ориентацию в пространстве.
Главное квантовое число – n:
•определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число – L:
•определяет геометрическую форму атомной орбитали. Имеет значения от 0,1,2,3…(n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы.
0=s, 1=p, 2=d, 3=f
Магнитное квантовое число - m:
•определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от -l до +l, включая 0.
Для s-орбитали:
l=0, m=0 - одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, m=-1,0,+1 - три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, m=-2,-1,0,1,2 - пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, m=-3,-2,-1,0,1,2,3 - семь равноценных ориентаций в пространстве (семь орбиталей).
Спиновое квантовое число – ms (s):
•определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и -1/2
Принцип Паули:
– в атоме не может быть 2 электронов у которых все 4 квантовые числа были бы одинаковыми.
8. Важнейшие классы и номенклатура неорганических веществ.
Все в-ва в природе делят на простые и сложные. Простые вещества состоят из атомов одного элемента, например S, O2, Cl2, Na, P. Простые вещества разделяют на металлы и неметаллы. Это деление основано на различиях в физических свойствах простых веществ.
В состав сложных в-в входят два или более элемента (например, Н2О, НСl, Н3РО4, Na2CO3). Сложные вещества делятся на органические и неорганические.
Органическими принято называть соединения углерода (например, СН3СООН - уксусная кислота, С2Н5ОН - этиловый спирт). Простейшие соединения углерода (СО, СO2, Н2СО3 и карбонаты, HCN и цианиды, карбиды и некоторые другие) обычно рассматривают в курсе неорганической химии.
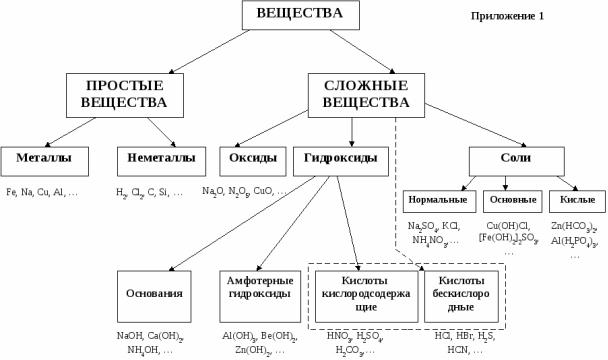
Все остальные вещества называются неорганическими (иногда - минеральными). Неорганические вещества делятся на пять главных классов: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Кислородсодержащие кислоты, основания и амфотерные гидроксиды по своей природе можно объединить в самостоятельный класс гидроксидов.
Бинарные соединения – на первом месте стоит Ме, как наиболее электроположительный элемент. Если бинарные соединения не содержат Ме, то на первое место помещается более электроотрицательный элемент.
Галогениды — соединения галогенов с другими химическими элементами. При этом галоген, входящий в соединение, должен быть более электроотрицательным, чем другой элемент соединения.
Оксиды:
1)солеобразующие – оксиды, которые при химических реакциях с кислотами основаниями образуют соль и воду.
2)несолеобразующие – оксиды неМе которые не имеют соответствующих гидроксидов и не вступают в реакции солеобразования (CO, NO, N2O, SiO).
Солеобразующие оксиды делятся на:
1)основные оксиды;
2)кислотные оксиды;
3)амфотерные оксиды, которые могут реагировать и как кислотные, и как основные оксиды (ZnO, PbO, Al2O3 , Cr2O3 ).
Пероксиды — сложные вещества, в которых атомы кислорода соединены друг с другом. Содержащие пероксогруппу —О—О— (например, пероксид водорода Н2О2, пероксид натрия Na2O2). В пероксидах кислород имеет степень окисления −1. (надпероксиды 1\2, озониды 1\3)
Халькогениды – бинарные соединения элементов 6 группы с менее электороотрицательными элементами (CdS, H2Te)
Нитриды – соединения азота с менее электроотрицательными элементами. Нитриды Ме – это твердые кристаллические в-ва, с высокими t кипения.
Гидриды – соединения Н2 с Ме (твердые хрупкие в-ва) или неМе (ковалентные соединения, многие газообразны, разлагаются водой с образованием к-т).
Интерметаллиды – хим соединения двух или нескольких Ме ( хрупкие в-ва со смешанным типом межатомной связи – металлическая, ионная, ковалентная ).
Гидроксиды – это сложные многоэлементные химические соединения, в состав которых входят атомы какого-либоэлемента, кислорода и водорода.Химический характер гидроксидов определяется свойствами соответствующих им оксидов. Поэтому гидроксиды делятся на три большие группы:
1.Гидраты кислотных оксидов, называемые кислотами, например, H2SO4.
2.Гидраты основных оксидов, называемые основаниями, например, Ba(OH)2.
3.Гидраты амфотерных оксидов, называемые амфотерными гидроксидами, например,
Be(OH)2.
Основания – сложные в-ва состоящие из Ме и одной или нескольких гидроксильных групп ( тв кристаллические в-ва, реагирующие с кислотами и кислотными оксидами с образованием солей ).
Кислоты – сложные в-ва состоящие из кислотных остатков и одного или нескольких атомов водорода, способных замещаться на атомы Ме.
Номенклатура.
В соответствии с ЮПАК сначала называется электороположительная часть, затем электоотрицательная.
Названия оксидов
Названия оксидов в соответствии с номенклатурными правилами образуются из слова «оксид» и названия оксидообразующего элемента в родительном падеже, например, СаО – оксид кальция, К2О – оксид калия.
В случае, когда элемент обладает переменной степенью окисления и образует несколько оксидов, после названия этого элемента указывают его степень окисления
римской цифрой в скобках, или прибегают к помощи греческих числительных (1- моно,2-ди,3-три,4-тетра,5-пента,6-гекса,7-гепта,8-окта). Например:
VO – оксид ванадия (II) или монооксид ванадия;
V2O3 – оксид ванадия (III) или триоксид диванадия;
VO2 – оксид ванадия (IV) или диоксид ванадия;
V2O5 – оксид ванадия (V) или пентаоксид диванадия.
9. Периодический закон и периодическая система элементов.
Периодический закон:
Свойства простых в-в и соединений, которые они образуют, находятся в периодической зависимости от величины атомного номера элемента.
Периодический закон позволил систематизировать свойства химических элементов и их соединений.
Элементы со сходной электронной конфигурацией внешних энергетических уровней обладают сходными химическими свойствами.
Период – последовательный ряд элементов расположенных в порядке возрастания заряда ядер их атомов, в котором электронная конфигурация меняется от ns1 до ns2np6.
Важнейшие свойства элементов:
•Радиусы
•Энергия ионизации
•Сродство к электрону
•Электоотрицательность
Атом не имеет сторого определенных границ, его точные размеры определить не возможно. В химической практике чаще всего используют эффективные радиусы (рассчитаны экспериментально). На размер радиуса оказывают влияние структура в- ва, характер связи, СО. Поэтому различают атомные (ковалентные и металлические) и ионные радиусы.
Металлический радиус – половина расстояния между ядрами соседних атомов Ме.
Ковалентный радиус – половина расстояния между атомами соседних атомов неМе.
Ионный радиус – характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие "ионный радиус" основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке.
Радиусы положительных ионов всегда меньше радиусов отриц ионов и наоборот.
Изменение атомных радиусов в группах меньше, чем в периодах; в группах изменение немонотонно.
Энергия ионизации – это минимальная энергия для удаления электрона. Максимальное значение имеют инертные газы, минимальное – щелочные Ме.
Сродство к электрону – называют энергию, выделяющуюся или поглощающуюся в процессе присоединения электрона к свободному атому в его основном состоянии с превращением его в отрицательный ион A-.
Электроотрицательность – способность атомов удерживать внешние электроны. Не является абсолютной константой и зависит от эффективного заряда ядра атома, который может меняться под влиянием соседних атомов, типов атомных орбиталей и характера их гибридизации.
10. Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
Ковалентная связь – это тип химической связи между двумя атомами, возникающий при обобществлении электронов, которые принадлежат этим атомам.
•Ковалентная связь образуется между двумя атомами за счет двух электронов с антипараллельными спинами
•Связь располагается в том направлении, в котором возможность перекрывания электронных облаков наибольшая
•Является тем более прочной, чем более плотно перекрываются электронные облака
Способы образования:
Обменный механизм – образование за счет неспаренных электронов одного и второго атомов.
Донорно-акцепторный механизм (частный случай ковалентной связи) – образование за счет неподеленной пары одного атома и вакантной орбитали другого атома.
Свойства ковалентной связи:
•Насыщаемость
•Направленность
•Поляризуемость
•Полярность ( полярная к. с., неполярная к. с.)
Насыщаемость – это свойство состоит в том, что образование электронной пары исключает участие этой пары в других химических взаимодействиях. Благодаря этому ковалентные соединения имеют строго определенный состав.
Направленность – это способность обеспечивать максимальное перекрывание облаков.
Поляризуемость – способность электронной оболочки атома деформироваться под воздействием внешнего поля. В качестве этого поля могут выступать ионы или полярные молекулы.
11. Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
Гибридизация – это процесс выравнивания орбиталей по форме и энергии.
s-связь – ковалентная связь, образованная за счет перекрывания атомных орбиталей атомных орбиталей вдоль линии связи.
π-cвязь – ковалентная связь, возникающая при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов.
Если в образовании химической связи одновременно участвуют s и p (p и d) одного и того же энергетического уровня то можно вести речь о гибридизации.
