
Термодинамика. Методичка
.pdf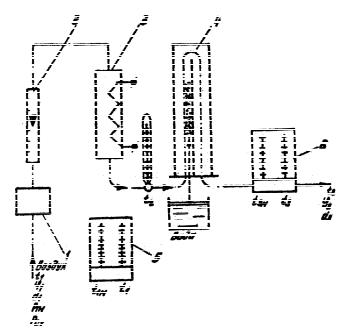
Испарение влаги в сушильной камере осуществляется за счет
теплоты, отдаваемой нагретым воздухом.
Рис. 3. Схема экспериментальной установки
1 – вентилятор, 2 – ротаметр, 3 нагревательная камера, 4 – сушильная камера, 5, 6 – психрометры.
2.Замерить и занести в Таблицу 1 показания психрометра 5 (t1 и t1м), установленного на входе в установку, и показания ротаметра 2 (П).
3.По показаниям ротаметра П с помощью градуировоч-
ного графика определить расход воздуха V , м3/ч.
4. По достижении температуры воздуха t2 40-50 С после нагревательной камеры 3 записать показания психрометра 6 (t3 и t3м), установленного на выходе из сушильной камеры 4.
Таблица 1
23
П |
V , |
t1, C |
t1м, С |
t2, С |
t3, С |
t3м, С |
В, мм |
|
3 |
/ч |
рт.ст. |
||||||
|
м |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Обработка опытных данных
1. На основе показаний психрометров 5 и 6 по психрометрической таблице (Приложение) определить относительную влажность входящего 1и выходящего из установки влажного воздуха 3 .
2. По Hd-диаграмме определить:
для точки 1 (на основе t1 и 1): энтальпию Н1 и влагосодержание d1 входящего воздуха, парциальное давление водяного пара р1п в этом воздухе;
для точки 2 (на основе d2 = d1 и t2): энтальпию Н2 воздуха после нагревания ;
для точки 3(на основе t3 и 3 ): влагосодержание d3 воздуха,
уходящего из установки.
р1в. |
|
3. По уравнению (2) рассчитать парциальное давление |
|||||||||||||||||||
|
Полученное |
значение |
перевести |
|
|
в |
Па |
||||||||||||||
(750 мм рт.ст. = 105 Па). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
4. Заполнить Таблицу 2. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
Н1, |
|
d1, |
|
р1п, |
р1с.в., |
|
|
Н2, |
|
3 |
, |
|
d3, |
|
|
||||
1 |
|
кДж |
|
г влаги |
|
мм |
Па |
|
|
|
кДж |
|
|
|
г влаги |
|
|
||||
% |
|
|
|
|
|
|
рт.ст. |
|
|
|
|
. |
% |
|
|
|
|
||||
кг сух. возд. |
кг сух. возд. |
|
|
|
|
кг сух. возд |
|
кг сух. возд. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
5. Рассчитать массовый расход сухого воздуха по урав- |
|||||||||||||||||||
нению Клапейрона-Менделеева: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
p |
V |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
1с.в. |
|
|
|
, кг/ч, |
|
|
|
|
|
|
|
||||
|
|
|
|
mс.в. |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
R T |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
в |
|
|
|
|
|
|
|
|
|
|
|
|
где |
p1с.в. В p1п. – парциальное давление сухого воздуха, Па; |
||||||||||||||||||||
V – объемный расход воздуха, определяемый по градуировоч-
24
ному графику, м3/ч. Rв = 287 Дж/(кг К) – газовая постоянная сухого воздуха.
6.Рассчитать количество теплоты, полученной нагретым воздухом в нагревательной камере, по уравнению (10).
7.Определить массу влаги Мп, полученную нагретым воздухом от высушивания материала, по уравнению (11).
8.Рассчитать затраты теплоты по уравнению (12) и расход сухого воздуха по уравнению (13) на испарение 1 кг влаги.
9.Построить линии процессов нагревания воздуха (1-2)
исушки нагретым воздухом (2-3) на Hd-диаграмме (без соблюдения масштаба).
10. |
Определить температуру точки росы tросы при охла- |
||
ждении (d=const) из состояний т.т.1 и 3. |
|||
11. |
Определить систематическую погрешность измере- |
||
ния температуры воздуха t1 |
на входе в установку и t3 на выходе |
||
из неё: |
|
t |
|
|
t |
100%, |
|
|
|
||
|
t |
||
|
|
|
|
где t абсолютная погрешность измерения температуры,
принимаемая равной половине цены деления шкалы прибора. Подробно материал к этому пункту изложен в разделе
«Оценка погрешности эксперимента».
Контрольные вопросы
1.Понятие «влажный воздух». Особенности изменения состояния влажного воздуха, связанные с присутствием в нем водяных паров.
2.В каких состояниях могут находиться водяные пары во влажном воздухе.
3.Понятие о температуре точки росы. Методика определения tросы по Hd-диаграмме.
4.Основные параметры влажного воздуха. Определе-
ние d, , H, pn и pв, размерности этих величин.
25
5.Устройство, назначение и принцип действия психро-
метра.
6.Hd-диаграмма влажного воздуха. Графическое представление процессов нагревания и сушки воздухом влажных материалов.
7.Методика расчета количества теплоты, затраченной на нагревание воздуха. Цель нагревания.
8.Методика расчета массы влаги, отводимой от высушиваемого материала в процессе сушки.
9.Методика расчета теплоты и сухого воздуха на испарение 1 кг влаги.
10.Какое количество влаги в воздухе при данной темпе-
ратуре показывают линии =70% и =100%.
11. Понятие о погрешностях измерения, источники погрешностей. Методика расчета систематических погрешностей измерения температур воздуха на входе в установку и на входе из неё.
26

Приложение
Психрометрическая таблица влажного воздуха
27

Лабораторная работа № 22
Определение теплоемкости воздуха
Цель работы: Ознакомиться с понятием теплоемкости вещества, освоить технику измерения величин, необходимых для определения теплоемкости воздуха методом проточного калориметрирования.
Задание
1.Провести опыты по определению удельной изобарной теплоемкости воздуха при тепловом режиме, указанном преподавателем.
2.Рассчитать средние значения теплоемкостей сpm и сvm, изменения внутренней энергии u , энтальпии h и энтропииS , а также показатель адиабаты воздуха k в условиях опыта.
3.Рассчитать значения сp и сv, используя молекулярнокинетическую теорию теплоемкости и сравнить с экспериментальными значениями сpm и сvm.
4.Составить отчет о выполненной работе, который должен содержать: задание, основы теории (кратко), схему экс- пери-ментальной установки, таблицу опытных данных, обработку опытных данных и результаты опытов в виде таблицы.
Основы теории
При проведении расчетов процессов и аппаратов химической технологии часто необходимо знать количество подведенной или отведенной теплоты. Для их определения используется теплофизическая характеристика – теплоемкость.
Полная теплоемкость – отношение количества теплотыQ в бесконечно малом термодинамическом процессе к изменению температуры T в том же процессе.
C Q , кДж .
T град
28
В практических расчетах используется удельная теплоемкость.
Удельной теплоемкостью называется количество теплоты, которое необходимо подвести к единице количества вещества, чтобы изменить его температуру на 1 градус. В связи с этим определением различают:
удельную массовую теплоемкость
с |
|
Q |
|
|
|
кДж |
|
|
|
|
|||||||
|
|
|
|
|
, |
|
; |
|
|
(a) |
|||||||
|
|
m t |
|
|
кг град |
|
|
|
|||||||||
удельную объемную теплоемкость |
|
||||||||||||||||
с |
|
Q |
|
, |
|
|
|
кДж |
|
; |
|
(b) |
|||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
м3 град |
|||||||||||
|
|
V |
|
t |
|
|
|
||||||||||
|
|
|
н.у. |
|
|
|
|
|
|
|
ну |
|
|
|
|||
удельную мольную теплоемкость |
|
||||||||||||||||
|
|
с |
|
|
Q |
|
|
, |
|
кДж |
|
, |
(c) |
||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
L t |
|
кмоль град |
|
|||||||||
где m – масса газа, кг;
Vн.у., мну3 – объем газа, приведенный к нормальным условиям.
Приведение объема газа к нормальным условиям связано с тем, что количество вещества (газа) в единице объема зависит от давления р и температуры Т в этом объеме. Чтобы учесть их влияние, объем газа рассчитывают при сопоставимых (например, нормальных) условиях:
( |
PV |
|
PнVн |
Vн ..., |
Рн=760 мм рт. ст.=1,013 105 Па, |
T |
|
||||
|
|
Tн |
|
||
Тн=273 К);
L– число киломолей вещества (L=m/µ), кмоль;
молекулярная масса газа, кг/кмоль.
Тогда расчет теплоты, участвующей в процессе, можно произвести по уравнениям:
Qx сx m t сx' Vну t cx L t , кДж, (1)
где х – индекс, указывающий характер процесса подвода теплоты Qx, например, при p const(Qp), при v const (Qv).
29

Так как теплота является функцией процесса Q f (x) , то и теплоемкость также будут зависеть от характера этого же процесса, то есть с f (x). В связи с этим различают:
ср – изобарная теплоемкость; сv – изохорная теплоемкость.
Эти теплоемкости для идеальных газов связаны уравнением Майера:
сp сv R.
сp сv R.
Теплоемкость зависит от температуры в общем случае нелинейно с
(рис. 1 ,а):
сХ=a+bt+et2+….
При определении количества теплоты для нагревания при х const от t1 до t2 в этом случае применяют
t2
средние теплоемкости сxm (здесь
t1
индекс «m» означает «средний»!), которые при нелинейной зависимости рассчитываются по средним табличным
t
значениям теплоемкостей сxm , то есть
о
(2)
(2’)
а
 б
б
сХ=const в
t
Рис.1. Зависимость теплоемкости от температуры.
в интервале температур от 0 до t:
|
|
|
|
|
|
|
t2 |
t1 |
|
|
|
|
|
|
t2 |
q1 2,x |
|
сxm t2 сxm t1 |
|
кДж |
|
||
|
|
сxm |
|
о |
о |
, |
, |
||||
|
|
t2 t1 |
|
t2 t1 |
кг град |
||||||
|
|
|
t1 |
|
|
|
|
||||
где qх,1 2 |
|
Qх,1 2 |
|
удельная массовая теплота, кДж/кг. |
|||||||
m |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Следовательно |
|
t2 |
t1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
qp,1 2 сpm t2 сpm t1, |
|
|||||
|
|
|
|
|
|
|
о |
о |
|
|
|
(3)
(4)
30

или |
qp,1 2 |
h2 h1 , |
(4’) |
||
|
qv,1 2 |
|
t2 |
t1 |
|
|
сvm t2 |
сvm t11 , |
(5) |
||
оо
или |
qv,1 2 |
u2 u1, |
(5’) |
т.е. теплоту можно подсчитать как по значениям теплоемкостей, так и по значениям энтальпий h (при p const) и внут-
t
ренних энергий u (при v const ). Значения сxm , u и h приво-
о
дятся в справочной литературе в виде таблиц [1,2].
При уменьшении интервала температур в выражении (3) получим теплоемкость при заданной температуре t, называемую истинной теплоемкостью, сх,ист.
|
q |
х |
|
|
dq |
х |
с |
х ист . |
(6) |
lim |
|
|
|
|
|||||
t |
|
|
|||||||
|
t 0 |
|
dt |
|
|
||||
Со средней теплоемкостью она связана соотношением
|
|
2 |
|
t2 |
|
|
|
|
||
t1 |
q1 2,x |
|
dqx |
|
сx,истdt |
|
кДж |
|
|
|
сxm |
|
1 |
|
t1 |
, |
. |
(7) |
|||
t2 t1 |
t2 t1 |
t2 tt |
||||||||
|
||||||||||
t2 |
|
|
|
кг град |
|
|||||
Для приближенных расчетов можно учесть линейную зависимость теплоемкости от температуры (рис. 1, б):
t2 |
|
сxm a 2bt , |
(8) |
t1 |
|
где a и b – индивидуальные для каждого газа коэффициенты (из
таблиц [1]); t t1 t2 – средняя температура газа. 2
Из молекулярно-кинетической теории известно, что энергия, подведенная к системе, состоящей из множества частиц (молекул), распределяется равномерно по степеням свободы i этих частиц. Эта энергия в виде внутренней энергии в идеальном газе распределяется пропорционально степеням свободы поступательного и вращательного движения молекул.
31

Одноатомная молекула совершает только поступательное движение, то есть изменяется положение молекулы в координатах x, y и z и число степеней свободы i = 3.
Для двухатомной молекулы к трем степеням свободы поступательного движения добавляются две степени свободы вращательного движения вокруг атомов i = 3+2 = 5.
Для трех- и многоатомных газов число степеней свободы принимается равным i =3+3+1= 7 (3 степени свободы в поступательного движения, 3 степени свободы вращательного движения и 1 степень свободы, учитывающая внутримолекулярное движение атомов и силы взаимодействия между молекулами). В соответствии с этой теорией для идеальных газов (для реальных газов – при не очень высоких температурах на каждую степень свободы при v const расходуется энергияR2 8,3142 4,16кДж/(кмоль град). Поэтому постоянные, то
естьнезависящиеоттемпературы,мольные теплоемкости сv (рис.1,в)
можно определить, в зависимости от атомности газа, по числам степеней свободы i, а сp в соответствии с уравнением Майера
(2’) по (i + 2) из Таблицы 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
||||
Атомность |
|
|
|
|
|
|
|
|
сv , |
|
|
|
|
|
|
|
|
|
|
сp , |
|||||||||||||
газов |
|
|
|
|
кДж/(кмоль град) |
|
|
кДж/(кмоль град) |
|||||||||||||||||||||||||
1 атомные |
|
3 |
|
|
R |
|
|
3 |
8,314 |
|
12,56 |
|
3 2 |
|
|
R |
|
|
20,93 |
||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||
2 атомные |
|
5 |
R |
5 |
8,314 |
|
20,93 |
|
5 2 |
|
R |
|
29,31 |
||||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
||||||||
3 и |
|
|
|
|
7 |
R |
7 |
8,314 |
|
29,31 |
|
7 2 |
R |
37,68 |
|||||||||||||||||||
многоатомные |
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
||||||||||||
Для пересчета различных удельных теплоемкостей удобны |
|||||||||||||||||||||||||||||||||
соотношения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
с |
x |
|
сx |
, |
|
кДж |
; с' |
|
cx |
|
cx |
, |
|
кДж |
; |
||||||||||||||||||
|
|
|
|
кг град |
|
x |
|
v |
22,4 |
|
|
|
нм3 град |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
